牛源防御素类抗菌肽的生物信息学分析
张 炜,杭柏林,董萌萌,胡 斌,徐彦召,张慧辉,胡建和
(河南科技学院动物科技学院,河南 新乡 453003)
防御素(defensins)是一类阳离子多肽,是抗菌肽家族中的重要成员,有多种生物学活性,如抗菌、抗病毒、抗肿瘤和免疫调节等功能,且不易产生耐药性,其应用前景巨大[1-2]。防御素分布广泛,如哺乳动物、昆虫和植物等生物体内。根据二硫键连接方式的不同和半胱氨酸残基位置的差异,将防御素分为α-防御素、β-防御素和θ-防御素三大类[3-4],其中β-防御素的抗菌活性高效、抗菌谱广,如抗细菌、抗真菌、抗病毒和抗寄生虫等,对一些耐药性细菌也具有抑杀活性[5-6],但作用机制稍有差异,如hBD2可作用于结核分枝杆菌的细胞膜,而hBD3抑制葡萄球菌细胞壁的生成[7]。β-防御素的抗菌活性易受到离子种类和浓度的影响,如hBD2的杀白色念珠菌活性与盐离子浓度关系密切[8],合成的bBD-1对盐敏感,在低盐离子浓度时,对乳腺炎大肠杆菌分离株有抑杀活性,但对乳腺炎葡萄球菌分离株的抑杀作用较弱[9]。
防御素专业网站(http://defensins.bii.astar.edu.sg/)收集了不同生物的防御素,共363种,其中牛源防御素共17种,均属于β-防御素[10]。TAP是从牛气管黏膜上皮中发现的牛的第一个防御素[11]。牛源防御素类抗菌肽可分布于体内不同组织部位,如TAP可分布于牛的气管和肺泡巨噬细胞,BNBD5可分布于中性粒细胞、气管、肺泡巨噬细胞,bBD可分布于牛的乳头黏膜、肾、阴道、卵巢、结肠等[12]。不同的牛源防御素类抗菌肽有着不同的抗微生物活性,如BNBD4和BNBD5对大肠杆菌和金黄色葡萄球菌具有较好的抑杀活性[13],TAP对金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌、肺炎克雷伯菌、白色念珠菌具有较好的抑杀活性[12],LAP对金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌和白色念珠菌具有较好的抑杀活性[14]。
本研究利用在线生物信息学软件对牛源防御素类抗菌肽的理化性质、二级结构、磷酸化和糖基化位点等特征进行了分析,结合已知牛源防御素类抗菌肽的生物学活性,初步分析牛源防御素类抗菌肽的作用机制,为深入研究与应用牛源防御素类抗菌肽提供更多的信息基础资料。
1 材料与方法
1. 1 抗菌肽氨基酸序列 牛源防御素类抗菌肽的氨基酸序列主要来自于文献[10],其序列如表1所示。

表1 牛源防御素类抗菌肽的氨基酸序列Table 1 Amino acid sequence of AMPs in bovine defensins family
1.2 生物信息学分析方法 利用ProtParam进行理化性质的分析,利用SOMA进行二级结构分析,利用NetOGlyc 4.0 Server进行糖基化分析,利用NetPhos3.1Server进行磷酸化分析,利用Target P 1.1 Server进行亚细胞内定位。
2 结果与分析
2.1 牛源防御素的理化性质 从表2中可以看出,牛源防御素类抗菌肽由37~42个氨基酸残基构成;除了LAP、BNBD2、BNBD3、BNBD4和BNBD6的等电点大于10之外,其余牛源防御素类抗菌肽的等电点均大于9且小于或等于10(除BNBD1的等电点小于9),但仍然能表明这些抗菌肽应带正电荷;通过分析牛源防御素类抗菌肽的带电荷氨基酸数目,发现带正电荷氨基酸数目较多,最多的达10个正电荷氨基酸残基,而带负电荷的氨基酸残基数较少乃至缺乏,总体而言,牛源防御素类抗菌肽为带正电荷的多肽(即阳离子型抗菌肽)。
从表3中可以看出,牛源防御素类抗菌肽均可以通过紫外方法进行检测;对半衰期进行分析,发现EBD、BNBD2、BNBD8、BNBD11和BNBD12的半衰期相对较长,其他牛源防御素类抗菌肽的半衰期相对较短;对稳定性进行分析,发现TAP、bBD-1、BNBD2、BNBD3、BNBD7、BNBD8和BNBD9为稳定性多肽,其他牛源防御素类抗菌肽为不稳定多肽;对脂溶性指数进行分析,EBD的指数值最高(>80),应具有较好的耐热性能,BNBD10的指数值次之(>75),而其他牛源防御素类抗菌肽的指数值稍低,耐热性能应稍差;BNBD12和BNBD13的GRAVY值>0,表明其为疏水性多肽,而其他牛源防御素类抗菌肽的GRAVY值<0,表明其为亲水性多肽。BNBD7、BNBD9和BNBD10含有E(谷氨酸),仅BNBD1、BNBD2、BNBD3、BNBD6、BNBD7、BNBD8和BNBD9含有H(组氨酸),仅TAP、BNBD2、BNBD3、BNBD5和BNBD6不含有L(亮氨酸),仅BNBD4和BNBD5不含有K(赖氨酸),仅 EBD、bBD-1、BNBD2、BNBD3、BNBD6、BNBD7、BNBD8和BNBD9不含有M(甲硫氨酸),仅TAP、LAP、bBD-1和BNBD10不含有F(苯丙氨酸),仅BNBD6、BNBD7、BNBD8和BNBD9不含有S(丝氨酸),仅TAP、LAP、bBD-1、BNBD7、BNBD8和BNBD9不含有W(色氨酸),仅bBD-1、BNBD6和BNBD10含有Y(酪氨酸),仅bBD-1不含有V(缬氨酸)。
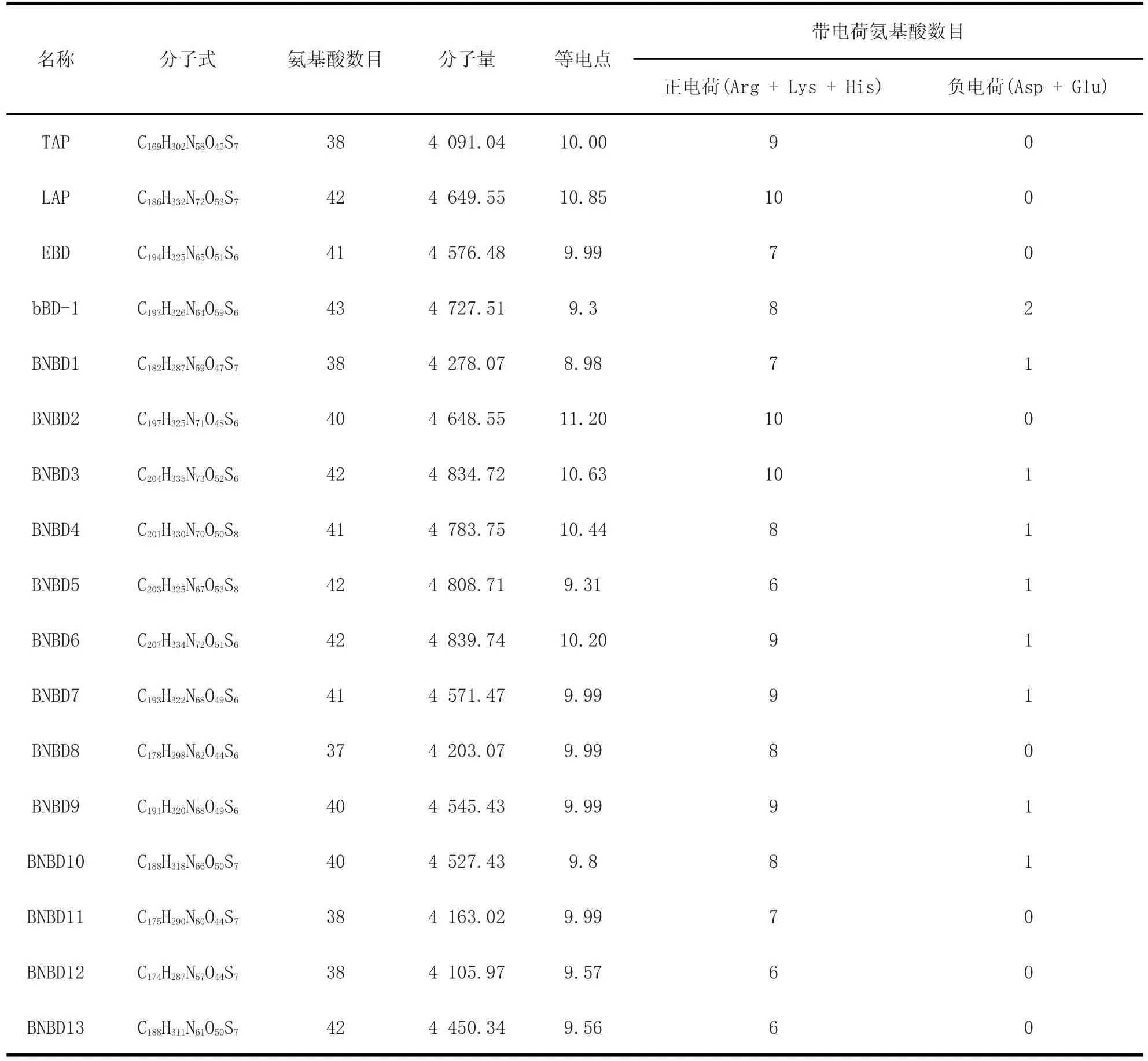
表2 牛源防御素的氨基酸数目、等电点、分子质量、带电氨基酸数目Table 2 Total number of amino acids,pI,MW and number of charged amino acids of bovien defensins
表4中可以看出,牛源防御素类抗菌肽TAP、LAP、EBD、bBD-1、BNBD1、BNBD2、BNBD3、BNBD4、BNBD5、 BNBD6、 BNBD7、 BNBD8、 BNBD9、 BNBD10、BNBD11、BNBD12和BNBD13分别由13、14、14、15、18、14、15、15、14、15、14、13、14、17、15、15和15种不同的氨基酸残基构成,均含有的氨基酸包括R(精氨酸)、N(天冬酰胺)、C(半胱氨酸)、Q(谷氨酰胺)、G(甘氨酸)、I(异亮氨酸)、P(脯氨酸)和T(酪氨酸),仅TAP、LAP、bBD-1、BNBD1和BNBD10含有A(丙氨酸),仅bBD-1和BNBD1含有D(天冬氨酸),仅 bBD-1、BNBD3、BNBD4、BNBD5、BNBD6、

表 3 牛源防御素的紫外检测、半衰期、稳定性、脂溶性和亲水性等信息Table 3 Detection with UV,half life,stability,index of fatty amino acids and hydrophily of bovine defensins
2.2 牛源防御素的二级结构 牛源防御素的二级结构预测(参数:视窗宽度为17,相似度阈值为8,状态数目为4)结果如表5所示。从表5中可以看出,TAP、LAP、bBD-1、BNBD2、BNBD3、BNBD4、BNBD6、BNBD7、BNBD8和BNBD10由α螺旋、β折叠、β转角和无规则卷曲构成,EBD、BNBD1、BNBD5、BNBD11、BNBD12和BNBD13由β折叠、β转角和无规则卷曲构成;在17种牛源防御素类抗菌肽中,BNBD10的α螺旋含量最高,BNBD8的β折叠含量最高,LAP的β转角含量最高,EBD的无规则卷曲含量最高。
2.3 牛源防御素的细胞内定位 经在线软件分析,牛源防御素EBD、BNBD2、BNBD4、BNBD8、BNBD11定位于线粒体,而其他防御素可能定位于细胞外。
2.4 牛源防御素的糖基化和磷酸化位点 经在线软件分析,牛源防御素类抗菌肽不存在糖基化。从表6中可以看出,除BNBD7不存在磷酸化位点外,其他16种防御素类抗菌肽存在丝氨酸和苏氨酸的磷酸化位点,但不存在酪氨酸的磷酸化位点;不同的防御素有不同数目的磷酸化位点,最高的如bBD-1有6个位点的磷酸化,EBD次之,其他的有1~3个磷酸化位点;有的位点可被多种激酶磷酸化,如防御素LAP的第6位点的丝氨酸(S)可被unsp、PKA、DNAPK和ATM等激酶磷酸化。

表 4 牛源防御素的氨基酸组成Table 4 Amino acid composition of bovine defensins

表 5 牛源防御素的二级结构Table 5 Secondary structure of bovine defensins
3 讨论
绝大多数抗菌肽是阳离子型的,其抗菌作用与带正电荷的氨基酸残基有关。抗菌肽的带正电荷氨基酸残基与带负电荷的细菌细胞膜相结合,然后通过不同的作用机制(如桶板模型、地毯模型、虫孔模型和凝聚模型等)发挥抑菌或杀菌活性[15-16]。精氨酸、赖氨酸和组氨酸等带正电荷的氨基酸与抗菌肽的抗菌活性有密切关系[17-18]。牛源防御素类抗菌肽的一级结构中存在较多的精氨酸、赖氨酸和组氨酸等碱性氨基酸,使其具有5~10个净正电荷,这应是牛源防御素类抗菌肽发挥抑菌或杀菌活性的重要基础。
不同抗菌肽的二级结构是不同的[12]。例如,抗菌肽LK为α螺旋形[19],抗菌肽HNP-2为β折叠型[20]。抗菌肽的二级结构主要由α螺旋、β折叠、β转角和无规则卷曲等构成。在牛源防御素类抗菌肽的二级结构中,无规则卷曲结构所占比例最高。而无规则卷曲结构有利于抗菌肽的稳定性。Lee等[21]认为这种稳定性与甘氨酸有关。牛源防御素类抗菌肽的氨基酸序列中均含有一定比例的甘氨酸。因此,可以认为甘氨酸对牛源防御素类抗菌肽的稳定性具有重要作用。
不同抗菌肽的亚细胞定位是不同的[22]。例如,鸡内源性抗菌肽NK-lysin定位于细胞质内[23],鸡内源性抗菌肽LEAP-2定位于细胞核内[24]。经分析,牛源防御素类抗菌肽仅少数定位于线粒体,大多数定位于细胞外。对于定位于细胞外的牛源防御素类抗菌肽,可能是其前原肽在信号肽的引导下到达细胞外等靶标部位,在某些酶的作用下,产生抗菌肽的成熟肽,从而对细胞外的病原微生物或肿瘤细胞发挥拮抗作用,或与其受体结合而发挥免疫调节作用。对于定位于线粒体的牛源防御素类抗菌肽,可能其对线粒体等细胞器具有一定作用,但究竟是何种作用还值得深入探讨。
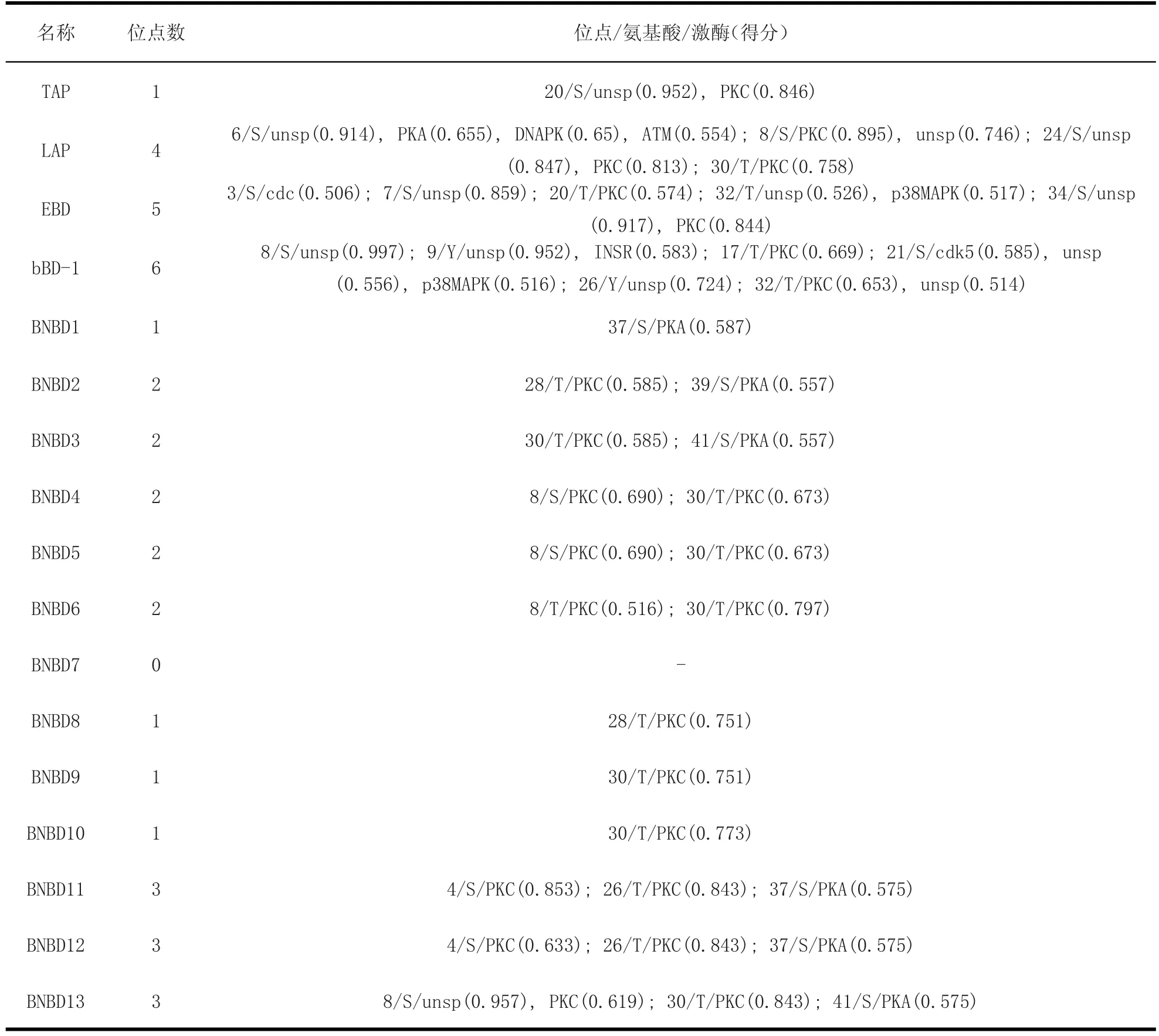
表 6 牛源防御素的的磷酸化位点Table 6 Phosphorylation site of bovine defensins
蛋白磷酸化在细胞分化、凋亡、信号传递和免疫等生物学过程中具有调节作用[25]。肌红蛋白发生磷酸化修饰后,二级结构发生改变,稳定性降低[26],但C/EBPβ蛋白的磷酸化修饰能增强其在3T3-L1前脂肪细胞成脂分化过程中的稳定性[27]。经预测发现,除了BNBD7外,牛源防御素类抗菌肽存在不同数目的丝氨酸和苏氨酸的磷酸化位点。可以推测,牛源防御素类抗菌肽发生磷酸化后,其二级结构会发生相应改变,但这种改变对牛源防御素类抗菌肽的稳定性、抗菌活性等生物学功能有何具体影响还值得深入研究。

