6-BA与ZT对芫花茎段外植体组织培养的影响
张 虎,巫建新,许建民,宋 微
(江苏农林职业技术学院,江苏 句容 212400)
芫花(DaphnegenkwaSieb.et Zucc.)为瑞香科瑞香属落叶灌木,主要分布在中国黄河流域以南地区。芫花花期在春季,花常3至7朵簇生于短花轴上,先于叶开放,其花朵锦簇,花色艳丽,具有较高的观赏价值,为我国优良野生花卉资源[1-3]。芫花性寒,有毒,全株可入药,是我国重要的中药材和生物农药[4-6]。
从20世纪60年代开始,尤其是90年代以后,芫花的生境遭到严重破坏,种群分布范围缩小,居群数量及个体数量急剧下降,其野生可利用资源逐渐减少[7]。研究芫花的繁殖技术成为保护和利用该植物资源的迫切要求。采用组织培养方法繁殖芫花,可保持母本优良性状,为优良单株的快速扩大繁殖提供有效途径。
国内外对芫花的药理学研究表明,芫花含有黄酮苷元等多种药用成分,其不同器官中所含药物成分及其含量不尽相同,通过不同加工与炮制方法,可有效提高其药用成分含量,其药用成分具有抗早孕、抗炎、抗肿瘤活性等作用[8-14]。对芫花生物农药的研究表明,芫花具有β-谷甾醇、雪松醇等杀虫活性成分,其提取物对抑制、杀死天牛和尺蠖等害虫具有活性[15-17]。对芫花抑菌效果的研究表明,芫花提取物具有多种抑菌成分,对辣椒疫霉病、番茄灰霉病等植物病原菌具有抑菌活性[18-19]。但对芫花作为观赏植物的研究相对较少,董春玲等对芫花开发成新花卉作物的前景进行了分析,初步探讨了其在园林应用的主要形式[20]。目前关于芫花繁殖与栽培技术的相关研究不多,其茎段外植体组织培养快速繁殖技术在国内外尚未见报道。
本研究以芫花茎段为外植体,研究其初代组织培养技术,以建立可以快速繁殖的芫花组织培养技术体系,为芫花种质资源保存、工厂化育苗等研究提供技术参考。
1 材料与方法
1.1 材料
芫花母本植株选自江苏省句容市,江苏农林职业技术学院林木种质资源圃。芫花茎段外植体采自野生芫花优株播种繁殖的2年生苗。芫花组织培养试验于2016年10月在江苏农林职业技术学院园艺工程中心植物组织培养室内进行。
1.2 方法
采集生长健壮,腋芽饱满,无病虫害的芫花当年生枝条,去除叶片,剪截成10 cm左右带腋芽茎段,用洗衣粉液浸泡,清洗20 min,接着用流水冲洗12 h。
在超净工作台上,把外植体剪为3—4 cm茎段,用无菌水冲洗3遍。采用75%乙醇消毒茎段30 s,放入0.1%的升汞加3—5滴吐温80的混合液浸泡消毒,处理时间分别为8,10,12,14 min;用无菌水冲洗后,剪截成2 cm左右具节茎段,接入MS固体培养基;每处理茎段30个,重复3次。
用消毒获得的无菌带芽茎段进行初代培养试验。采用MS+0.2 mg/L NAA+(0.5,2.0,5.0) mg/L 6-BA和MS+0.1 mg/L NAA+(1.0,1.5,2.0) mg/L ZT,共6个处理进行试验。每处理30个茎段,重复3次。
1.3 培养基与培养条件
将接种外植体置于培养室进行培养,室内温度(24±1) ℃,相对湿度75%,光照强度2 500 lx,光周期L14∶D10 ,培养25 d。MS固体培养基加入蔗糖30 g/L及琼脂7 g/L,按配方质量浓度加入植物生长调节剂及调整酸碱度至pH为5.8。
1.4 数据处理
观测污染率、死亡率、存活率、萌发率、玻璃化率、萌芽均高等指标,数据统计均在培养25 d时进行,数据采用 SPSS 软件进行方差分析和多重比较。相关指标计算如下:
污染率(%)=(外植体污染数/接种外植体总数)×100;
死亡率(%)=(外植体死亡数/接种外植体总数)×100;
存活率(%)=100-污染率(%)-死亡率(%);
萌发率(%)=(腋芽萌发的外植体数/接种外植体总数)×100;
玻璃化率(%)=(玻璃化外植体数/接种外植体总数)×100;
萌芽均高(cm)=萌发新梢长度之和/接种外植体总数。
2 结果与分析
2.1 消毒方式对外植体灭菌效果的影响
2.1.1 预处理无流水冲洗环节的消毒方法对芫花茎段外植体灭菌效果的影响 预处理采用洗衣粉液浸泡芫花茎段外植体20 min,消毒采用75%乙醇30 s+0.1%升汞8—14 min进行灭菌处理,并调查污染率,将污染率数据进行方差分析,试验结果见表1。

表1 预处理无流水冲洗环节的消毒方法对芫花茎段外 植体灭菌效果的影响
同列数据后相同小写字母表示差异不显著(P>0.05)
预处理无流水冲洗环节的消毒方法对芫花茎段外植体消毒处理的污染率为87.8%—100.0%,各处理无显著差异。由此可知,预处理过程中无流水冲洗环节的消毒方法,污染率高,外植体消毒效果不理想。
2.1.2 预处理加流水冲洗环节的消毒方法对芫花茎段外植体灭菌效果的影响 预处理采用洗衣粉液浸泡芫花茎段外植体20 min,接着用流水冲洗12 h;然后采用75%乙醇30 s +0.1%升汞加3—5滴吐温80混合液8—14 min进行灭菌处理,结果见表2。
表2 预处理加流水冲洗的消毒方法对芫花茎段外植体灭菌效果的影响

处理污染率/%死亡率/%存活率/%75%乙醇30 s+升汞吐温混合液8 min91.1 a3.3 b5.6 c75%乙醇30 s+升汞吐温混合液10 min70.0 b8.9 b21.1 b75%乙醇30 s+升汞吐温混合液12 min57.8 bc13.3 b28.9 a75%乙醇30 s+升汞吐温混合液14 min44.4 c35.6 a20.0 b
同列数据后不同小写字母表示差异显著(P<0.05)
预处理加流水冲洗环节的消毒方法其污染率随消毒时间的延长逐渐下降。消毒8 min处理的污染率为91.1%,显著高于其他各处理;消毒14 min污染率最低,为44.4%,显著低于8,10 min处理;消毒12,14 min处理污染率差异不显著。
预处理加流水冲洗环节的消毒方法茎段外植体死亡率随消毒时间的延长逐渐上升。消毒14 min死亡率为35.6%,显著高于其他各处理;消毒8,10,12 min的处理,其死亡率均在13.3%以下,各处理间差异不显著。
预处理加流水冲洗环节的消毒方法茎段外植体的存活率数据分析表明,消毒8min处理的存活率为5.6%,效果最差,显著低于其他处理;消毒10 min和14 min存活率为21.1%和20.0%;消毒12 min效果最好,存活率达28.9%,显著高于其他处理。
综合分析污染率、死亡率与生存率的试验结果可知,芫花茎段外植体的最佳消毒方法为预处理采用洗衣粉液浸泡芫花茎段外植体20 min,接着用流水冲洗12 h;消毒采用75%乙醇30 s+0.1%升汞吐温80混合溶液12 min处理,其污染率为57.8%,死亡率为13.3%,存活率为28.9%。
2.2 6-BA与ZT质量浓度对初代培养的影响
采用6-BA与ZT不同质量浓度的植物生长调节剂配方处理对芫花茎段外植体萌发与生长情况的影响见表3。
6-BA与ZT不同质量浓度处理芫花茎段外植体,对萌芽率的影响结果表明,6-BA各质量浓度处理其萌芽率在34.4%以下,ZT各质量浓度处理其萌芽率在74.4%以上,6-BA处理萌芽率显著低于ZT处理。由此可知,对芫花的外植体的初代培养细胞分裂素采用ZT,对芫花茎段外植体芽萌发的促进效果显著优于6-BA。在不同生长调节剂配方处理中,MS+0.1 mg/L NAA+1.5 mg/L ZT处理对芫花茎段外植体芽萌发效果显著优于其他处理,萌发率达到92.2%。
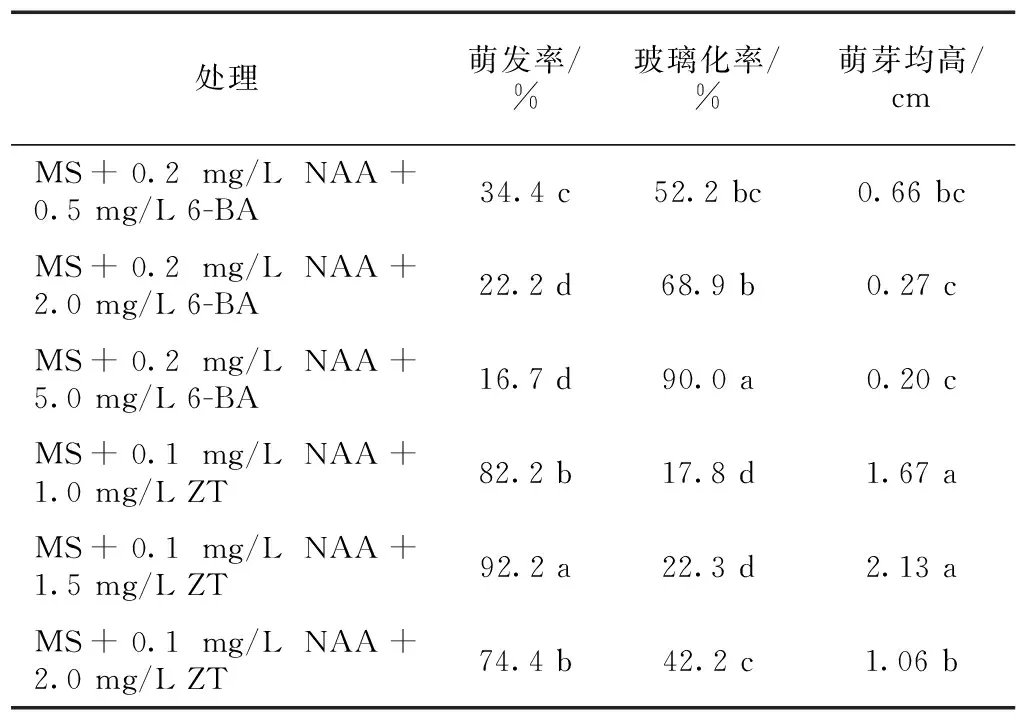
表3 6-BA与ZT质量浓度对芫花茎段初代培养的影响
同列数据后不同小写字母表示差异显著(P<0.05)
6-BA与ZT不同质量浓度处理芫花茎段外植体,对玻璃化率的影响结果表明,随着细胞分裂素6-BA与ZT质量浓度升高,芫花茎段外植体初代培养玻璃化现象逐渐加剧。6-BA处理玻璃化率在52.2%以上,ZT处理玻璃化率在42.2%以下,6-BA处理玻璃化率显著高于ZT处理。在不同生长调节剂配方处理中,MS+0.1 mg/L NAA+1.0 mg/L ZT 处理与MS+0.1 mg/L NAA+1.5 mg/L ZT处理,对芫花茎段外植体初代培养中减少玻璃化现象显著优于其他处理,玻璃化率小于22.3%。
6-BA与ZT不同质量浓度处理芫花茎段外植体,对萌芽平均高度的影响结果表明,6-BA处理萌芽均高在0.66 cm以下,ZT处理萌芽均高在1.06 cm以上,6-BA处理萌芽均高显著低于ZT处理。在不同生长调节剂配方处理中,MS+0.1 mg/L NAA+1.0 mg/L ZT 处理与MS+0.1 mg/L NAA+1.5 mg/L ZT处理,对芫花茎段外植体初代培养中萌芽平均高度显著优于其他处理,萌芽均高分别为1.67 cm和2.13 cm。
综合分析萌发率、玻璃化率与萌芽均高的试验结果可知,芫花茎段外植体初代培养诱导丛生芽的最佳配方为MS+0.1 mg/L NAA+1.5 mg/L ZT,其萌发率为92.2%,玻璃化率为22.3%,萌芽均高为2.13 cm。
芫花茎段外植体诱导丛生芽,不同历时的生长情况见图1。

图1 芫花茎段外植体初代培养生长情况
3 结论与讨论
综上所述,芫花茎段外植体的最佳消毒方法,为预处理采用洗衣粉液浸泡20 min,用流水冲洗12 h;消毒采用75%乙醇30 s+0.1%升汞吐温80混合溶液12 min处理,其污染率为57.8%,死亡率为13.3%,存活率为28.9%。芫花茎段外植体初代培养诱导丛生芽的最佳配方为MS+0.1 mg/L NAA+1.5 mg/L ZT,其萌发率为92.2%,玻璃化率为22.3%,萌芽均高为2.13 cm。
植物组织培养过程中,外植体带菌是最主要的污染来源[21]。外植体体表被毛或表面粗糙则消毒困难,采用乙醇、升汞等杀菌剂消毒,消毒时间短则污染率高,延长消毒时间则会导致外植体中毒致死加剧[22]。消毒预处理过程中,外植体采用流水冲洗有助于去除附着在体表组织的污物,在消毒溶液中添加表面活性剂吐温,有助于杀菌剂浸润外植体表面,进而提高杀菌效果[23]。芫花茎段外植体消毒效果试验表明,预处理增加流水冲洗环节,升汞消毒添加吐温80,是提高其外植体消毒效果的有效途径。这与芫花新梢表面密被茸毛、污染物不易清洁的特性相关。
植物体细胞具有全能性,实践中愈伤组织能否表达其全能性,进而产生丛生芽具有不确定性。本试验采用芫花茎段外植体,诱导丛生芽的初代组织培养方法,较张恒基等采用腋芽外植体脱分化形成愈伤组织[24],进一步诱导丛生芽的培养方法更为便捷。2种方法研究思路不同,可互为补充。
植株生长发育过程与植株的内源和外源激素种类、含量及配比等有密切关系[25]。植物对于不同外源激素的响应成因复杂。本试验芫花茎段外植体的初代培养中,细胞分裂素ZT对芫花茎段芽萌发与生长的促进效果明显优于6-BA,这一结论与张恒基等对芫花愈伤组织分化成芽和不定芽增殖试验研究结论相似[24]。这一结果表明,芫花茎段外植体组织培养时,在芽的分化、萌发、长成阶段,ZT作为外源激素具有重要促进作用,6-BA不可替代其作用。
植物组织培养过程的玻璃化苗发生百分率和细胞分裂素成正相关,其中6-BA的影响大于ZT和KT[26]。本试验中,6-BA较ZT更容易导致芫花试管苗的玻璃化现象,这一结论与陈兵先等结论相一致[26]。本试验中,ZT的质量浓度为1.0—1.5 mg/L,其玻璃化率维持在17.8%—22.3%之间;ZT的质量浓度达到2.0 mg/L时,玻璃化率升高至42.2%,显著高于ZT其他处理。从本试验结果看,芫花茎段外植体组织培养中,ZT质量浓度应限制在 2.0 mg/L以下。
张慧君等研究认为,植物的外源激素须通过对内源激素的调节,来控制器官的生长发育,各种植物生长物质的水平,都通过影响植物外植体的基因表达而引起器官分化[27]。芫花组织培养休眠芽的萌发、愈伤组织分化成芽、成枝的过程中,外源激素如何影响内源激素,进而完成形态构成的机理,还有待进一步研究。

