咖啡浓度对咖啡牛奶体系稳定性 及消化行为的影响
张志鹏,蒋 将,刘元法
(江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡 214122)
咖啡牛奶是一种新型功能性饮品,飘香醇厚的咖啡加上芳美浓郁的牛奶,从而形成了具有双重口感享受的饮品。它不仅风味独特,而且还具有咖啡的生物学功能,现今流行病学家研究发现,长期饮用咖啡可以降低2型糖尿病[1]、结肠癌[2]和心血管疾病[3]的发病率和死亡率,这都归功于咖啡中富含的酚酸,特别是氢化肉桂酸(咖啡酰奎宁酸、阿魏酸奎宁酸、咖啡酸)[4],因为酚酸可以改善能量代谢、减少体内脂肪、提高肝脏脂肪分解代谢能力[5],从而增加人体健康;而体系中的牛奶是成人和婴儿摄取蛋白质的主要来源,也为人体提供了生长发育所需要的能量和氨基酸,因此咖啡牛奶作为一种新型饮品深受大家喜爱,现已在日本软饮料市场占有很大的比例[6]。
但是研究发现当体系中咖啡提取物的含量过高时,咖啡牛奶将变得不稳定,有些甚至出现脂肪分离、氧化等现象[7]。现在主要通过添加合适的乳化剂来达到稳定体系的效果,国内研究发现硬脂酰乳酸钠、单甘酯和蔗糖酯以3∶4∶2的比例复配形成的复合乳化剂的稳定效果最好[7];国外研究发现高亲水亲油平衡值(HLB)的蔗糖酯和甘油二酯将加速体系的分离,而聚甘油酯则抑制体系的分离[6]。除此之外,现在大量的研究已经证实咖啡中的酚酸将导致牛奶中蛋白质的二级和三级结构发生变化,从而达到促进或抑制蛋白消化能力的作用[8],但是很少有研究对咖啡牛奶的体外胃、肠模拟消化行为进行表征。
因此,本文采用新型乳液稳定性评价手段Turbiscan Lab多重光散射仪以及马尔文纳米粒度/电位仪,来研究不同咖啡浓度对咖啡牛奶体系稳定性的影响;之后对不同样品进行体外模拟胃、肠消化,以不同消化阶段体系的微观结构和蛋白电泳作为评价手段,来表征咖啡浓度对咖啡牛奶消化行为的影响。以期为咖啡牛奶的研究开发提供一定的依据。
1 材料与方法
1.1 材料与仪器
星巴克研磨咖啡粉、纸质滤膜 无锡星巴克咖啡店;全脂奶粉 新西兰恒天然有限公司;胃蛋白酶(3000 U/mg)、胰蛋白酶(2500 U/mg)、四甲基乙二胺(TEMED)、AB-3(49.5%聚丙烯酰胺和3%双丙烯酰胺混合储备液) 西格玛奥德里奇上海贸易有限公司;猪胆盐、过硫酸铵、甘油 国药化学试剂公司;其他试剂 均为分析纯。除另有说明外,所有浓度均以重量百分比为基础(即 w/w,%)表示。
Turbiscan Lab多重光散射仪 法国Formulaction公司;电泳仪、凝胶成像仪 美国Biorad公司;JJ-1B 强力恒速电动搅拌器 金坛市金南仪器厂;纳米粒度及Zeta电位仪(Zetasizer nano ZS) 英国马尔文公司;激光共聚焦显微镜(LSM710) 德国蔡司公司。
1.2 实验方法
1.2.1 不同咖啡含量的乳化液体系制备 10 g速溶咖啡粉和25 g全脂奶粉分别溶解于100、50 ℃的100 mL去离子水中,并将咖啡液通过纸质滤膜进行过滤;溶解完全后,分别取50、25、12.5 mL的咖啡滤液与50 mL的全脂牛奶在室温下混合,并添加相应量的去离子水,得到50%高浓度咖啡(H)、25%中浓度咖啡(M)、12.5%低浓度咖啡(L)以及不添加咖啡滤液的全脂牛奶空白(C)四种不同体系,室温下混合30 min后,通过高压均质机以30 MPa的均质压力,均质两次后放入4 ℃冰箱中,进行下一步体系稳定性和体外模拟胃、肠消化行为研究。
1.2.2 背散射光强度和稳定性指数 采用Turbiscan Lab多重光散射仪对样品进行乳液稳定性指数测定。移取20 mL样品于特制的石英样品瓶中(取样过程中尽量不要将样品撒到试剂瓶壁上),放入Turbiscan Lab多重光散射仪中,使用近红外光(λ=880 nm)从样品瓶底部开始扫描,经中部到顶部扫描一次。设置扫描间隔30 s,扫描时长1 h。,将实验温度设为50 ℃,进行加速实验。得到不同时间乳化液背散射光强度曲线图,以及不同时间乳化液的稳定性指数,该值越小,体系就越稳定[9]。
1.2.3 粒径测定 用磷酸盐缓冲液(0.01 mol/L,pH7.0)将样品稀释500倍,通过马尔文纳米粒度仪对样品进行5次重复测量,测量开始前的平衡时间设定为1 min,温度为25 ℃,扫描角度为120 °,扫描时间为120 s,波长为632.8 nm,以水为溶剂,折射率为1.333。
1.2.4 Zeta 电位分析 样品用磷酸缓冲液(0.01 mol/L,pH7.0)稀释500倍,用马尔文纳米电位仪对乳化液中粒子的表面电位进行测定,设定温度25 ℃。
1.2.5 体外模拟肠胃消化 根据Tang等[10]的方法对不同样品进行体外模拟胃、肠消化,并做了一些改进。将10 mL样品与10 mL胃液(2 g NaCl和7 mL浓HCl混合,用去离子水稀释至1 L;胃蛋白酶(E/S:1∶20))在37 ℃水浴中进行混合,用0.1~1 mol/L的HCl调节pH至2.0,之后在37 ℃的水浴条件反应1 h。反应结束后立刻用0.9 mol/L的NaHCO3将体系pH调至5.3,用1 mol/L的NaOH 继续调节pH至7.5,加入胰蛋白酶(E/S:1∶20),混匀后37 ℃下反应1 h。将不同消化阶段的消化液于沸水中灭酶10 min终止反应,4 ℃环境下冷藏,进行下一步电泳和共聚焦显微镜分析。
1.2.6 十二烷基磺酸钠-聚丙烯酰胺凝胶电泳分析(SDS-PAGE) 根据Schägger等[11]的方法,用4%浓度的浓缩胶(0.712 mL AB-3,1.5 mL 电泳缓冲液(Tris buffer),4.5 μL四甲基乙二胺(TEMED),45.1 μL 10%过硫酸铵,3.88 mL水)和16%浓度的分离胶(1.2 mL甘油,4.9 mL AB-3,4 mL Tris buffer,4 μL TEMED,40 μL 10%过硫酸铵,2.3 mL水)。将样品溶解在样品缓冲液(25 mL 0.5 mol/L Tris buffer,20 mL甘油,40 mL 10%十二烷基硫酸钠(SDS),15 mL水,pH6.8)中,调整蛋白质最终浓度为2 mg/mL,上样量为15 μL。在恒定电压下进行凝胶电泳,初始电压为30 V,直到样品经过浓缩胶,进入分离胶后,调节电压为120 V。蛋白凝胶经染色和脱色后,在凝胶成像仪中进行电泳图像采集。
1.2.7 共聚焦显微镜 吸取1 mL不同消化时间的消化液与20 μL的尼罗红(w/v,0.1%)混匀,避光条件下放置30 min染色,用取样针将样品点于载玻片上,用硅油密封盖玻片的边缘,放置显微镜下进行观察。参数设置:显微镜放大倍数:×50;尼罗红的激发波长是514 nm。
1.3 数据处理
本次实验所得数据均为3次重复3次平行实验,结果均以平均值±标准偏差表示,图表由Origin 8.0和Sigmaplot 12.5软件制作,显著性分析使用SPSS 18.0软件Duncan法(p<0.05)。
2 结果与分析
2.1 乳液稳定性
如图1所示,与空白组相比,样品瓶底部的背散射光强度降低,其中高含量咖啡体系最明显(下降了5%);而样品瓶顶部的背散射光呈现略微下降的趋势,这表明咖啡含量的升高会导致体系底部乳化液油滴浓度的降低以及顶部轻微降低的现象;中部背散射光强度升高,并且出现了明显的波动,这说明随着咖啡含量的升高,体系的稳定性变差。这可能由于咖啡导致全脂奶溶液底部和顶部的油滴向中部聚集,从而导致体系的稳定性降低[12]。

图1 不同咖啡含量体系样品1 h内的背射光强度图谱Fig.1 Back light intensity spectra of samples with different coffee contents within 1 h
另外,可以用简单的稳定性动力学指数(Stability Index,TSI)表征整个体系的稳定性。图2表明,经过1 h的加速实验,空白组的稳定性指数呈直线上升趋势,最终达到了1.2;但是添加咖啡的样品,无论是低浓度体系还是高浓度体系,经过1 h的加速实验,TSI均显著提高,分别达到了1.4、1.8、2.1。文献[13]报道背散射光强变化越大,稳定性指数升高,测量体系就越不稳定。

图2 不同咖啡含量体系样品1 h内的稳定性指数变化曲线Fig.2 TSI curves of samples with different coffee contents within 1 h
2.2 粒径测定
体系粒径减少会导致乳液中分散粒子的相互作用增大,从而提高乳液的稳定性。图3为不同含量咖啡乳液体系最小平均粒径的粒径分布图。图4为其相应的平均粒径和多分散指数(PDI)。从粒径分布图得知,随着咖啡浓度的升高,乳液体系的粒径分布整体向右移,在5000 nm处出现一个小峰,并且咖啡浓度越高,该峰就越大。随着咖啡浓度的增加,平均粒径从306 nm增加到了643.6 nm(高浓度咖啡体系),结合图2的实验结果,粒径增大可能是由于咖啡的加入导致体系的不稳定,发生了一定程度的聚集;除此之外,空白组为单峰分布状态,并且粒径分布很窄,咖啡加入到全脂奶中,体系变为双峰分布状态,且粒径的分布变宽,PDI值增大(从0.34增加到0.48)。这可能由于咖啡是混合物,里面含有很多大分子物质,咖啡含量越高,体系的组成越复杂,混乱度增加,从而导致液滴尺寸向非均匀性发展,多分散指数增大。

图3 不同咖啡含量体系样品的粒径分布图Fig.3 The particle size distribution of different coffee content system samples
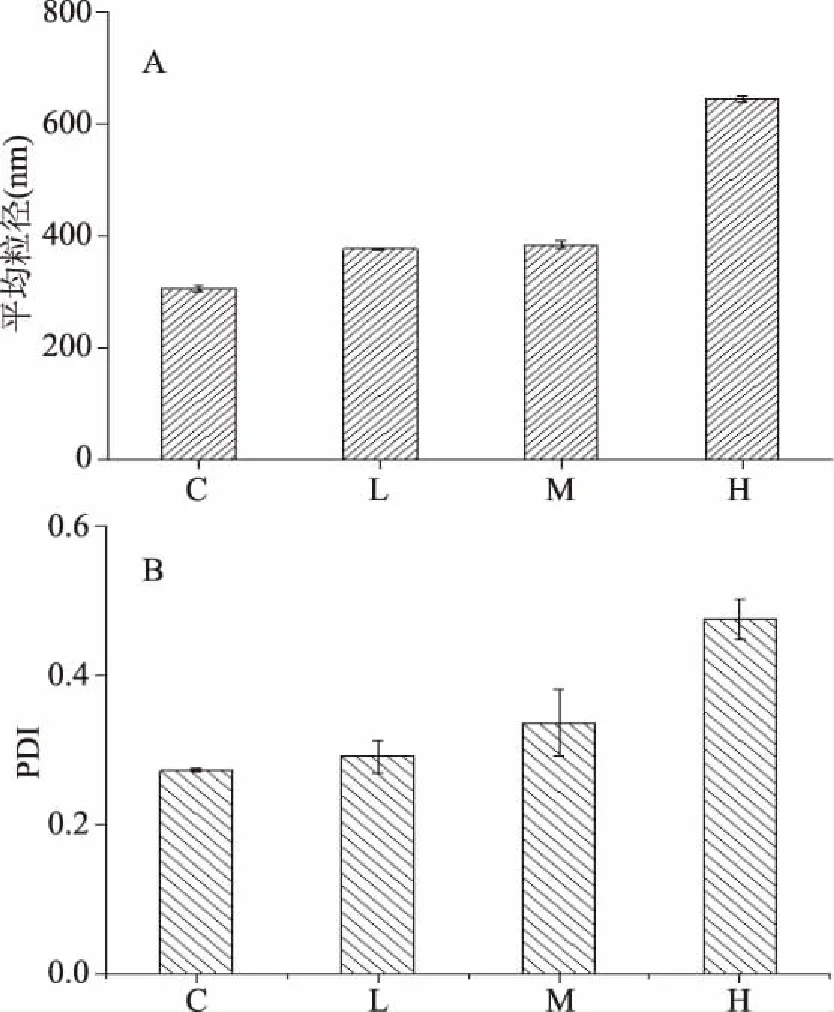
图4 不同咖啡含量的体系样品的平均粒径(A)和PDI(B)Fig.4 The average particle size(A)and polydispersity index(B)of different coffee content system samples
2.3 电位分析
与空白样品的Zeta电位相比,添加咖啡会导致体系电位绝对值降低,并且随咖啡浓度升高下降越明显。乳液的稳定是由液滴间的静电排斥维持的,因此体系电位值下降也是导致体系稳定性降低的一个原因。除此之外,Zeta-电位在某种程度上反映了油-水界面上蛋白质分子间的斥力[14],这表明咖啡的添加导致乳液中蛋白质分子间的排斥力下降。一些研究表明,咖啡中的酚类化合物与蛋白质共价结合会导致蛋白质分子中的净电荷发生改变,进而影响蛋白的表面性质[15]。

图5 不同咖啡含量的体系样品的Zeta电位Fig.5 Zeta Potential of different coffee content system samples
2.4 十二烷基磺酸钠-聚丙烯酰胺凝胶电泳分析(SDS-PAGE)
全脂牛奶中主要的蛋白是酪蛋白(CN)和乳清蛋白(WPI),如图6所示,在消化过程中,无论咖啡浓度的高低,所有蛋白质亚基都降解为了小分子物质。α-CN和β-CN,在胃水解1 h后,电泳图中只剩下少量小肽,再经过1 h肠水解,电泳图上几乎已经看不到肽,Sarkar A等[16]发现在胃消化15 min时,β-CN和κ-CN已被完全消化,1 h后只能检测到少量α-CN。β-Lg和α-La,发现胃消化1 h后,α-La已被完全水解,而β-Lg还有些许残留,Pena-Ramos[17]等人也发现了相似的现象。不同咖啡浓度体系间蛋白肽条带趋势变化基本相同,说明咖啡的添加对体系中蛋白消化没有负面影响。

图6 不同咖啡含量体系样品的模拟肠胃消化的电泳图Fig.6 The electrophoresis patterns simulating digestion of different coffee content systems
2.5 共聚焦显微镜
如图7所示,在体外模拟胃、肠消化过程中,不同样品消化液的微观结构存在差异。在模拟胃消化阶段,胃液中较低的pH和较高的离子强度将削弱整个体系的静电作用力,通过降低液滴间的静电斥力导致体系的聚集现象;除此之外,胃液中胃蛋白酶的存在使液滴表面的蛋白分子水解,从而促进液滴的聚集[18]。但是高含量咖啡体系出现了较大的聚集体,这说明高含量的咖啡会促进更多油滴的暴露、聚集;而体外模拟肠消化过程中,油滴聚集体消失,可能是由于肠消化过程中添加的胆盐,它是一种较好的乳化剂,从而形成新的乳液滴。

图7 不同咖啡含量体系样品的 模拟肠胃消化的微观图(×50)Fig.7 Confocal microscopy images simulating digestion of different coffee content systems(×50)
3 结论
随着咖啡浓度的升高,咖啡牛奶体系稳定性下降,特别是50%高浓度咖啡体系,1 h内的TSI升高了0.9;平均粒径增加了337.6 nm;电位值降低了6。体外模拟胃、肠消化,不同阶段的SDS-PAGE以及共聚焦显微图表明咖啡含量对体系中蛋白的消化没有负面影响;但是与空白相比,咖啡含量较高的体系(25%、50%)在体外模拟胃的消化过程中,会促进油滴的暴露,从而产生较大的油脂聚集体。这些结果表明,随着咖啡浓度升高,体系稳定性下降,且在体外模拟胃消化过程中促进油滴的暴露与聚集,但对体系中蛋白的消化无负面影响。

