黄曲霉毒素B1降解菌的筛选及鉴定
王 威,谢岩黎
(河南工业大学粮油食品学院,河南郑州 450001)
黄曲霉毒素(Aflatoxin,AFT)是一组由黄曲霉(Aspergillus.flavus)和寄生曲霉(Aspergillus.nomius、Aspergillus.parasiticus、Aspergillus.tamarii)等多种真菌经过聚酮作用产生的次级代谢产物[1-2]。其中Aspergillus.flavus主要产生B族黄曲霉毒素,Aspergillus.parasiticus产生B族和G族黄曲霉毒素[3-4]。目前已分离出20余种黄曲霉毒素,主要存在AFB1、AFB2、AFG1、AFG2,其他均为衍生物,如AFM,它是AFB在动物肝脏内经过羟化衍生而形成的代谢产物,它会分泌到乳汁(Milk)中,其中以AFB1的毒性最大,污染最广,具有致癌性、致毒性、致突变性、抑制免疫力、肝损伤等[5-7]。
目前去除食品和饲料中黄曲霉毒素的方法主要有3种,物理法、化学法和生物法[8]。物理法主要有吸附剂、烘焙、紫外照射、电离辐射等。化学法主要有碱法、氧化法等,但是理化方法对食品的品质和营养有不同程度的影响,且容易造成化学残留,设备成本高等问题。目前生物法是研究热点,生物法去除黄曲霉毒素的方式有两种,一是微生物吸附脱毒[9],菌体细胞吸附毒素形成稳定复合物,但是这一过程容易受到温度和菌体浓度影响,过程可逆。二是微生物或其代谢产物降解脱毒。黄曲霉毒素B1降解是微生物的代谢产物或者酶破坏AFB1的毒性基团氧杂萘邻酮和二呋喃环的过程,前者为致癌基团,后者为基本毒性结构[10]。生物法降解AFB1条件温和,去毒效率高,且生物酶具有作用的专一性等优点。Guan等[11]以香豆素为唯一碳源和能源筛选出嗜麦芽窄食单胞菌(Stenotrophomonasmaltophilia),其能够显著降解黄曲霉毒素B1,Hormisch等[12]以荧蒽为碳源,从多环芳烃污染的土壤中分离出分歧杆菌(Mycobacteriumfluoranthenivoranssp.),该菌能在72 h内将一定量的AFB1全部降解。Liang等[13]从芽孢杆菌(Bacillusshackletonii)中分离出新型AFT降解酶,能够降解AFB1、AFB2、AFM1。
本研究通过大量工作,从河南郑州地区筛选到具有良好降解AFB1特性的菌株,对降解能力最优的菌株进行了初步鉴定,并对该菌株的AFB1脱毒机理和降解特性做了初步研究。
1 材料与方法
1.1 材料与仪器
微生物样品 来源于腐烂朽木、发霉粮食、发酵食品、霉菌污染的土壤以及加油站土壤(河南郑州高新区)等。AFB1标准品 美国Sigma公司;香豆素 上海Macklin生化科技有限公司;甲醇、乙腈 色谱纯,天津市四友精细化学品有限公司。
Agilent 1260高效液相色谱仪 美国Agilent公司;KDC-160HR高速冷冻离心机 安微中科中佳科学仪器有限公司;PHS-3C型精度pH计 上海雷磁科学仪器股份有限公司;LY20-92B台式恒温振荡器 上海龙跃仪器设备有限公司。LDZX-50KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;YT-CJ-1N型超净工作台 北京亚泰科隆仪器技术公司;BC-J160S电热恒温培养箱 上海博迅实业有限公司医疗设备厂;
1.2 实验方法
1.2.1 培养基的配制 初筛培养基为Hormisch等[12]改良筛选培养基(L-1):0.25 g KH2PO4,1.0 g NH4NO3,1.0 g CaCl2,0.25 g MgSO4·7H2O,1.0 mg FeSO4,20 g琼脂,2 g香豆素;种子培养基(营养肉汤)(L-1):3 g牛肉膏,10 g蛋白胨,5 g NaCI;发酵培养基(L-1):3 g牛肉膏,10 g蛋白胨,6 g葡萄糖,5 g NaCI;菌种保存培养基(L-1):3 g牛肉膏;10 g蛋白胨;5 g NaCI,20 g琼脂,以上培养基pH均为7.0,121 ℃高压灭菌20 min。
1.2.2 降解AFB1菌株的分离与筛选
1.2.2.1 初筛 称取样品1 g,研钵磨碎后置于9 mL无菌生理盐水中,摇床振荡混匀2 h(150 r/min),吸取0.2 mL上清液接种于5 mL种子培养基中,37 ℃培养12 h,然后将菌液接种到初筛培养基中,37 ℃倒置培养1周,观察菌株的生长情况,挑取有生长迹象的菌株,再次在初筛培养基平板上划线、培养,如此反复转接3~4次,挑取能在以香豆素为唯一碳源的培养基上生长的单菌落,保存备用。
1.2.2.2 复筛 取初筛菌株接种于5 mL种子培养基中,37 ℃、150 r/min气浴摇床培养24 h,再以5%的接种量转接于100 mL发酵培养基中,37 ℃,150 r/min气浴摇床培养48 h,取975 μL菌体发酵液与25 μL AFB1标准品(100 μg/mL)混匀于1.5 mL的灭菌的棕色离心管中,混合后浓度为2.5μg/mL,以无菌的发酵液加AFB1标品作空白对照,37 ℃、150 r/min气浴摇床暗处培养72 h,3组平行实验,反应结束后,4 ℃、12000 r/min离心5 min去除菌体,取上清液测样。
1.2.3 AFB1的提取及检测 AFB1的提取和HPLC检测方法参考Teniola的方法[14],取1 mL上清液,用等体积的二氯甲烷涡旋振荡萃取3次,每次30 s,取二氯甲烷层,36 ℃下氮气吹干,用1 mL色谱级乙腈溶解,经0.22 μm滤膜过滤后进样。
液相条件:色谱柱为ZORBAX SB-C18柱(150 mm×4.6 mm,5μm);流动相为甲醇∶乙腈∶水=1∶1∶2(V∶V∶V),流速1 mL/min;柱温30 ℃,检测波长:362 nm。
AFB1的去除率利用以下公式计算:
去除率(%)=(1-实验组AFB1含量/对照组AFB1含量)×100
1.2.4 菌株的鉴定
1.2.4.1 表型测定 接菌在肉汤培养基平板上,37 ℃培养24 h后,观察形态、色泽,显微镜观察细胞形状以及革兰氏染色结果。
1.2.4.2 细菌16S rDNA基因序列测定及同源性分析 使用Ezup柱式细菌基因组DNA抽提试剂盒。以引物对7F:5′-CAGAGTTTGATCCTGGCT-3′和1540R:5′-AGGAGGTGATCCAGCCGCA-3′特异性扩增16S rDNA。PCR 扩增程序:94 ℃ 4 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 1 min,30个循环:72 ℃ 10 min。采用1%的琼脂糖凝胶电泳检查PCR产物。采用试剂盒纯化并克隆PCR产物,生工生物工程(上海)股份有限公司进行测序。将PCR扩增得到的16S rDNA序列用NCBI的BLAST程序进行序列同源性比对,并用MEGA 7软件进行NJ(Neighbor-Joining)分析,并构建基于16S rDNA序列的系统发育树,用Bootstrap法(1000次重复)检验。
1.2.5 菌株降解活性物质的确定 为初步确定能够降解AFB1的活性物质,设立三组试验:a. 胞外粗提液:将1.2.2中发酵液在4 ℃、8000 r/min离心20 min,取上清液,即得胞外粗提液。b. 菌细胞悬浮液:将a中离心后所得菌细胞用50 mmol/L,pH7.0的磷酸盐冲洗两次,用磷酸盐缓冲液溶解。c. 胞内裂解物:用超声细胞破碎仪将b中细胞悬液在冰上破碎(5 s,33 min,两次),再将破碎的细胞溶液冷冻离心(4 ℃、12000 r/min离心5 min),随后取上清液用0.22 μm的抽滤器无菌抽滤。
1.2.6 菌株降解曲线测定 将菌株接种到发酵培养基中,在37 ℃培养72 h后,与AFB1混合培养,测定不同培养时间(6、12、24、48、96 h)下AFB1的降解率。
1.3 数据处理
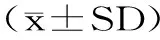
2 结果与分析
2.1 菌株的初筛
初筛获得31株能在以香豆素为唯一碳源和能源的培养基中稳定生长的菌株,如表1所示,6株分离于土壤、6株来源于发霉粮食(小麦、玉米和糙米)、6株来源于腐烂朽木(杨树、芝麻杆),5株来源于发酵食品,其他来源于花生粕与玉米胚芽粕,对以上菌株进行复筛。

表1 降解黄曲霉毒素B1菌株的初筛结果Table 1 Result of the firstly screened aflatoxin degradation strains
2.2 菌株的复筛
将初筛得到的31株菌株进行复筛,共得到10株降解活性良好的菌株(表2),其中XY1降解能力最强,降解率达到了71.91%,选择菌株XY1进行后续研究。

表2 降解黄曲霉毒素B1菌株的复筛结果Table 2 Results of the secondly screened aflatoxin B1 degradation strains
2.3 菌株的鉴定
XY1菌株在培养基上生长为灰白色的菌落,革兰氏阴性菌。16S rDNA基因是编码原核生物核糖体小亚基的基因,长度在1500 bp左右,提取菌株XY1总DNA,进行PCR扩增,其PCR产物电泳图如图1所示,在1500 bp处出现特异性条带,与预计结果相同。将XY1的16S rDNA(1444 bp)在NCBI用Blast比对,从GenBank数据库获得相关序列进行系统发育分析,由图2可知,XY1与Klebsiellasp.(FR677021.1)位于一个分支中,与Klebsiellasp.同源性达到99%,可以初步确定XY1为克雷伯氏菌(Klebsiella),属于克雷伯氏菌属。

图1 XY1菌基因PCR产物电泳图Fig.1 PCR products of XY1 gene shown in agarose gel electrophoresis注:1:XY1菌基因PCR产物图;M:Marker:DL5000。

图2 基于16S rDNA基因构建的XY1邻位连接法系统进化树Fig.2 Neighbor-Joining phylogenetic tree of strain XY1
2.4 发酵液中降解AFB1物质的确定
从图3中可以看出,XY1菌胞外粗提液的降解率明显高于菌细胞悬液及胞内裂解物,胞外粗提液降解率为70.23%,菌细胞悬液降解率为8.26%,胞内裂解物的降解率为3.18%,其中菌细胞悬浮液对AFB1有一定的降解率,说明菌细胞对AFB1有一定的吸附作用,对比上清液的降解率后,可以确定是发酵液中菌株的胞外代谢产物起主要降解作用。在碱性环境下,AFB1的内酯键易受OH-的攻击,从而引起内酯环的打开造成化学降解,形成香豆盐[15]。上清液降解AFB1实验中,测定反应结束后的pH为8.2。由李超波[16]实验表明,pH大于8.5时,才会对AFB1的降解起到较大的影响,由此可以排除pH的干扰。

图3 Klebsiella sp.XY1菌不同组分对AFB1的降解Fig.3 Result of AFB1degradation by the different components of Klebsiella sp.XY1
2.5 降解曲线的测定
菌株对毒素降解曲线如图4所示,前12 h内,降解速度较快,而在12~24 h之间降解速度减缓,这是因为在0~12 h内,同时存在活性物质对AFB1的降解作用和菌体对AFB1的吸附作用,但吸附率较低,随着时间的增加又出现解吸附现象,此时毒素浓度会有所回升,所以降解速度减缓,EI-Nezami等[17]在研究乳酸菌吸附时提出,微生物对毒素的吸附是一个很迅速的过程。在24~120 h内毒素的降解率逐渐提高,可能是由于菌体的解吸附过程彻底结束,只存在活性物质对毒素的降解作用,所以随着时间的延长,降解率逐渐提高。

图4 降解曲线Fig.4 Degradation curve
3 结论
从腐烂朽木中分离、筛选出能高效降解AFB1的细菌XY1,其降解率达到71.91%。经鉴定为克雷伯氏菌(Klebsiellasp)。克雷伯氏菌XY1去毒活性物质主要存在于上清液,为胞外代谢产物。本研究结果表明,利用和AFB1的结构类似物香豆素为唯一碳源和能源进行黄曲霉毒素B1降解菌株的筛选,是一种可行、安全的方法。

