依那西普抗体的活性结构保护
房筱,李代禧,郭柏松,杨春生
(1. 上海理工大学 医疗器械与食品学院,上海 200093;2. 上海东富龙科技股份有限公司,上海 201108)
依那西普(etanercept),是全人源化肿瘤坏死因子(TNF-α)拮抗剂。它可以特异性地与TNF-α结合,竞争性阻断TNF-α与细胞表面的受体结合[1],主要用于治疗类风湿性关节炎[2]、强直性脊柱炎[3]、斑块型银屑病[4]、银屑病性关节炎[5]、幼年特发性关节炎[6]以及中毒性表皮坏死松懈症[7]等疾病。由于该类药物复溶后的稳定性极差,故通常会加入海藻糖(trehalose,TRE)、蔗糖(sucrose,SUC)、甘露醇(mannitol,MAN)等保护剂作为辅料[8],以稳定抗体蛋白药物的活性结构。在文献[9]中选用海藻糖和甘露醇作为保护剂。虽然海藻糖对依那西普抗体蛋白具有保护效果,但在实际生产中不可能使用任何单一保护剂对药物蛋白进行保护,获得显著的保护效果,通常需要考虑使用两种或者两种以上的保护剂来稳定蛋白质药物的结构活性[10]。蛋白药物制备中,有时不免要经历低温或冷冻干燥过程,在此过程中药物分子活性结构容易发生改变,为此经常选择一些活性保护剂加入药物中,并研究药物在溶液中和真空冷冻干燥条件下药物分子的活性变化。
潘琦等[11]采用拉伸分子动力学和伞状采样研究了依那西普抗体蛋白的解离过程,通过计算其解离自由能,分析了依那西普抗体蛋白在真空干燥和水溶液环境下的稳定性,但对于其本身结构的变化情况、抗体蛋白与保护剂之间的相互作用,以及保护剂的保护作用机制并未进行深入研究。 而且随着计算机运算能力和模拟算法设计的不断改进,分子动力学方法越来越广泛地应用于蛋白质的研究中[12]。
为此,本文以热敏性抗体蛋白依那西普为研究对象,选择海藻糖、蔗糖和甘露醇为保护剂,采用分子动力学模拟方法,对依那西普进行单一保护和复合保护研究。研究了在溶液和真空干燥环境下,保护剂对依那西普活性结构的保护作用与规律,以及保护剂的保护作用机制,从分子角度阐述保护剂对生物大分子的保护作用机理。
1 原理与方法
1.1 原理
分子间接触数表征两分子之间相互作用的强弱,在本研究中当两个原子间的间距小于0.35 nm时,才认为原子间相互接触,视作一个接触数[13]。因此通过计算依那西普与保护剂以及依那西普与水之间的接触数,以分别表征依那西普蛋白分子与保护剂分子和水分子之间作用力的强弱以及依那西普的优先作用倾向。接触数越大,表明分子间的结合作用越强;反之结合作用越弱。
由于这3组体系分子数不同,含有的原子数也不同,因此模拟系统中保护剂和水分子原子总数差异较大。为了准确比较依那西普分子与不同保护剂或水分子结合作用的相对大小,本研究引用接触系数的定义[13],定义依那西普的接触系数CTW为
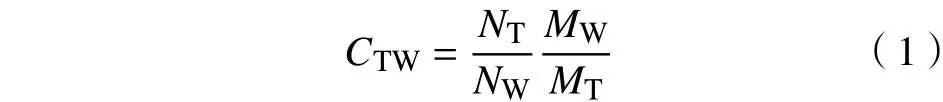
式中:NT为依那西普与保护剂的接触数;NW为依那西普与水分子的原子接触数;MT为保护剂分子的总原子数;MW为水分子的总原子数。CTW数值越大,表明依那西普与保护剂分子之间的结合作用越强,且依那西普是优先与保护剂作用的。
1.2 构建模型
依那西普晶体结构(PDB ID:3AVE)从PDB数据库获得,获取地址为http://www.rcsb.org/pdb/explore/explore.do?structureId=3ave,具体分子结构如图1所示。海藻糖、蔗糖、甘露醇的分子结构分别采用Gaussion 09化学软件在B3LYP/6-31G*方法下进行结构优化[14],优化后的结构为最终结构,如图2所示。
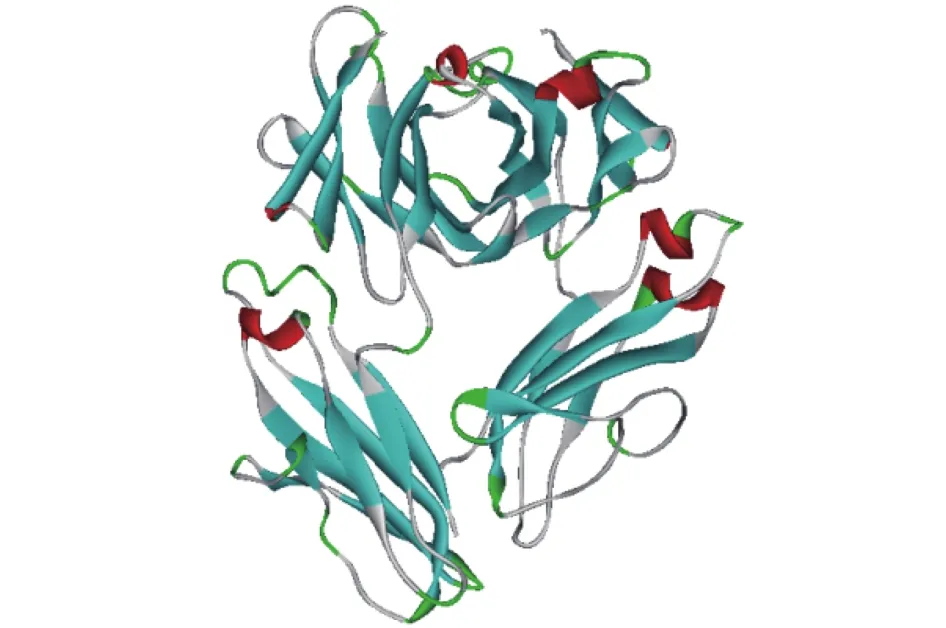
图1 依那西普的三维结构Fig.1 Three-dimensional structure of etanercept
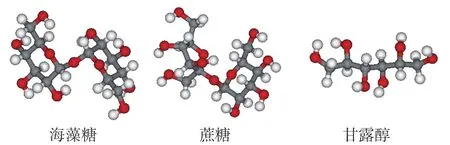
图2 海藻糖、蔗糖、甘露醇的分子结构Fig.2 Molecular structures of trehalose, sucrose and mannitol
1.3 模拟方法
分子动力学模拟方法采用 Gromacs 5.1.4生物大分子软件包[15],其中依那西普蛋白选用Amber99sb-ildn力场[16],水分子选用TIP3P模型[17]。在模拟过程中,时间步长设定为1 fs,范德华相互作用利用Lenard-Jones函数计算[18],截断设为1.0 nm。为了修正范德华分子间的远程相互作用,邻近作用半径设为1.0 nm,每10步重建一次邻 近 列 表 。 采 用 PME( particle mesh Ewald) 方法[19]用于静电相互作用的远程修正,静电相互作用的截断设定为1.0 nm。
首先,建立 9 nm × 9 nm × 9 nm 的周期性体系,每个体系中分别添加相应的保护剂,添加离子中和体系电荷,共构建了3组保护体系以及1组对照体系,如表1所示。每个体系分别进行5 000步 的 能 量 最 小 化 , 再 以 LINCS(linear constraint solver)方法[20]限制所有化学键的键长,利用 Maxwell 分布方法[21]设置体系各原子的初始速度,并通过 Velocity-rescale方法[22]控制体系的温度为 300 K,耦合常数为 0.1,同时系统压力采用 Berendsen方法[23]设定体系的压强耦合常数为0.5。对水溶液体系和真空环境体系分别进行5 ns的预平衡,再平衡 40 ns,得到均匀稳定的依那西普蛋白的水溶液体系和依那西普蛋白的真空环境体系。
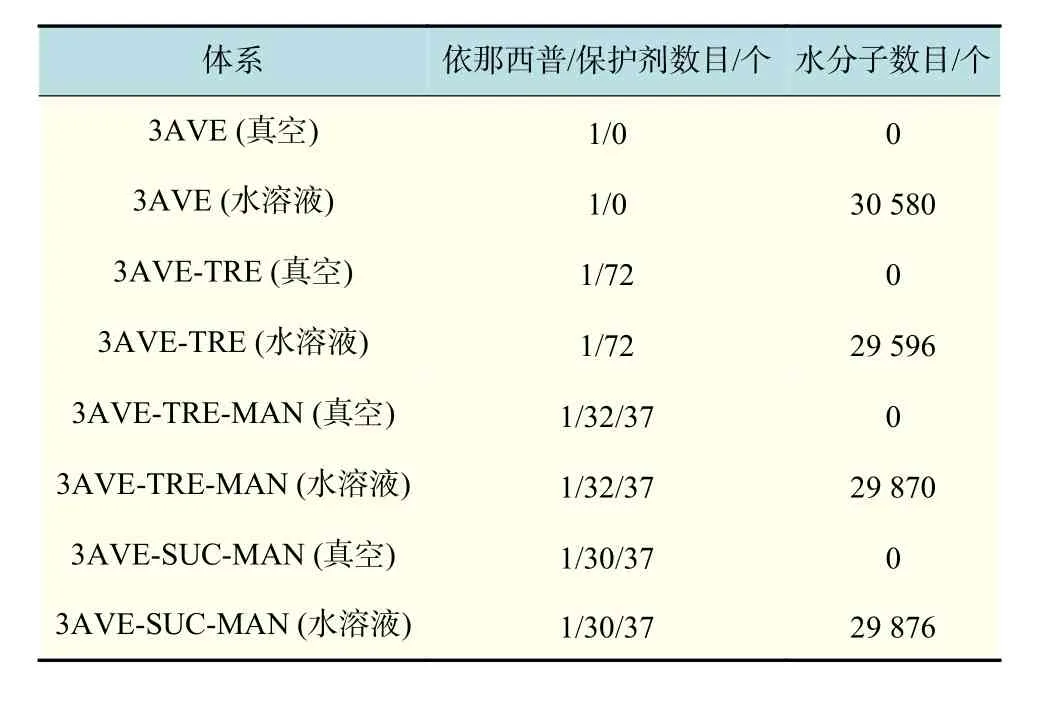
表1 依那西普4组保护体系的组成Tab.1 Composition of the four protective systems of etanercept
体系达到平衡后,取最后5 ns用于数据分析,采用SPSS19.0软件中的单因素方差分析进行计算。对同一环境条件下,不同保护体系之间进行比较,运用单因素方差分析中的Tukey检验程序进行,所选取的置信区间为95%,并采用Origin8.0软件对数据进行图形化处理。
2 结果与讨论
2.1 依那西普的结构稳定性分析
为了判断分子动力学模拟过程中体系的稳定性,计算了主链相对于初始结构的均方根偏差(root mean square deviation, RMSD)。 RMSD 可以反映特定结构与初始结构的相似程度,均方根偏差值RMSD越低,表明特定结构与初始结构的差异性越小[24]。为此,分别计算了水溶液和真空环境下,依那西普在不同保护体系中的RMSD,如图3所示,考察了不同环境及不同保护剂配方对抗体蛋白结构稳定性的影响。模拟平衡后,最后5 ns的RMSD之间的显著性(检测水平p = 0.05),在柱状图上用字母表示,字母相同表示无显著差异,字母不同表示差异显著。
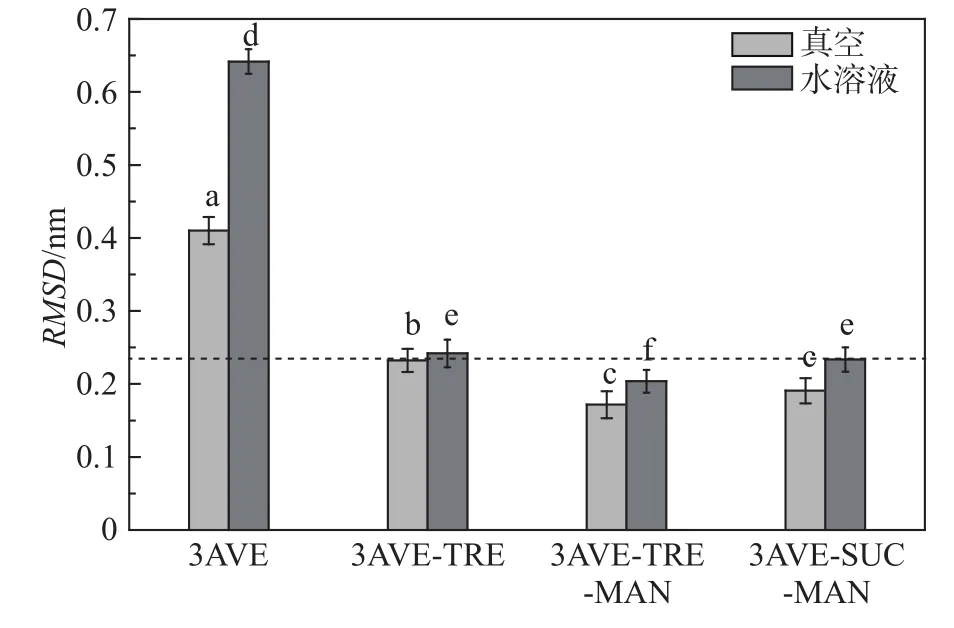
图3 依那西普在真空干燥环境和水溶液中的RMSDFig.3 RMSD of each etanercept in vacuum drying and aqueous solutions environment
从图3可以看出,真空环境中4种体系的依那西普RMSD比其在溶液中的RMSD低,其中海藻糖–甘露醇复合保护体系中依那西普的RMSD最低,此种复合保护剂对依那西普的稳定作用最强,与初始结构相比差异性最小。水溶液中4种体系的RMSD均比其各自在真空环境的RMSD略高,说明依那西普抗体蛋白在水溶液中的稳定性小于真空环境,溶液体系中水分子对蛋白药物的稳定性有一定影响。加入保护剂后与未添加保护剂的抗体蛋白相比,其RMSD明显降低,而且经过单因素方差分析后可以看出,具有保护剂的抗体蛋白的RMSD与未添加保护剂时相比具有显著性差异,这说明保护剂能显著提高体系中蛋白质的稳定性。在真空干燥环境中,具有复合保护剂的抗体蛋白的RMSD比纯海藻糖保护体系的RMSD低,且具有显著性差异,但是海藻糖–甘露醇复合保护体系及蔗糖–甘露醇复合保护体系中抗体蛋白的RMSD无显著差异,这说明在依那西普活性保护过程中,在冷冻干燥条件下,复合保护体系能够更好地保护抗体蛋白的活性结构。而在水溶液环境中,海藻糖–甘露醇复合保护体系的RMSD低于其他3组体系,且经过方差分析得出,其RMSD与其他3组相比具有显著性差异。可见,海藻糖–甘露醇复合保护体系对依那西普活性结构保护效果最好。
为了检测加入保护剂后对抗体蛋白原子的影响,计算了抗体蛋白中的主链原子的均方根涨落(root mean square fluctuation,RMSF),如图 4 所示为抗体蛋白主链的均方根涨落值RMSF。
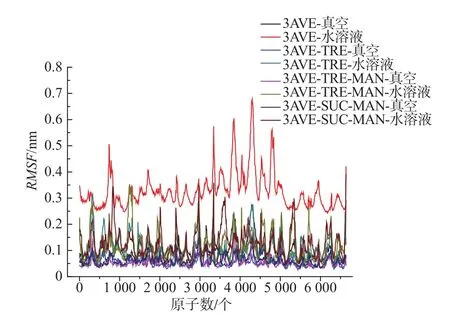
图4 不同保护体系中依那西普主链的RMSFFig.4 RMSF of the etanercept’s main chain in different protective systems
由图4可以得出,海藻糖–甘露醇复合保护体系中依那西普的RMSF最小,说明该保护剂与抗体蛋白存在较强的相互作用,能够提高抗体蛋白的稳定性。在溶液体系中,依那西普在无保护剂的情况下,其RMSF较高,说明在纯水溶液中依那西普抗体蛋白中的主链涨落幅度较大。而加入保护剂后,体系中原子涨落幅度有较明显的降低,说明保护剂与抗体蛋白之间存在相互作用,从而降低了原子的运动强度,提高了蛋白体系的稳定性。加入保护剂后,抗体蛋白的主链涨落幅度相对较小,但还有一定涨落,说明保护剂并不能完全降低抗体蛋白原子的热运动,分析其原因为保护剂并不是完全覆盖在蛋白表面,不同保护剂具有选择吸附性,且吸附区域不同,导致保护剂与抗体蛋白之间的相互作用存在强弱分布,如图5所示。其中,橙色表示海藻糖;黄色表示蔗糖;紫色表示甘露醇。
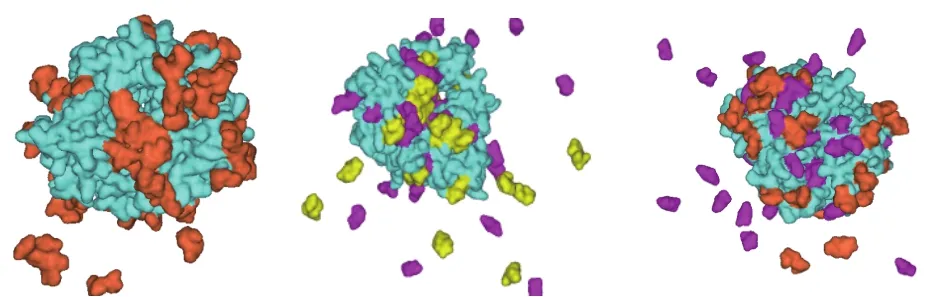
图5 复合保护体系在依那西普抗体蛋白表面的吸附情况Fig.5 Adsorption of complex protective system on the surface of etanercept

图6 依那西普与保护剂之间的平均相互作用能Fig. 6 Average interaction energy between etanercept and protectants
2.2 依那西普保护体系分子间的相互作用
依那西普抗体蛋白与保护剂分子间存在相互作用,通过比较分子间相互作用能以区分蛋白质与保护剂分子间相互作用力的强弱[25]。依那西普与不同保护剂之间的平均相互作用能如图6所示。在水溶液环境中抗体蛋白与保护剂之间的相互作用能低于真空干燥环境,其原因是在水溶液中,保护剂、蛋白质、水三者之间均存在相互作用,保护剂均具有亲水性,水分子与保护剂之间存在较强的相互作用,降低了保护剂与抗体蛋白之间的相互作用。在真空干燥环境中,海藻糖–甘露醇复合保护体系、蔗糖–甘露醇复合保护体系的相互作用能与纯海藻糖体系相比具有显著差异,说明单一保护体系对抗体蛋白的保护作用是有限的。在水溶液环境中,海藻糖–甘露醇复合保护体系与蔗糖–甘露醇复合保护体系的相互作用能值高于纯海藻糖保护体系,且3种保护剂体系之间的相互作用能具有显著差异,这说明复合保护剂与抗体蛋白之间有较强的相互作用,其中海藻糖–甘露醇复合保护剂与抗体蛋白的相互作用能较高。而两种复合保护体系之间也具有显著差异,说明海藻糖–甘露醇复合保护剂与抗体蛋白之间存在较多的分子间相互作用,这种复合保护体系更有利于稳定抗体蛋白的分子结构,这与差示扫描微量热分析实验结果海藻糖–甘露醇复合保护体系的保护效果最好是一致的[26]。
2.3 依那西普保护体系的分子间氢键作用
图7为真空干燥环境与水溶液中依那西普与保护剂之间的氢键数。可以看出,真空干燥环境中抗体蛋白与保护剂之间的氢键数多于在水溶液中的氢键数,而在溶液中海藻糖–甘露醇复合保护与抗体蛋白之间存在较强的氢键相互作用,稳定抗体蛋白分子结构。通过单因素方差分析可以看出,真空干燥环境中抗体蛋白与保护剂之间的氢键数明显多于两者在溶液中的氢键数,由于在真空干燥环境中保护剂与依那西普蛋白之间形成了较多的分子间氢键,表现出较强的直接相互作用。而在水溶液环境中,由于大量水的存在,水与抗体蛋白、保护剂之间均存在分子间作用力,且部分保护剂与水的相互作用强于保护剂与抗体蛋白之间的相互作用。由于分子处在不停的运动中,部分保护剂与抗体蛋白接触减少,使得保护剂与依那西普之间形成的分子间氢键较少,分子间的相互作用减弱。

图7 真空干燥环境与水溶液中依那西普与保护剂之间的氢键数Fig.7 Number of hydrogen bonds between etanercept and protectants in vaccum drying and aqueous solution environment
在水溶液环境中,通过分析保护剂与抗体蛋白之间的氢键数的平均值和方差得出,复合保护体系中保护剂与抗体蛋白之间的氢键数多于单一保护体系两者之间的数量,说明复合保护剂与抗体蛋白之间形成较多的氢键结合位置,也间接说明复合保护剂之间能够协同交叉保护抗体蛋白。而且动力学和热力学研究也表明,复合保护体系中保护剂与依那西普蛋白之间的氢键数目多于单一保护剂体系[11]。
由于保护剂对蛋白药物的保护作用主要是通过分子间相互作用实现的,主要推动力是静电相互作用,同时氢键也起到一定的作用[27]。有研究表明,糖类与蛋白质之间的氢键结合是抑制蛋白质在冷冻干燥过程中发生结构变性的主要原因[28],说明在冷冻干燥过程中蛋白质与保护剂之间形成的氢键,能够降低热振动和稳定体系的结构,有利于蛋白质的结构保持稳定性。通过分析保护剂与抗体蛋白之间的氢键,得出复合保护体系中保护剂与抗体蛋白之间的氢键相互作用强于海藻糖单一保护体系,而海藻糖–甘露醇复合保护体系对抗体蛋白的氢键相互作用最大。
2.4 依那西普保护体系的分子间接触系数
图8为溶液中抗体蛋白与保护剂之间的接触系数。从接触系数及方差分析中可以看出,复合保护体系的接触系数远大于单一保护体系,且海藻糖–甘露醇复合保护体系的接触系数最大,为6.63。所以在溶液中复合保护体系中保护剂与蛋白质有较多的分子间接触,在溶液中抗体蛋白不仅与保护剂之间存在分子间接触,而且还与水之间存在较多的接触,计算得出它们之间的接触系数均大于1,说明在溶液中依那西普更易于与保护剂之间产生分子间接触。在3种保护体系中,海藻糖–甘露醇复合保护剂与抗体蛋白之间的接触能力更强,与抗体蛋白分子间产生的分子间结合作用也是最强。
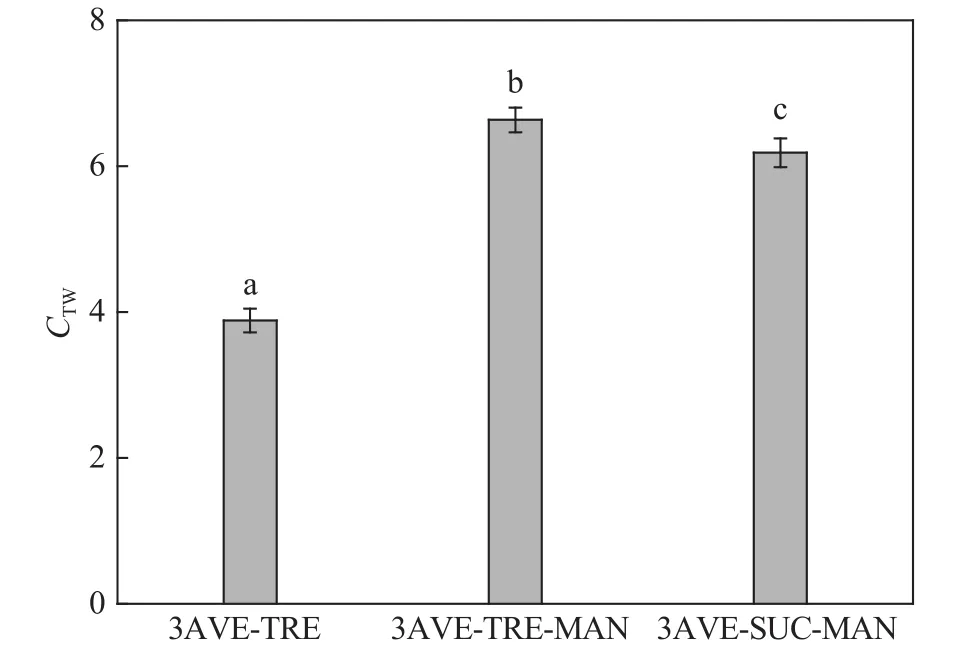
图8 依那西普与保护剂之间的接触系数Fig.8 Number of contact coefficient between etanercept and protectants
3 结 论
通过分析海藻糖–甘露醇复合保护体系、蔗糖–甘露醇复合保护体系、纯海藻糖体系中保护剂与蛋白质之间的相互作用关系,并与不添加保护剂的体系相比,可以看出这3种保护体系对依那西普抗体蛋白均具有保护作用。其中,海藻糖–甘露醇复合保护体系与蔗糖–甘露醇体系对抗体蛋白结构活性的稳定作用强于纯海藻糖保护体系,而海藻糖–甘露醇复合保护体系的对抗体蛋白保护作用更强。本文从分子水平上阐述了保护剂对抗体蛋白的保护作用机理,这不仅筛选出依那西普抗体蛋白的最适保护剂,而且还从理论上解释了其活性保护作用规律。分子模拟方法与实验筛选相比,不仅节省了大量的筛选时间、研究成本,而且能从理论上阐释筛选出的保护剂对蛋白质的保护效果及作用机理,特别是针对大通量筛选最适保护剂,此种方法更能节约成本。随着分子动力学模拟方法不断发展,如模拟算法、分子力场的发展、模拟技术与分子数据库相结合,相信以后此方法在诸多领域中会起到越来越重要的作用。

