太湖蓝藻水华期可溶有机物的生物降解
许 明,刘伟京,白永刚,涂 勇
太湖蓝藻水华期可溶有机物的生物降解
许 明*,刘伟京,白永刚,涂 勇
(江苏省环境科学研究院,江苏省环境工程重点实验室,江苏 南京 210036)
以太湖蓝藻水华期产生的可溶有机物(DOM)为代表,研究溶解性有机碳(DOC)、有色DOM(CDOM)以及荧光DOM(FDOM)的生物降解,并结合平行因子分析和二维相关图谱分析(2D–COS)揭示独立FDOM组分的变化特征.结果表明,降解初期DOC浓度剧烈下降,而后缓慢降低,且与CDOM浓度线性相关.模型拟合确定DOC中活性、半活性以及非活性部分分别占40%,37%,23%,表明藻华期DOC中大部分(77%)可在短期内降解.SUVA254、R、HIX等指标变化说明生物降解中DOM的芳香度、平均分子质量、腐殖度等逐渐升高.4个独立FDOM组分的生物活性大小为:类色氨酸组分>类酪氨酸组分>类富里酸组分>类腐殖酸组分,其中类色氨酸和类酪氨酸是活性和半活性FDOM的主要组成,而类富里酸和类腐殖酸组分是非活性FDOM的主要组成.结合2D–COS进一步发现激发波长较低的荧光组分优先被微生物降解.
蓝藻水华;可溶性有机质;生物降解;三维荧光光谱;二维相关分析
目前水体中浮游藻类暴发式生长,大量的代谢产物和藻体降解产物作为可溶有机物(DOM)进入水体[1-2].DOM成分复杂,主要包含糖类、蛋白质以及腐殖质等[3].生物降解作为DOM主要环境行为之一,不仅与DOM浓度和结构密切相关[4],而且对微生物群落和营养网结构具有重要影响[5].此外,DOM生物降解可消耗溶解氧,促进湖泛形成[6],而新兴有机污染物的自然消减也受DOM生物活性调控[7].由于DOM在化学组成和结构上具有高度的异质性,不同组分对环境条件与生物降解的响应显著不同,故有必要探究不同组分的具体演化机制.然而,目前关于藻华期不同DOM组分在生物降解中动态变化的异质性研究较少.
DOM结构复杂,按一定的组成特性分析有利于认识DOM的降解特征.目前DOM的主要示踪方法包括溶解性有机碳(DOC)、发色DOM(CDOM)及荧光DOM(FDOM)等[8-9].其中DOC可衡量DOM的宏观碳含量,而CDOM(吸收光谱)和FDOM(荧光光谱)可深层地揭示DOM的组成、分子结构、来源及演化[10-11].除了特定波长处的绝对吸收值和荧光强度、不同波段的比例、光谱指数以及特定区域斜率等指标,光谱联合数学模型也可加深对DOM环境演变的理解.三维荧光光谱结合平行因子分子(EEM– PARAFAC)能够分离出独立荧光组分,有效解决不同荧光团的区域重叠问题[12-13].二维相关光谱分析(2D–COS)可揭示不同DOM结构应对外部因素的敏感度和反应顺序[14].关于2D–COS应用于DOM生物降解目前仍未见报道.
本研究以太湖藻华期DOM为研究对象,通过生物培养测定,结合多种分析手段,考察溶解性有机碳(DOC)、CDOM以及FDOM等在生物降解中的演化特征,旨在理解藻华期DOM的生物化学特征以及环境归趋.
1 材料与方法
1.1 样品采集及准备
于2017年7月在太湖梅梁湾蓝藻暴发区用棕色玻璃瓶(450℃预烧4h)采集5L含有藻浆的湖水,先用0.70μm孔径的预烧玻璃纤维滤膜(Whatman)过滤,再用0.22μm孔径的聚碳酸酯滤膜(Millipore)过滤,滤液冷冻备用.设置两个平行实验,取平均值.
在同样点位用抓泥斗采集表层沉积物样品,添加100g沉积物到800mL过滤湖水中,振荡培养过夜后用0.22μm的聚碳酸酯滤膜过滤,将滤膜上的微生物洗脱至无菌水中,作为接种液备用.
1.2 生物培养测定
DOM的生物降解按文献[15-16]方法执行,具体如下:将48mL过滤湖水分别置于15个锥形瓶中(450 ℃预烧4h),添加2mL接种液,并添加一定浓度的无机营养盐,使得最终氨氮、硝酸盐氮和磷浓度分别为9.5, 9.8, 2.0mmol/L.用通气橡胶塞封口,在黑暗条件下恒温(25℃)振荡.分别于0, 4, 8, 16, 32d取出3个锥形瓶,立即过滤,测定滤液的DOC浓度、吸收光谱以及荧光光谱.另外,对照实验表明接种液产生的DOM可忽略不计.
1.3 DOM分析

表1 常用CDOM和FDOM的相关指标描述
DOC浓度由TOC-Vcph型总有机碳分析仪(岛津,日本)通过高温燃烧(680℃)联用非色散红外检测测定.吸收光谱由UV-2550型紫外可见分光光度计(岛津,日本)测定,光程路径10cm,测试波段200~ 800nm,间隔1nm,以700nm处吸收值校正基线,Milli-Q水为参比.吸收系数a(m-1)按式(1)计算:
式中:为波长处吸光度,为光程路径(m).荧光光谱由F-7000型荧光分光光度计(日立,日本)测定,激发光源为150W氙弧灯,光电倍增管电压为700V.同步荧光光谱的扫描波段200~450nm,间隔1nm,发射波长与激发波长差值∆为60nm,扫描速度240nm/ min.EEM光谱的激发扫描波段200~450nm,间隔5nm,发射扫描波段250~550nm,间隔1nm,狭缝宽度5nm,扫描速度1200nm/min.采集光谱后,首先按仪器相关方法修正内部误差,继而通过瑞利效应赋值和拉曼散射综合区域标准化消除干扰峰.将EEM数据导入MATLAB(R2012a版本)软件,用drEEM工具箱(1.0版本)进行:(1)内滤效应修正;(2)扣除空白修正;(3)将荧光强度归一化为激发波长350nm处的拉曼信号强度(RU350)[17].内滤效应修正公式为:

式中:obs和cor分别为修正前后的荧光强度,Ex和Em分别为相应激发和发射波长处的吸光度.按表1计算吸收光谱和荧光光谱的相关指标.
1.4 数据分析
1.4.1 生物降解模型模型基于一级降解动力学理论,假定DOM中活性组分和半活性组分的生物降解遵循一级动力学,而非活性组分不会被降解,且与水质、微生物、培养方式无关[23].采用模型拟合DOM的生物降解,如式(3)所示:

式中:为降解时间(d),123分别为活性、半活性和难降解DOC的浓度(mg/L),1、2为降解系数(d-1).采用SigmaPlot软件(12.0版本)对不同降解时间的DOC浓度进行非线性拟合,得到123.
1.4.2 PARAFAC分析 通过交替最小二乘算法,把整个EEM数据矩阵分离为相互独立的荧光组分,每个组分代表一个单独的荧光团或者一组强烈共变化的荧光团.采用drEEM工具箱对样品的EEM数据进行PARAFAC运算,该工具箱以N-way工具箱中的PARAFAC算法为内核.通过比较不同组分数量的残差分布以及S4C6T3半检验分析验证模型有效性,并将最终得到的每个组分最大荧光强度(max)作为其相对浓度[17].
1.4.3 2D–COS分析 2D–COS分析可通过信号峰之间变化的关系揭示不同DOM组分在生物降解中的反应顺序.以降解时间为外部扰动因素,用2D Shige软件(关西大学,日本)对同步荧光光谱进行2D–COS分析,并将同步图和异步图用Matlab软件重新绘制.
1.4.4 统计学分析 用Origin 8.5软件计算平均值和标准差.采用单样本T检验比较结果,若< 0.05,认为具有显著性.
2 结果与讨论
2.1 生物降解中DOC变化
如图1所示,藻华期湖水的初始DOC浓度为(29.10 ± 2.37) mg/L,经过32d生物降解后,降低至(7.11 ± 0.51) mg/L,去除率达76%.其中前8d平均降解速率为2.35mg C/(L·d),而后24d平均降解速率仅为0.13mg C/(L·d).因此,降解初期DOM中活性组分被微生物快速利用,但随时间推移,非活性组分难以被降解.通过模型拟合,发现活性,半活性以及非活性DOC浓度分别为11.74, 11.16, 6.65mg/L (2= 0.9776).与河水、城镇污水以及土壤等陆源DOC相比[15,24-25],藻华DOC的生物活性较高(77%).文献报道藻源DOM在生物反应器中5d内DOC浓度可降低40%[26].这些值意味着藻华产生的DOC中活性组分(40%)可在湖泊表层短期内降解,半活性组分(37%)的降解需要数十天,经水团交换后更可能发生湖泊深层[23].然而,非活性组分(23%)降解周期未知,可作为碳库长期存在.

图1 经历不同生物降解时间后的DOC浓度变化以及G模型拟合
2.2 生物降解中CDOM变化
如图2a所示,藻华期湖水CDOM的吸收系数250~600nm呈指数式降低,其中波长小于300nm的CDOM与蛋白发色团有关,而300~400nm之间的CDOM则可能来自于蓝藻体内的紫外线保护剂[27].以254表征CDOM的浓度,在32d的生物降解中从(33.37 ± 2.26)m-1降低至(22.55 ± 0.47)m-1(表2),且与DOC浓度显著相关(< 0.05)(图2b).藻华CDOM的初始SUVA254值为(0.51 ± 0.21)L/(mg C·m),低于常见地表水的SUVA254值(1.0~6.0L/(mg C·m))[9],说明其主要包含254nm处无吸收的小分子脂肪族物质.极低的SUVA254值也证实了蓝藻生物量是藻华期湖水CDOM的主要来源.微生物消耗小分子脂肪族物质,而大分子腐殖类物质不易被降解,故腐殖类物质比例升高,SUVA254值升高.

a为吸收系数变化;b为254与DOC浓度的线性拟合
CDOM的吸收光谱斜率和斜率比R与其相对分子质量和芳香度密切相关[20].地表水CDOM的275–295值为0.012~0.023nm-1,其值越低意味着DOM的相对分子质量越高[9].本研究中275–295值随生物降解而逐渐降低,而350–400值逐渐升高.这不仅与小分子脂肪族物质降解有关,而且在降解后期微生物残体累积也可能造成350–400值升高.R值可用来鉴定天然水体CDOM的来源,其值大于1说明藻体和水生植物是主要来源[9].R值从1.71±0.20降低至0.82±0.07,与SUVA254值变化一致.前人研究也发现河水DOM在生物降解过程中低波长段CDOM的损失高于长波长段CDOM[4].
2.3 生物降解中FDOM变化
2.3.1 FDOM指标一般来说,陆源FDOM的FI值较低,而微生物来源的FDOM的FI值较高[22].藻华期湖水FDOM的初始FI值为1.83 ± 0.01,接近于蓝藻胞内有机质的FI值(1.2~1.8)[28].FI值在生物降解中变化不明显,但HIX值显著升高(<0.05).HIX值表征FDOM腐殖化程度,其原理是由于腐殖化过程中H/C值降低,荧光分子的发射光谱向长波长移动,故HIX值升高.虽然第16~32d内DOC浓度变化较低,但HIX值显著升高,表明微生物可将低腐殖度组分转化高腐殖度组分.初始BIX值大于1,证实藻华期湖水FDOM的自生性.随着自生性物质被降解, BIX值逐渐降低,但在降解后期呈现波动式变化.前人研究藻体生物降解过程中发现了类似的结果[2].
与BIX类似,(C,T)和(A,T)可表征FDOM中类腐殖组分与类蛋白组分的相对含量,这两个比值越高,意味着类腐殖组分相对含量越高.藻华期湖水FDOM的初始(C,T)和(A,T)较低,并随生物降解而升高,表明类蛋白组分含量降低.虽然峰A和峰C都与类腐殖物质有关,但两者生物降解中的行为不同.降解初期(前8d)峰A相对于峰C优先被降解,从而(C,A)从0.78 ± 0.08升高到0.91 ± 0.04.然而,降解末期(C,A)降低至0.87 ± 0.02,说明峰A和峰C的总体损失相似.

表2 经历不同生物降解时间后CDOM和FDOM相关指标变化(平均值±标准偏差)
虽然FI、HIX、SUVA254都与DOM分子质量、芳香度和生物活性有关,但相关性分析表明它们之间不存在线性关系.如图3所示,表征类腐殖组分和类蛋白组分比例的(C,T)、(A,T)、(C,A)、BIX以及HIX之间,(C,T)和(A,T)以及HIX显著相关(<0.05).这些复杂的相关性表明DOM结构复杂,各指标代表了不同的组分.然而,由于不同荧光团可能存在覆盖,这些指标只能宏观上体现DOM的结构变化,无法进一步量化不同荧光组分的具体变化.

a为(C,T)和(A,T);b为(C,T)和HIX
2.3.2 PARAFAC组分变化 通过PARAFAC运算,共得到4个独立荧光组分,半检验分析表明它们的激发光谱和发射光谱高度重叠(图4).组分C1激发最大值在235nm处,发射最大值在400nm处,与文献中的类富里酸组分相似[29].组分C2在235和265nm处存在激发最大值,在302nm处存在发射最大值,可归为类蛋白质中的酪氨酸组分[30].组分C3也具有2个激发最大值,分别在235, 275nm处,一个发射最大值在330nm处,代表类蛋白质中的色氨酸组分[30].组分C4的2个激发最大值分别位于265, 365nm处,发射最大值位于460nm处,与类腐殖酸荧光组分相似[30].以四个荧光组分的max之和表示FDOM浓度,发现C1、C2、C3以及C4分别占21%、20%、40%以及19%,即类色氨酸组分相对含量最高.可以看出,PARAFAC不仅能够得到具体的独立荧光因子,还可以定量比较不同组分的含量.
如图5a所示,FDOM浓度在生物降解中降解了60%,不同荧光因子的响应不同.其中C2和C3的max值分别从(1.13 ± 0.18) RU和(2.27 ± 0.13) RU降低至(0.38 ± 0.03) RU和(0.52 ± 0.05) RU,去除率分别为66%和77%,而C1和C4的去除率则分别为40%和34%.换言之,4个荧光组分的生物活性大小为C3 > C2 > C1 > C4.进一步用模型拟合4个组分的生物降解,结合DOC的拟合结果可知,活性和半活性DOM中C3是主要组成,分别占54%和49%,其次为C2(25%和22%),而难降解DOM中C1和C4各占31%.
DOM中类蛋白组分的含量与活性DOM组分含量正相关,并且自由态氨基酸能够被异养微生物快速利用[4].但在本研究中,相当一部分的C2和C3(44%和33%)不能被降解,这可能是由于类蛋白组分与类腐殖组分之间潜在的络合作用限制了它们对微生物的利用性,但荧光性并未抑制[31].前人研究发现类色氨酸和类酪氨酸组分含量之和与活性DOC浓度相关,而类酪氨酸组分含量与半活性DOC浓度相关,说明类酪氨酸组分的生物活性比类色氨酸组分低[32].因此,类蛋白组分中只有活性部分可表征FDOM的生物活性.
如图5b所示,随着类蛋白组分的快速降解,类腐殖组分相对含量逐渐升高,表明难降解FDOM主要为类腐殖物质.有文献指出类腐殖物质在生物降解中基本没有变化[4],而在本研究中类腐殖组分也具有一定程度的生物活性.虽然藻华期湖水FDOM与陆源高度腐殖化FDOM的荧光光谱相似,但藻华期湖水FDOM相对新鲜,生物降解程度低,所以更易被降解.类腐殖组分的活性规律取决于其化学组成和降解历史[18].相较而言,组分C1比C4的生物活性高,这主要是因为腐殖酸比富里酸的分子质量高,结构更紧实,难以被微生物分解.总体来说,藻华期湖水FDOM的活性程度与其他来源的FDOM不同,具体组分的生物活性有待进一步研究.
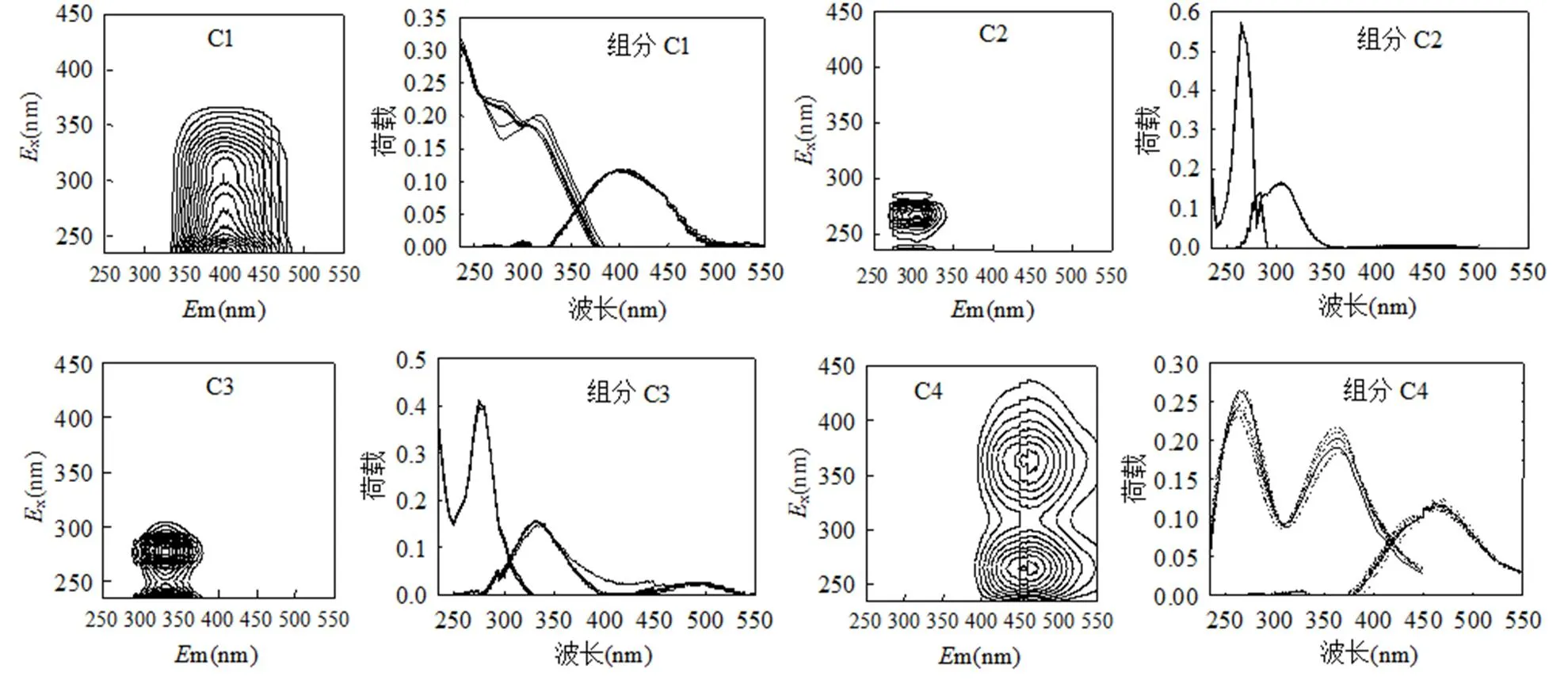
图4 PARAFAC组分的EEM光谱及半检验分析

图5 经历不同生物降解时间后PARAFAC组分变化
a为max值;b为含量百分比
2.3.3 2D–COS分析 藻华期湖水FDOM的同步荧光光谱如图6a所示,232nm处的荧光峰为类酪氨酸物质,275nm处的荧光峰为类色氨酸物质,而326, 364nm处的2个肩峰可分别归为类富里酸和类腐殖酸物质.以降解时间为外部干扰因素,对荧光光谱进行2D–COS分析(图6b和6c).同步图的对角线上,分别在235, 275, 326, 364nm处观察到4个正交峰,而在235/275nm、235/364nm以及275/364nm附近的3个正交叉峰表明类酪氨酸、类色氨酸和类腐殖酸荧光峰的荧光强度变化一致(随生物降解而降低).根据Noda规则[33],异步图可以揭示不同波长处光谱变化的顺序.若1/2处的光谱信号为正,则1处的光谱变化比2处的更迅速;若1/2处的光谱信号为负,则1处的光谱变化落后于2处.在异步图对角线下存在两个负交叉峰,分别位于364/235和364/275nm,而在275/235、326/275以及364/326nm处的光谱信号均为负,这些光谱特征表明四个荧光峰的变化顺序为:235 > 275 > 326 > 364nm.换言之,低激发波长的FDOM对生物降解的敏感性更强.结合PARAFAC结果,虽然类酪氨酸物质对生物降解的敏感度高于类色氨酸物质,但类色氨酸组分的生物活性较高.这可能是因为藻华期DOM中类色氨酸的底物浓度高于类酪氨酸物质,而降解速率一般与底物浓度成正比.与此不同,2D–COS分析中采用通过标准化排除了底物浓度的影响.

a为同步荧光光谱;b为同步图;c为异步图
3 结论
3.1 藻华期湖水DOM生物活性很高,生物降解符合模型,活性,半活性以及非活性DOC分别占40%、37%以及23%.大量活性组分的生物降解将消耗大量溶氧,增加湖泛风险.
3.2 CDOM和FDOM的光谱指标变化说明小分子脂肪族组分生物活性很高,而大分子芳香族组分生物难以被微生物降解,从而DOM腐殖度升高.
3.3 EEM–PARAFAC表明4个荧光组分的生物活性大小为:类色氨酸组分C3>类酪氨酸组分C2>类富里酸组分C1>类腐殖酸组分C4,结合2D–COS进一步发现四个组分的降解顺序为C2 > C3 > C1 > C4.类蛋白组分与类腐殖组分生物活性的异质性表明藻华暴发可改变湖泊水体中的碳源结构,进而影响微生物群落结构.
[1] 王成林,潘维玉,韩月琪,等.全球气候变化对太湖蓝藻水华发展演变的影响[J]. 中国环境科学, 2010,30(6):822-828.
[2] Zhang Y L, Liu X H, Wang M Z, et al. Compositional differences of chromophoric dissolved organic matter derived from phytoplankton and macrophytes [J]. Organic Geochemistry, 2013,55:26-37.
[3] Philippe A, Schaumann G E. Interactions of dissolved organic matter with natural and engineered inorganic colloids: A review [J]. Environmental Science & Technology, 2014,48(16):8946-8962.
[4] Cory R M, Kaplan L A. Biological lability of streamwater fluorescent dissolved organic matter [J]. Limnology and Oceanography, 2012, 57(5):1347-1360.
[5] Wear E K, Carlson C A, James A K, et al. Synchronous shifts in dissolved organic carbon bioavailability and bacterial community responses over the course of an upwelling-driven phytoplankton bloom [J]. Limnology and Oceanography, 2015,60(2):657-677.
[6] 李佐琛,段洪涛,张玉超,等.藻源型湖泛发生过程水色变化规律 [J]. 中国环境科学, 2015,35(2):524-532.
[7] Tan D T, Temme H R, Arnold W A, et al. Estrone degradation: Does organic matter (quality), matter? [J]. Environmental Science & Technology, 2015,49(1):498-503.
[8] 闫金龙,江 韬,赵秀兰,等.含生物质炭城市污泥堆肥中溶解性有机质的光谱特征 [J]. 中国环境科学, 2014,34(2):459-465.
[9] Hansen A M, Kraus T E C, Pellerin B A, et al. Optical properties of dissolved organic matter (DOM): Effects of biological and photolytic degradation [J]. Limnology and Oceanography, 2016,61(3):1015- 1032.
[10] 崔东宇,何小松,席北斗,等.牛粪堆肥过程中水溶性有机物演化的光谱学研究 [J]. 中国环境科学, 2014,34(11):2897-2904.
[11] 李 丹,何小松,高如泰,等.紫外-可见光谱研究堆肥水溶性有机物不同组分演化特征[J]. 中国环境科学, 2016,36(11):3412-3421.
[12] 沈 烁,王育来,杨长明,等.南淝河不同排口表层沉积物DOM光谱特征[J]. 中国环境科学, 2014,(9):2351-2361.
[13] 刘丽贞,黄 琪,吴永明,等.鄱阳湖CDOM三维荧光光谱的平行因子分析 [J]. 中国环境科学, 2018,38(1):293-302.
[14] Hur J, Jung K Y, Jung Y M. Characterization of spectral responses of humic substances upon UV irradiation using two-dimensional correlation spectroscopy [J]. Water Research, 2011,45(9):2965-2974.
[15] Hosen J D, Mcdonough O T, Febria C M, et al. Dissolved organic matter quality and bioavailability changes across an urbanization gradient in headwater streams [J]. Environmental Science & Technology, 2014,48(14):7817-7824.
[16] Mcdowell W H, Zsolnay A, Aitkenhead-Peterson J A, et al. A comparison of methods to determine the biodegradable dissolved organic carbon from different terrestrial sources [J]. Soil Biology & Biochemistry, 2006,38(7):1933-1942.
[17] Murphy K R, Stedmon C A, Graeber D, et al. Fluorescence spectroscopy and multi-way techniques. PARAFAC [J]. Analytical Methods, 2013,5(23):6557-6566.
[18] Weishaar J L, Aiken G R, Bergamaschi B A, et al. Evaluation of specific ultraviolet absorbance as an indicator of the chemical composition and reactivity of dissolved organic carbon [J]. Environmental Science & Technology, 2003,37(20):4702-4708.
[19] Helms J R, Stubbins A, Ritchie J D, et al. Absorption spectral slopes and slope ratios as indicators of molecular weight, source, and photobleaching of chromophoric dissolved organic matter [J]. Limnology and Oceanography, 2008,53(3):955-969.
[20] Baker A, Bolton L, Newson M, et al. Spectrophotometric properties of surface water dissolved organic matter in an afforested upland peat catchment [J]. Hydrological Processes, 2008,22(13):2325-2336.
[21] Cory R M, Mcneill K, Cotner J P, et al. Singlet oxygen in the coupled photochemical and biochemical oxidation of dissolved organic matter [J]. Environmental Science & Technology, 2010,44(10):3683-3689.
[22] Huguet A, Vacher L, Relexans S, et al. Properties of fluorescent dissolved organic matter in the Gironde Estuary [J]. Organic Geochemistry, 2009,40(6):706-719.
[23] Sleighter R L, Cory R M, Kaplan L A, et al. A coupled geochemical and biogeochemical approach to characterize the bioreactivity of dissolved organic matter from a headwater stream [J]. Journal of Geophysical Research-Biogeosciences, 2014,119(8):1520-1537.
[24] Saadi I, Borisover M, Armon R, et al. Monitoring of effluent DOM biodegradation using fluorescence, UV and DOC measurements [J]. Chemosphere, 2006,63(3):530-539.
[25] Ohno T, Parr T B, Gruselle M C I, et al. Molecular composition and biodegradability of soil organic matter: A case study comparing two new England forest types [J]. Environmental Science & Technology, 2014,48(13):7229-7236.
[26] Nguyen M L, Westerhoff P, Baker L, et al. Characteristics and reactivity of algae-produced dissolved organic carbon [J]. Journal of Environmental Engineering-Asce, 2005,131(11):1574-1582.
[27] Maie N, Scully N M, Pisani O, et al. Composition of a protein-like fluorophore of dissolved organic matter in coastal wetland and estuarine ecosystems [J]. Water Research, 2007,41(3):563-570.
[28] Korak J A, Wert E C, Rosario-Ortiz F L. Evaluating fluorescence spectroscopy as a tool to characterize cyanobacteria intracellular organic matter upon simulated release and oxidation in natural water [J]. Water Research, 2015,68:432-443.
[29] 李晓洁,高红杰,郭冀峰,等.三维荧光与平行因子研究黑臭河流DOM [J]. 中国环境科学, 2018,38(1):311-319.
[30] Lee B M, Seo Y S, Hur J. Investigation of adsorptive fractionation of humic acid on graphene oxide using fluorescence EEM-PARAFAC [J]. Water Research, 2015,73:242-251.
[31] Zang X, Van Heemst J D H, Dria K J, et al. Encapsulation of protein in humic acid from a histosol as an explanation for the occurrence of organic nitrogen in soil and sediment [J]. Organic Geochemistry, 2000,31(7/8):679-695.
[32] Guillemette F, Del Giorgio P A. Reconstructing the various facets of dissolved organic carbon bioavailability in freshwater ecosystems [J]. Limnology and Oceanography, 2011,56(2):734-748.
[33] Noda I, Ozaki Y. Two-dimensional correlation spectroscopy: applications in vibrational and optical spectroscopy [M]. London: John Wiley and Sons Inc., 2005.
Biodegradation of dissolved organic matter in Lake Taihu during cyanobacterial blooms.
XU Ming*, LIU Wei-jing,BAI Yong-gang, TU Yong
(Jiangsu Key Laboratory of Environmental Engineering, Jiangsu Provincial Academy of Environmental Science, Nanjing 210036, China)., 2018,38(9):3494~3501
Occurrence of cyanobacterial blooms can induce considerable patchiness in the quantity and quality of dissolved organic matter (DOM). The present study investigated the changes of dissolved organic carbon (DOC), chromophoric DOM (CDOM) and fluorescent DOM (FDOM) in an inoculated 32-day laboratory incubation. The biodegradation of individual FDOM components was further studied using parallel factor analysis (PARAFAC) and two dimension correlation spectroscopy (2D-COS). The results showed that the DOC concentration decreased significantly initially, followed by a slow biodegradation. Fitting bymodel successfully separated the DOC into labile (40%), semi-labile (37%) and refractory (23%) pools, suggesting that 77% of the DOC can be metabolized quickly after its production. The values ofSUVA254, spectral slope ratio, and HIX indicated that the aromaticity, molecular weight, and humic degree of DOM increased with biodegradation. The bioavailability of 4PARAFAC components followed the order of: tyrosine- > tryptophan- > fulvic acid- > humic acid-like component. Tyrosine- and tryptophan-like component accounted for a large proportion of the labile and semi-labile DOM, while the refractory DOM was mainly composed of fulvic-acid- and humic acid-like component. Synchronous fluorescence spectra combined with 2D-COS revealed that the fluorescent compounds with lower excitation wavelengths were preferentially biodegraded.
cyanobacterial blooms;dissolved organic matter;biodegradation;EEM;2D-COS
X524
A
1000–6923(2018)09–3494-08
许 明(1982–),男,江苏连云港人,高级工程师,博士,主要从事水污染控制工程.发表论文20余篇.
2018–02–01
江苏省科技厅社会发展-面上项目(BE2017765);南京市科技计划项目(201716004)
* 责任作者, 高级工程师, yexumingbai@163.com

