矮牵牛‘梅林’遗传转化体系的建立
曹尚杰,焦孟月,张彦妮,岳莉然
矮牵牛(Petunia hybrida)属茄科多年生草本植物,在东北地区常作一二年生栽培。因其花色丰富、适应性强的特点被长期广泛应用于世界各地园林,并被誉为花坛之王;又因其生命周期短、遗传背景清晰、易于进行根癌农杆菌介导的基因导入等优点在开花分子生物学研究上成为模式植物[1],并为植物基因工程中验证基因功能[2-3]及创造新品种提供了有利条件[4]。目前国内外对矮牵牛遗传转化体系的研究较为深入,但矮牵牛再生方式受基因型限制,现有的遗传转化体系通用性不强,不同学者得出的结论也不尽相同[5-7],因此,要在前人的基础上针对不同品种进行试验摸索其适宜的遗传转化体系。
IPT基因在一些植物中表达,均表现出叶片内源细胞分裂素(Cytokinins,CTK)含量增加,植株衰老延缓[8]。早期研究大多使用组成型表达启动子(如CaMV35S)驱动目的基因的表达,但CTK过量表达影响植株正常生长发育,如抑制茎的伸长及侧根形成、丧失顶端优势、植株矮小等[9]。因此IPT基因的转化研究中,对启动子的选择尤为重要。许多研究已证明,SARK启动子调控IPT基因可以在干旱条件下表达,保证较高的CTK含量,增强光合速率,降低作物产量的损失。已有研究获得的转PSARK-IPT基因的水稻、花生、棉花、玉米等作物,在干旱胁迫条件下均表现出降低产量损失的优势,且未改变谷物的主要成分[10-12]。矮牵牛‘梅林’因为开花早、花色多样而在城市园林绿化中应用广泛,但其抗旱性较差,因此可以对其进行分子生物学改良,来提高其抗性,延长其观赏期。目前有关该品种的遗传转化研究尚未见报道,本研究以矮牵牛‘梅林’为材料,旨在建立其遗传转化体系,导入IPT基因,期望获得转基因植株,进一步从中选育出花期延长、花量增加或抗性提高的矮牵牛新品种,为今后利用转基因方法改良矮牵牛品种提供参考。
1 材料与方法
1.1 材料
‘梅林’(‘Merlin’)矮牵牛无菌苗(培养于东北林业大学园林学院实验室)。携带有PSARK-IPT基因的农杆菌菌株PSICHyg-2(由加州大学戴维斯分校的Blumwald Eduardo教授惠赠)保存于东北林业大学园林学院实验室。
1.2 方法
1.2.1 抗生素敏感性试验 在叶片分化培养基(MS+3.0 mg·L-16-BA+0.1 mg·L-1NAA)和生根培养基(1/2MS+0.1 mg·L-1IBA)中添加不同浓度的潮霉素(Hey)(0、1、2、3、4、5 mg·L-1),分别接种预培养2 d的叶盘和生长健壮的不定芽,光照培养15 d,每种处理30个外植体,3次重复,观察统计愈伤及芽的分化情况和不定芽的生长及生根状况,确定合适的抗生素使用浓度。
1.2.2 农杆菌叶盘法转化条件的优化 选取生长健壮的矮牵牛幼苗,将叶片剪成0.5 cm×0.5 cm的叶盘,接种于叶片分化培养基上经过预培养即可用于转化。
1.2.2.1 外植体预培养时间的确定 转化前,将剪好的矮牵牛叶盘分别置于叶片分化培养基上预培养1、2、3、4 d 再用于侵染[用稀释好的菌液(OD600=0.5)侵染3 min],将侵染过的叶片接种于叶片分化培养基上,于28℃黑暗条件下共培养36 h,之后转移到添加有500 mg·L-1的头孢霉素(Cef)和2 mg·L-1的潮霉素的叶片分化培养基。每15 d继代1次,直至长出抗性愈伤组织或抗性芽。统计其抗性愈伤分化率和抗性芽分化率。
1.2.2.2 菌液浓度、侵染时间和共培养时间的确定
在超净工作台上,用稀释好OD600值分别为0.3、0.4、0.5、0.6、0.8、0.9 的菌液侵染预培养(预培养时间选取上面得到的结果)过的矮牵牛叶片,侵染时间分别设置为1、3、5 min和8 min,之后将叶片接种到叶片分化培养基上,置于28℃黑暗条件下完成共培养 24、36、48、60 h,继而接种于筛选培养基(MS+3.0 mg·L-16-BA+0.1 mg·L-1NAA+2 mg·L-1Hyg)上培育,每15 d继代1次,直至长出抗性愈伤组织或抗性芽。统计其抗性愈伤分化率和抗性芽分化率。
1.2.2.3 脱菌头孢浓度的确定 在分化培养基上添加不同浓度的 Cef:0、100、200、300、400、500 mg·L-1。将完成侵染后的外植体接种于上述培养基上,每2 d观察外植体的染菌及生长状况,15 d后统计外植体的染菌率及分化率,确定最适的脱菌浓度。
试验除了处理条件的变化,其他培养条件均相同,每个处理均设置30个外植体,重复3次。之后将具有潮霉素抗性的不定芽接种在添加有4 mg·L-1的潮霉素的生根培养基中进行筛选和生根培养。试验设置2组对照,一组为未转化株系于分化及生根筛选培养基上培养,另一组为未转化株系接种于不添加Hey的分化及生根培养基。
所有MS基本培养基均含含2.5%蔗糖和0.76%琼脂,pH 值 5.8~6.0。培养条件:光照时间 16 h·d-1,光照强度(90±10)μmol·m-2·s-1,温度 24℃,湿度40%。
1.2.3 抗性植株的分子检测 基因组DNA提取及PCR检测:取抗性植株叶片,用基因组DNA提取试剂盒(天根技术有限公司)提取DNA,以此DNA为模板,未转化植株DNA为阴性对照,无菌水为空白对照,PBI101-IPT质粒为阳性对照,SARK-1F:5'-GAAGGAATGCTCGTTGTCTC-3'为上游引物,SARK-1R:5'-GCTTGGCTGCGATGATAC-3'为下游引物,进行PCR扩增。扩增体系为:1μL模板,1 μL上游引物,1 μL 下游引物,12.5 μL 2×Taq PCR Master Mix,9.5 μL ddH2O。扩增条件为:94℃ 预变性 5 min;94℃变性30 s;56℃退火30 s;72℃延伸90 s;72℃延伸10 min;10℃终止;4℃保存,35个循环。扩增产物琼脂糖凝胶电泳检测分析,电压120V,15 min。
RNA提取及 RT-PCR检测:为进一步检测转基因株系,以Trizol为提取试剂,提取抗性植株叶片总RNA,以此RNA为模板,用反转录试剂盒反转率成cDNA,以cDNA为模板进行PCR,PCR体系及条件同上。
1.3 数据统计
运用Excel及SPSS19.0软件对试验数据整理分析。
染菌率=(染菌外植体数/接种外植体总数)×100%
抗性愈伤分化率=(分化抗性愈伤外植体数/接种外植体总数)×100%
抗性芽分化率=(分化抗性芽外植体数/接种外植体总数)×100%
2 结果与分析
2.1 潮霉素对矮牵牛叶片和不定芽筛选压的确定
随着Hey浓度升高,愈伤组织诱导率、不定芽生根率及生根系数逐渐降低(表1),当潮霉素浓度>2 mg·L-1时,愈伤体积变小,且黄化,长势逐渐变差,出芽能力丧失(图1)。生根过程中,随着潮霉素浓度的升高,生根率及生根系数逐渐降低,浓度为5 mg·L-1时,生根率为0(表2)。Hey的浓度也会影响外植体的形态,随着浓度的升高,外植体须根数量减少,根系变短,植株纵向生长受到抑制,当Hey浓度为3 mg·L-1外植体叶片开始出现黄化现象(图2),潮霉素浓度为4 mg·L-1时,外植体基本失去生根能力。综合考虑,把2 mg·L-1潮霉素作为矮牵牛叶片的筛选浓度,4 mg·L-1潮霉素作为矮牵牛不定芽的生根筛选浓度。

表1 不同浓度潮霉素对矮牵牛分化率的影响Table 1 Effects of different concentrations of Hey on leaf differentiation

图1 不同浓度潮霉素对叶片分化的影响Fig.1 Effects of different concentrations of hygromycin on leaf differentiation

表2 不同浓度潮霉素对矮牵牛生根的影响Table 2 Effects of different concentrations of Hey on rooting
2.2 预培养时间对转化效率的影响
随着预培养时间的延长,抗性愈伤形成率呈现先升高后降低的趋势(表3),预培养2 d的抗性愈伤及芽的分化率最高,分别为61.28%和1.60%,预培养4 d,转化率降为0,因此2 d为最佳预培养时间。
2.3 菌液浓度对转化效率的影响
随着菌液浓度的升高,抗性愈伤及抗性芽分化率均先升高后降低(表4),OD600=0.5时,愈伤及芽的分化率达到最大值,所以侵染矮牵牛‘梅林’品种叶片外植体的最适农杆菌菌液浓度OD600为0.5。
2.4 侵染时间对转化效率的影响
侵染时间延长,抗性愈伤及芽的分化率先升高后降低,侵染3 min抗性愈伤及芽分化率最大(表5),因此3 min是矮牵牛转化的最佳侵染时间。

图2 不同浓度潮霉素下矮牵牛生根状况Fig.2 Status of different concentrations of Hey on rooting

表3 预培养时间对矮牵牛转化效率的影响Table 3 Frequency of the transformation of Petunia with different pre-culture time %

表4 OD600值对矮牵牛转化效率的影响Table 4 Frequency of the transformation of Petunia with different values of OD600 %

表5 侵染时间对矮牵牛转化效率的影响Table 5 Frequency of the transformation of Petunia with different infection time
2.5 共培养时间对转化效率的影响
随共培养时间的延长,抗性愈伤及芽分化率先升高后降低。共培养24 h,抗性愈伤分化率低且无抗性芽产生(表6)。共培养时间在48 h及以上时,叶片边缘变褐,叶缘分布少量菌液,后期农杆菌不易控制,且抗性愈伤及芽分化率低。共培养36 h,叶片无明显变化,此时抗性愈伤及芽分化率最高,因此选择36 h为最佳共培养时间。
2.6 头孢浓度对转化效率的影响
转化过程中,农杆菌的控制效果对能否转化成功十分重要。0~200 mg·L-1的 Cef浓度范围对农杆菌的抑制效果较差,染菌率均达100%,此时菌落布满叶片,对受体伤害较大,诱导率为 0(表 7)。300~500 mg·L-1的浓度范围内,随着浓度的升高,农杆菌生长逐渐受到抑制,染菌率逐渐降低,诱导率升高。当Cef浓度为500 mg·L-1,农杆菌生长完全受到抑制,诱导率为61.38%,因此选择500 mg·L-1的头孢浓度作为抑菌浓度,既能对农杆菌起到较好的控制效果,又能保证外植体具有一定的分化率。
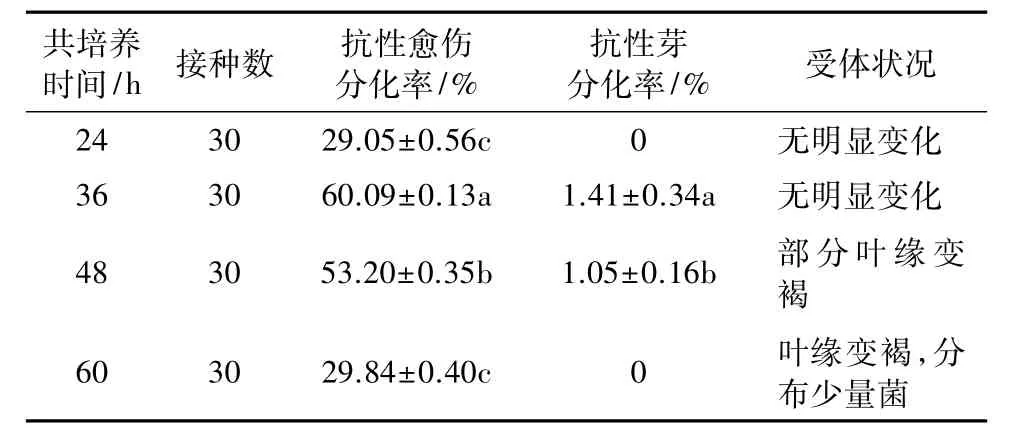
表6 共培养时间对矮牵牛转化效率的影响Table 6 Frequency of the transformation of Petunia with different time of co-cultivation

表7 不同头孢浓度对矮牵牛转化效率的影响Table 7 Frequency of the transformation of Petunia with different Cef contentions
2.7 抗性植株的筛选
以未转化株系为对照,于分化筛选培养基上培养得到黄化的愈伤,不能分化出不定芽,经转化的受体部分可以分化出绿色的抗性愈伤,但大部分没有再分化(图3A、图3B),少数的抗性愈伤可以分化得到抗性芽(图3C),平均转化率仅有1.11%。将转化得到的抗性芽接种于生根筛选培养基上,部分不定芽新叶先黄化,植株逐渐死亡,生长状况与未转化株系类似(图3E、F)。部分植株正常生根且长势较好,与未转化株系生根培养类似(图3D、G)。经生根筛选,初步得到15株具有潮霉素抗性植株。
2.8 抗性植株的分子检测

图3 抗性植株筛选情况Fig.3 The status of screening resistant plants

图4 抗性植株的PCR检测Fig.4 The PCR detection of resistant seedlings
对15株抗性植株的基因组DNA进行PCR检测。在PCR分析中,表达载体(阳性对照)的质粒DNA和12株转基因植物的基因组DNA产生了IPT基因预期的目的片段;在未转化的植物中没有检测到扩增产物(图4)。初步确定5、10、15为假阳性植株,其他为阳性植株。
选择长势较好的8个阳性植株进行RT-PCR检验。植株的总RNA完整可用(图5)。RT-PCR结果显示,IPT基因目的片段在7个转基因株系中扩增出目的条带,但在非转化的植株中未发现(图6),表明IPT基因已经整合到了7个转基因植株的基因组DNA中,在转基因植株中至少在转录水平上表达。
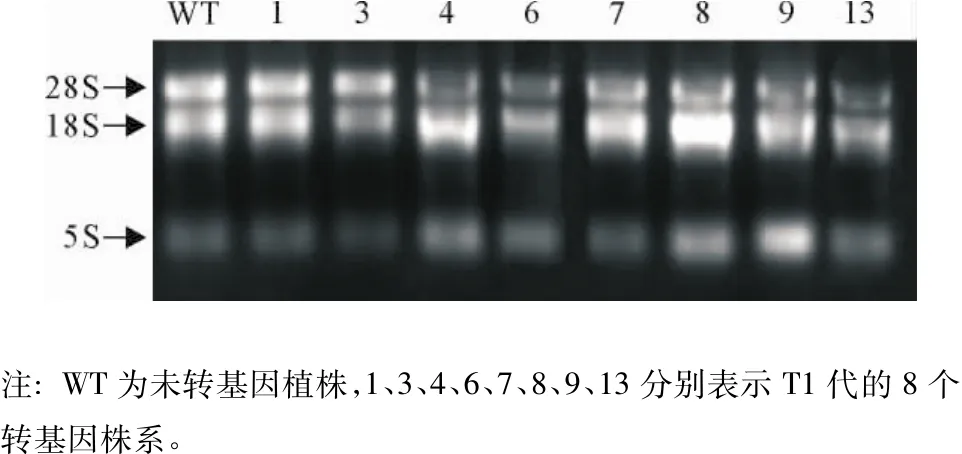
图5 转基因株系的总RNAFig.5 The total RNA of transgenic lines
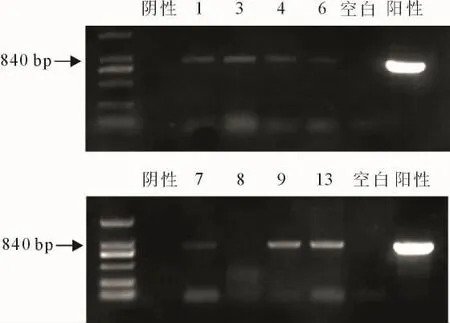
图6 转基因株系的RT-PCR检测Fig.6 The RT-PCR detection of transgenic lines
3 结论与讨论
有关矮牵牛遗传转化的研究已有很多报道,但由于遗传转化效率的基因型依赖性强,故不同品种其研究结果也不同。影响根癌农杆菌介导遗传转化效率的因素主要有预培养时间、菌液浓度、侵染时间、共培养时间和延迟培养等[13]。若转化前不进行预培养,外植体处于受伤状态而十分敏感,直接被菌液侵染会导致叶片因抵抗力差而无法正常生长甚至死亡。适当的预培养一方面可促进细胞分裂,提高外源基因的短期表达和稳定整合率,另一方面可筛选掉污染的外植体,且使外植体适应培养基的培养条件[14]。农杆菌的侵染浓度和侵染时间对转化过程至关重要,菌液浓度过高会使叶片产生过敏性反应,导致在培养中逐渐褐化甚至死亡,侵染时间过长,叶片外植体会由于农杆菌毒害而失去分化能力;菌液浓度过低、侵染时间过短,则减少了T-DNA的整合概率而使转化率降低。共培养是转化过程中十分重要的环节,农杆菌附着在叶片的受伤部位不能立即转化,只有经过适当的共培养才能完成目的基因向植物细胞转移,从而整合到植物基因组的过程[15]。本研究以矮牵牛‘梅林’无菌植株叶片为外植体,通过对比分析不同处理下的侵染效果,筛选出适合于矮牵牛‘梅林’外植体的最适转化条件:预培养2 d,农杆菌侵染浓度为 OD600=0.5,侵染时间3 min,共培养36 h。侵染完成后的延迟培养阶段需要用到选择抗生素和抑菌抗生素,在前人的研究中多采用卡那霉素(Kana)和潮霉素(Hey)作为选择抗生素[6,16],头孢霉素(Cef)作为抑菌抗生素。本研究中,矮牵牛‘梅林’叶片分化及生根对潮霉素浓度比较敏感,2 mg·L-1的Hey就能完全抑制矮牵牛‘梅林’叶片分化,4 mg·L-1的Hey就可以抑制不定根的产生,所以选择2 mg·L-1的Hey作为最适的分化筛选浓度,4 mg·L-1的Hey作为最适的生根筛选浓度。生长转化过程中有效控制农杆菌的生长是转化成功的关键,但抑菌剂不仅对农杆菌有抑制作用,也会影响外植体的分化及生长,抑菌剂的使用浓度以完全抑制农杆菌的生长而不影响外植体分化为宜。孙艳香[17]等研究发现,300 mg·L-1的 Cef为‘交响曲’系列矮牵牛遗传转化适宜的脱菌浓度。而本试验中,500 mg·L-1的Cef才可以达到很好的抑菌效果。
IPT基因与细胞分裂素合成有关,前人研究中,转IPT基因植株会发生形态上的变化。对转基因植株进行生根培养,根系萌发时间、生根率及根系生长状况与未转化植株相似,说明IPT基因未抑制根系的生长。以转基因植株茎段为外植体增殖培养,增殖率明显提高,可能与IPT基因促进CTK合成有关。观察矮牵牛无菌苗的生长,转基因植株易在叶腋处萌发新芽,分枝增加,在转基因山椒等研究中也有相似的形态变化[18]。综上,IPT基因具有增加矮牵牛分枝,矮化植株等功能,且不影响根系的萌蘖。此外,大量研究表明,IPT基因具有提高植株抗性、延长花期、延缓衰老、提高产量等作用,因此对IPT基因在矮牵牛上的功能表达还有待进一步研究。
——矮牵牛

