MicroRNA与心血管疾病的研究进展
贾禹 综述 曾智 审校
(四川大学华西医院心血管内科,四川成都610041)
1 MicroRNA
MicroRNA(miRs)是一个典型的由22个核苷酸构成的具有内含子性质的非编码RNA分子。miRs靶向作用于mRNA的非复制区3’UTR(从编码区末端的终止密码子延伸至多聚A尾巴的末端),抑制mRNA翻译成蛋白质。单个miRs能调节多个基因的表达,调节复杂的生理过程。miRs已被证实在心血管疾病(CVDs)中具有重要作用,且多数miRs在血管重构过程中具有多重作用(见图1)[1]。在本篇主要论述miRs对多种靶基因的调节机制,阐明miRs与血管重构和CVDs的关系(见表1)。
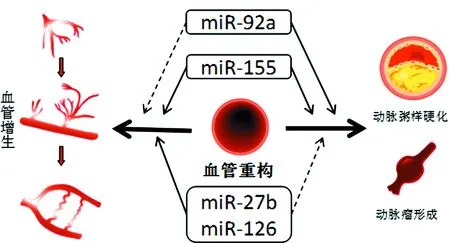
注:数个miRs能影响众多的血管重构过程。MiR-126和miR-27b能促进血管增生,抗动脉粥样硬化。MiR-92a能抑制血管增生,促进动脉粥样硬化。MiR-155对血管增生和动脉粥样硬化同时具有促进作用。实线箭头代表促进,虚线箭头代表抑制。
图1对血管重构具有多重作用的miRs
2 高血压
2.1 MiR-1
既往发现鞘氨醇激酶1(SphK1)的上调与肺动脉高压患者的肺血管重构密切相关;但是潜在机制不详。近期Sysol等[2]发现缺氧诱导的肺动脉平滑肌细胞(PASMCs)中,miR-1受到下调并抑制SphK1的表达。在人PASMCs中过度表达miR-1能抑制基础的和缺氧诱导的细胞增生和转移。此外,在老鼠肺组织中得到同样的结果。经miR-1类似物治疗的大鼠,阻断缺氧诱导的肺动脉高压的发展,以及减缓PASMCs内SphK1的上调。证实miR-1与血管重构密切相关,包括PASMCs的增生、转移,其过度表达可抑制缺氧诱导的肺动脉高压的发生发展。
2.2 MiR-34a
近期研究,Liu等[3]纳入50例原发性高血压及健康者的外周血液标本,用miR-34a抑制剂转染脐静脉内皮细胞,抑制miR-34a表达。试验发现原发性高血压患者组外周血miR-34a明显上调。体外试验显示,抑制miR-34a可促进脐静脉内皮细胞增生、转移和细胞周期(G1/S期)的转化。此外,miR-34a靶向作用于转化生长因子β诱导因子同源异型盒2(TIGF2)基因,促进血管内皮损伤。
2.3 MiR-29
Widlansky等[4]在2型糖尿病患者动脉内皮细胞内发现MiR-29显著下调。拮抗大鼠miR-29b-3p或致突变MiR-29b-1/a,发现大鼠内皮依赖性血管舒张功能(EDVD)受损,一氧化氮水平降低,并诱发高血压。用溶血磷脂酶Ⅰ(Lypla1)治疗2型糖尿病患者、MiR29b-1/a突变大鼠以及miR-29b-3p受拮抗大鼠,可以提高动脉的EDVD。实验证实MiR-29b-1/a通过靶向作用于Lypla1,促进一氧化氮的表达,维持EDVD。
3 主动脉瘤
动脉瘤是动脉局部血管壁扩张大于原血管直径50%,在CVDs治疗中具有巨大挑战。大多数动脉瘤在急性撕裂或者形成夹层后发现,需要紧急开胸或者行修补手术。
3.1 MiR-33
既往研究证明抑制miR-33可以增加高密度脂蛋白并减缓动脉粥样硬化的发展。抑制血管紧张素Ⅱ或者氯化钙诱导大鼠的miR-33表达,均可减缓腹主动脉瘤(AAA)的发展。体外实验显示:miR-33(-/-)的大鼠外周血巨噬细胞可通过灭活氨基末端激酶1(JNK1),减少基质金属蛋白酶-9的表达。miR-33(-/-)小鼠的主动脉血管平滑肌细胞抑制p38促分裂素原活化蛋白激酶(MAPK),减少单核细胞驱化蛋白1的表达。上述两种情况均能增强miR-33的靶基因三磷酸腺苷结合盒转运体A1的表达。抑制miR-33的受试小鼠以及miR-33骨髓转移的多种受试者,AAA的形成均受到抑制[5]。
3.2 MiR-103a
Jiao等[6]发现,血管紧张素Ⅱ诱导的小鼠AAA样本中,解聚素金属基质蛋白酶10(ADAM10)蛋白表达明显增加。ADAM10特异性抑制剂GI254023X可减少巨噬细胞向小鼠腹主动脉渗入。在细胞水平发现,miR-103a-1抑制ADAM10的表达,而拮抗miR-103a-1可增加ADAM10的表达。尤其在小鼠AAA中,miR-103a表达减少,ADAM10表达增加。实验证实miR-103a通过靶向抑制ADAM10表达,抑制AAA形成,为AAA治疗提供一种新的可能。
3.3 MiR-24
在小鼠AAA中,发现miR-23b/27b/24群下调,其中miR-24下调最为显著。通过原位杂交,在鼠主动脉瘤组织内有外膜的巨噬细胞中发现了miR-24的存在。实验证实,巨噬细胞活化后,miR-24作用于壳多糖酶3样蛋白1(CHI3L1),驱使炎性基因的表达。小鼠AAA模型实验证实,促进miR-24表达可加速AAA形成,反之亦然[7]。
4 动脉粥样硬化
动脉粥样硬化是冠心病、脑梗死、外周血管病的主要原因。脂质代谢障碍为动脉粥样硬化的主要病变基础。
4.1 MiR-126
近期Schober等[8]将患有高脂血症鼠内膜剥蚀14~28 d后,拮抗miR-126组鼠和对照组鼠比较损伤面积增加,内皮细胞增殖减少,颈动脉腔内皮恢复也受损。作者证实miR-126-5p的靶基因是δ类同源物1(DLK1),在人类动脉粥样硬化损伤中,miR-126-5p水平以及DLK1表达和损伤型巨噬细胞数量呈负相关,并且对内皮细胞的增殖有正性作用。表明miR-126-5p水平上升有抗动脉粥样硬化作用。
4.2 MiR-155
最近,Tian等[9]证明了miR-155靶向作用于高迁移率族蛋白1(HMGB1),从而抑制髓系特异性锌指蛋白2并增强巨噬细胞对氧化低密度脂蛋白的摄取。提升miR-155水平可靶向作用于HMGB1,增加氧化低密度脂蛋白水平,诱导泡沫细胞的形成。系统抑制鼠的miR-155可减少动脉粥样硬化斑块和富含脂质的巨噬细胞。
4.3 MiR-27b
MiR-27b与胆固醇和脂质代谢具有密切关系,并可作为动脉粥样硬化和肥胖潜在的治疗靶点,但其体内效应并不确定。近期,Hsu等[10]用石斑鱼生成的转基因miR-27b-SP,可破坏miR-27b活性,导致血管内脂质沉积、非酒精性脂肪肝等。实验发现miR-27b-SP增强过氧化物酶体增殖因子活化受体γ 和CCAAT增强子结合蛋白-α(C/EBP-α)的表达,促进脂质和脂肪再生。证实miR-27b在早期的脂质和脂肪的形成中,具有重要调节作用。
5 心力衰竭
5.1 MiR-29a
心肌肥厚患者的miR-29a血清学水平明显高于单纯的高血压患者。miR-29a作用于转化生长因子β(TGF-β)信号转导途径,激活血管重构相关蛋白如基质金属蛋白酶-9、Ⅰ和Ⅲ型胶原蛋白[11]。在压力负荷的老鼠模型中,使用miR-29a拮抗剂组大鼠的心肌细胞肥大受到抑制,心肌肥厚的指标心房钠尿肽和β-心肌肌球蛋白重链明显下降。实验证实在高压力的作用下,miR-29a可促进心室肌细胞的重构和肥大,促进心力衰竭发生发展[12]。
5.2 MiR-185
Kim等[13]利用主动脉狭窄的老鼠模型,发现miR-185在肥厚心肌细胞中明显下调。为了确定miR-185能对抗心肌肥厚,实验对照过度表达和敲除miR-185的心肌肥厚老鼠,实验发现miR-185的上调可以对抗心肌肥厚效应,表明了miR-185在心肌细胞中具有抗心肌肥厚作用,实验进一步明确了miR-185的靶基因为钙调素依赖蛋白激酶2D(CaMKⅡδ)、钠钙交换体亚型和T细胞活化核因子(NFAT),利用特定双荧光素酶活性和免疫印迹实验证实,NFAT和CaMKⅡδ受miR-185抑制,实验证明miR-185作用多个靶基因和信号转导途径,可有效抑制心肌肥厚,并作为潜在心力衰竭药物治疗。
5.3 MiR-221/222家族
MiR-221-3p和miR-222-3p在人类及大鼠心肌病理组织中明显上调,在扩张型心肌病或者主动脉狭窄伴有严重心肌纤维化的病理组织中,与非纤维化的心肌组织相比miR-221/222明显减少。抑制血管紧张素Ⅱ诱导的高压力负荷大鼠的miR-221/222,发现心室的纤维化增加,扩张度加剧,收缩及舒张功能明显下降。实验证实,miR-221/222靶向作用于TGF-β信号转导途径基因,包括JNK1、应激活化蛋白激酶1、TGF-β受体1、TGF-β受体2以及原癌基因1。因此miR-221/222可缓解压力负荷诱导的心力衰竭发展[14]。
6 心律失常
6.1 MiR-1
细胞内运输系统功能紊乱与CVDs密切相关。近期研究发现表达miR-1的实验组大鼠,有着更频繁的运输相关的生物学过程,如对钙离子的转运。突出融合蛋白6(Stx6)在老鼠心肌梗死后或缺氧后的心肌细胞中减少,并进一步证明miR-1靶向作用于它。沉默心肌细胞Stx6,可损害L型钙离子通道,导致钙离子外流,而过度表达Stx6,其结果相反。实验证实,miR-1可抑制Stx6,导致细胞内钙离子调控异常,发生心律失常[15]。
6.2 MiR-21
近期,Huang等[16]经人工造模心包炎大鼠,发现信号传导子及转录激活子3(STAT3)和miR-21明显上调。抑制STAT3使miR-21下调,可改善心房纤维化,减少纤维化相关基因的表达,减少心房传导的不均一性,减少心房颤动发病率。而抑制miR-21,可减少STAT3的磷酸化,并产生相同效应。实验证实,miR-21和STAT3在心肌受损后,协同作用诱导心房颤动。
7 思考与展望
由于蛋白质组成的复杂性,并存在翻译后修饰、水解、变性等,寻找具有特异性、敏感性的蛋白标志物困难重重[17]。而miRs与传统蛋白生物标志物相比具有以下优势:低复杂性、无加工修饰、可合成高亲和“捕获”试剂、良好的稳定性等。李晨等[18]综述了miRs对心肌梗死早期诊断的应用价值,列出miR-499[19]、miR-208[20]、miR-1 与miR-133[21],证实其具有高效的敏感性和特异性,并具有早期诊断的优势,无疑为心肌梗死的诊断提供了新思路;但是,上述研究存在以下不足:样本量较小、单中心实验、受试人群单一、miRs标志物的选择有一定的随机性,因此有待进一步的大样本临床研究。miRs在检测技术及速率均不及超敏肌钙蛋白,这种情况或许是目前用于临床检验的最大障碍。
沉默大鼠miRs基因、病毒转导等试验用于治疗与血管重构相关的CVDs正在迅速发展,若用于临床,有必要警惕体内miRs沉默步骤中的脱靶效应及miRs治疗的潜在毒性[22]。故讨论miRs与血管重构的关系,有望对CVDs的预防、诊断、治疗反应、新治疗方案及预后评估提供新的方向,并促进对miRs的深入研究。
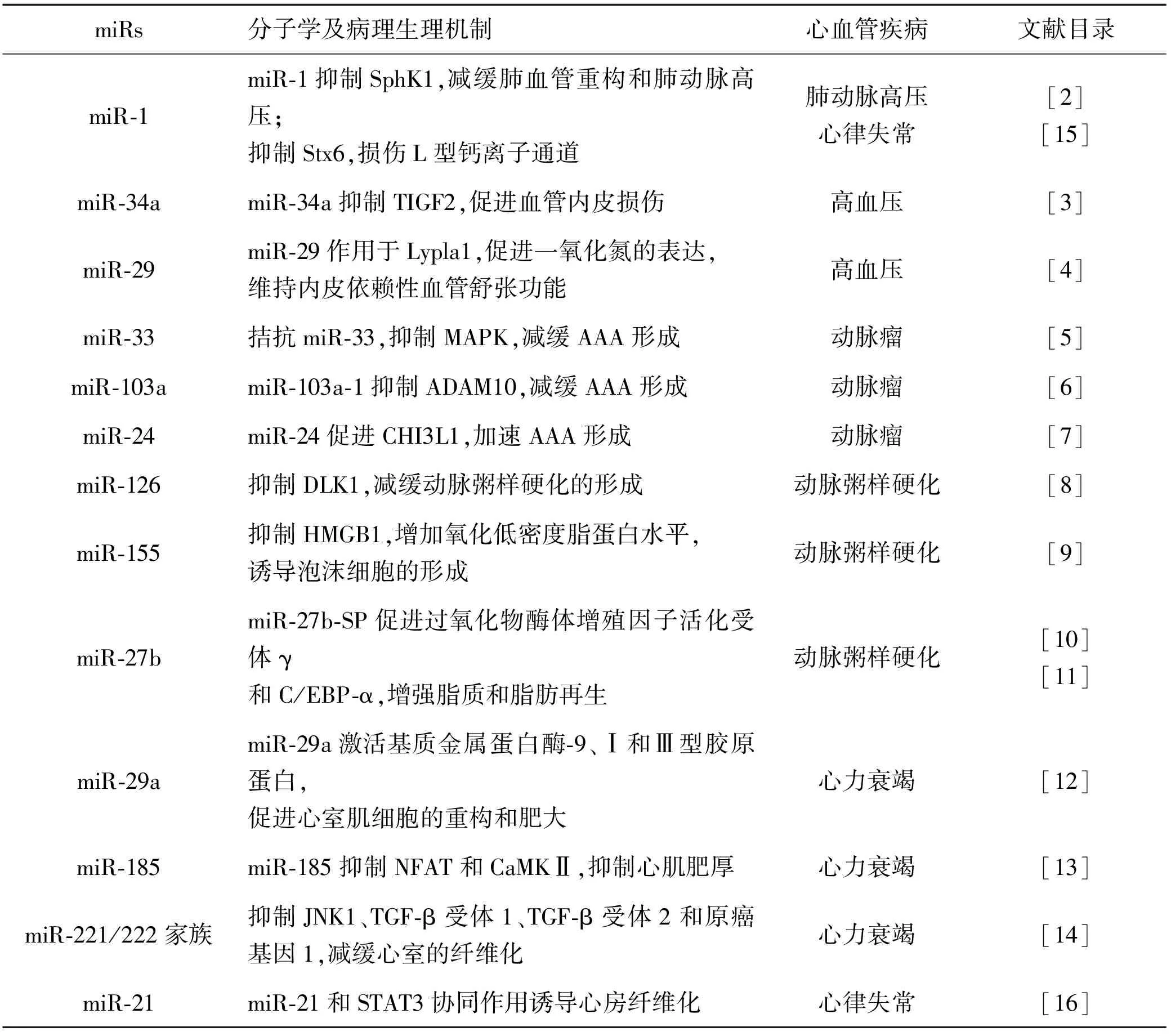
表1 参与调控血管重构的miRs

