围手术期新型抗血小板及抗凝药物管理
闫伟国 综述 杨树森,2 审校
(1.哈尔滨医科大学研究生院,黑龙江哈尔滨150081;2.哈尔滨医科大学附属第一医院心内科,黑龙江哈尔滨150001)
全球每年有1 000万人死于动脉血栓事件(缺血性卒中、心脏病和外周坏疽)。血小板是动脉血栓形成的关键因素,几十年来,阿司匹林一直是首选的抗血小板药物。在欧盟,每年有50万与静脉血栓栓塞有关的死亡事件[1],静脉血栓主要由纤维蛋白和一些被网罗其中的血细胞组成。抗凝药物是预防或治疗这些疾病的有效手段,华法林和肝素是最常使用的药物。然而,随着对药物机制研发的不断深入,新型的抗血小板及抗凝药物也已相继问世。
对于临床工作而言,越来越多的患者需个体化、精准化的抗血小板及抗凝剂治疗,尤其是在外科手术的患者中的应用,这使得抗血栓药物的处理逐渐成为了心血管疾病诊治管理过程中极具有挑战性的部分。因此,本文将对抗血小板药物和抗凝药物的药理特性、围术期的使用情况、出血并发症处理以及一些与药物相关的实验室分析做一综述。
1 抗血小板药物
血小板黏附、活化和聚集是由众多黏附因子介导,这些黏附因子的活化又会加剧内皮损伤或斑块破裂的病理过程,最终导致动脉闭塞,引发短暂性或持续性缺血,有效阻断血栓形成过程可以预防此类缺血事件的发生发展。预防或治疗动脉血栓的策略正在不断更新,联合抗血小板药物治疗方案及用药时程,高度依赖于疾病的潜在风险程度及处理方案(表1)[2]。
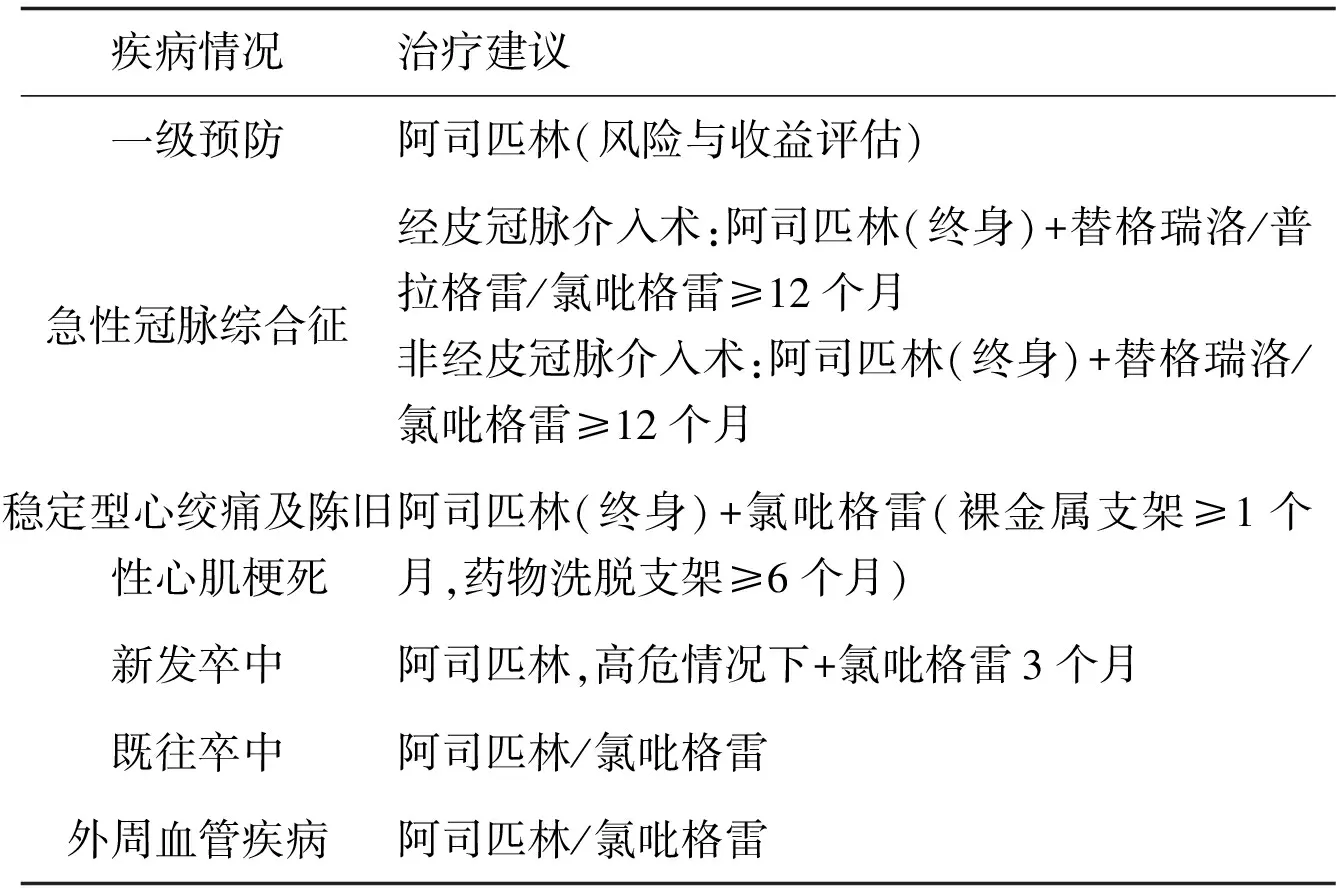
表1 抗血小板药物的治疗建议
1.1 抗血小板药物种类及药理作用
1.1.1 乙酰水杨酸(阿司匹林)
阿司匹林是一种环氧化酶抑制剂,通过抑制血栓素A2合成来抑制血小板。阿司匹林对血小板的抑制作用是不可逆的,大约7~10 d[3]。低剂量(75~100 mg)阿司匹林的出血风险低,而抗血小板作用与高剂量(300 mg)相当。大约有30%的患者接受阿司匹林治疗失败(血栓并发症或死亡),依从性差是一个重要原因,但很难被量化[4]。
1.1.2 P2Y12受体拮抗剂
P2Y12受体是在血小板表面表达的腺苷二磷酸受体,可以通过化学方式阻断。氯吡格雷、普拉格雷、替格瑞洛是目前临床使用的P2Y12受体拮抗剂,坎格雷洛最近也获得了FDA许可。这些药物与阿司匹林联合使用,即双联抗血小板治疗(DAPT)。
氯吡格雷是一种新型的噻吩吡啶类衍生物,其活性代谢产物不可逆转地与P2Y12结合。对于快速启动血小板抑制,需要初始负荷剂量。其药理作用持续到受影响的血小板的寿命终止。 CYP450依赖使氯吡格雷易受药物的影响[5]。30%使用氯吡格雷治疗的患者没有表现出足够的血小板抑制作用,遗传多态性或细胞内信号通路改变似乎是其原因[6]。
普拉格雷是第三代口服噻吩吡啶类药物,它不可逆转地与P2Y12结合,抑制血小板作用。普拉格雷显示了比氯吡格雷更可靠的活性药物转化作用和更快、更有效的抗血小板作用。遗传多态性不影响普拉格雷的代谢。
替格瑞洛是一种口服的非噻吩吡啶类可逆P2Y12阻滞剂,其活性代谢物产物也具有较强的血小板抑制作用。研究发现,在同时使用替格瑞洛和地高辛的情况下应监测地高辛浓度,一些他汀类药物(如洛伐他汀)与替格瑞洛联合应用时血药浓度会增加[7]。
坎格雷洛是FDA批准的最新静脉注射非噻吩吡啶类可逆型P2Y12受体拮抗剂。不需要初始负荷剂量,血小板抑制达90%以上。坎格雷洛可被血浆酶灭活,血小板功能在停止注射的60 min内恢复正常。这些良好的药代动力学特性使坎格雷洛成为治疗围手术期高危患者的一种很有前景的抗血小板药物[8]。
1.1.3 糖蛋白Ⅱb/Ⅲa受体抑制剂
糖蛋白Ⅱb/Ⅲa(GpⅡb/Ⅲa)受体是血小板表面最大量的蛋白质,其激活可产生持续的血栓形成效应[9]。GpⅡb/Ⅲa受体抑制剂阻断了纤维蛋白原对活化血小板的黏附,阻止了血小板桥的构建,对纤连蛋白、血管假性血友病因子、玻连蛋白的黏附性均有抑制作用。阿昔单抗、替罗非斑和依替巴肽是目前正在使用的GpⅡb/Ⅲa受体拮抗剂。
阿昔单抗可在1 min内可逆地与血小板结合,需使用负荷剂量。替罗非班和依替巴肽是合成的GpⅡb/Ⅲa受体拮抗剂,能够可逆地与GpⅡb/Ⅲa受体结合并迅速分离(10~15 s),替罗非班对受体的亲和力大于依替巴肽[10]。
1.1.4 其他抗血小板药物
西洛他唑和双嘧达莫是一种磷酸二酯酶抑制剂,可干扰环磷酸腺苷和环磷酸鸟苷的降解。蛋白酶激活受体-1拮抗剂,如沃拉帕沙,主要通过其他途径抑制血小板活化,许多其他血小板表面蛋白(如糖蛋白Ⅵ)是目前正在研究的潜在靶点。
1.2 围手术期抗血小板治疗的管理
对于冠状动脉支架术后患者行外科手术而言,双联抗血小板药物治疗在围手术期可显著地减少动脉血栓事件,然而不间断地应用抗血小板药物治疗可造成较高的出血风险。合理选择手术适应证、优化抗血小板治疗方案以及评估栓塞和出血的相对风险并加以权衡至关重要。
对于出血风险低的外科手术,可以不终止抗血小板药物治疗。对于出血风险高的外科手术,应停用阿司匹林和其他抗血小板药物,并在术前停用足够长的时间,以使血小板功能恢复,降低术中出血风险。对于血栓栓塞事件风险较低且出血风险高的患者,应在围手术期中断抗血小板药物治疗。对患者进行出血风险的连续性评估,以指导术中和术后的治疗策略[11]。
高出血风险患者停用抗血小板药物治疗后,心血管事件发生率显著增加,因此,可以考虑应用抗血小板药物治疗的桥接策略。目前已有关于替罗非班和依替巴肽作为桥接方案的报道。最近,坎格雷洛因其药代动力学特点,被推荐作为一种合适的桥接药物。通常情况下,一旦围手术期无出血风险,应尽早恢复DAPT。肝素类药物也可用于进行桥接处理,但由于它们对冠状动脉内血栓或支架血栓形成无明确抑制作用,因此,肝素并不是抗血小板药物的合适替代品。
1.3 出血的管理
出血是抗血小板药物最常见的副作用。抗血小板药物治疗引起的主要外科出血增加了围手术期并发症的发生率和死亡率。当患者血红蛋白< 80 g/L或血细胞压积<25%时,推荐限制性输血管理策略[12]。目前,尚无抗血小板药物的有效拮抗剂。大出血的处理均是建立在氨甲环酸、纤维蛋白原、因子Ⅷ、去氨加压素、血小板和活化因子Ⅶa基础上的,这些药物的致血栓性特征可能引起血栓形成等严重并发症。
1.4 药物监测和实验室检查
目前,临床上有许多血小板功能测试方法,例如:浊度透光率测量、血栓弹力图和VerifyNow。这些检测方法最初都被用来识别血小板功能(功能障碍或者过度活跃),随着越来越多的抗血小板药物的应用,抗血小板药物在疗效上表现出显著的个体差异,这些检测分析方法就显得更加重要,可以通过检测血小板功能进行药物监测、个体化药物治疗的设计、围术期评估和手术计划变更等[13]。
2 抗凝血药物
抗凝药物能抑制凝血和纤维凝块的形成和发展,主要用于治疗或预防静脉血栓栓塞和心房颤动引发的血栓栓塞。最近,低分子肝素和抗Ⅹa因子药物(黄达肝葵钠)已广泛地取代了普通肝素。口服抗凝药用于长期治疗或预防不同心血管疾病的血栓栓塞并发症,如静脉血栓栓塞、心肌梗死或心房颤动以及机械瓣膜植入术后[14]。
2.1 抗凝药种类及药理作用
2.1.1 非口服抗凝药物
肝素通过使抗凝血酶构象发生变化,大大激活抗凝血酶的作用,加速Ⅱa、Ⅸa、Ⅹa、Ⅺa和Ⅻa的失活。普通肝素的抗凝作用呈剂量依赖性,低分子肝素做预防性治疗时,可使用固定剂量,也可根据体重调整剂量,以加强抗凝治疗[15]。黄达肝葵钠可以选择性地与抗凝血酶Ⅲ结合,抑制Ⅹa,进而阻断凝血酶的形成和血栓的进展,直接凝血酶抑制剂,如阿加曲班和比伐卢定[16]。
2.1.2 口服抗凝药
在过去近80年的时间里,维生素K拮抗剂是临床最常用的口服抗凝剂。在双香豆素、华法林之后,又合成了苯丙香豆素和阿肯辛醇[17]。这些药物主要通过抑制维生素K还原酶,阻断维生素K依赖性凝血因子的合成,起到抗凝作用[18]。维生素K拮抗剂存在一定的局限性,影响药物效果,如:基因多态性使不同患者药物敏感性存在差异。因此,在达到预期抗凝效果的过程中,药物剂量个体间差异较大,这必将导致药物剂量不足或过量,引发出血或血栓栓塞。
2.1.3 新型口服抗凝药
2004年,西美加群获得欧洲医疗机构许可,成为第一个进入市场的口服凝血酶抑制剂;但因其潜在的肝毒性,很快就被停用[19]。2008年以来,直接凝血酶抑制剂——达比加群酯和Ⅹ因子抑制剂——利伐沙班、阿哌沙班和依度沙班逐渐进入临床。其他新型口服抗凝药(NOACs)也正在临床试验阶段。达比加群酯是一种低分子量的直接凝血酶抑制剂,通过离子相互作用直接结合到凝血酶活性部位。 与肝素不同,达比加群酯可抑制由凝血酶引起的血栓进展。
阿哌沙班是一种直接的选择性Ⅹa因子抑制剂,它可以抑制游离及与血栓结合的Ⅹa因子。阿哌沙班口服后迅速被胃和小肠吸收,不受食物的影响。阿哌沙班代谢由CYP3A4介导,同时使用CYP3A4和P-糖蛋白诱导剂(如卡马西平)能够导致阿哌沙班血药浓度降低。
利伐沙班是一种口服、直接、高选择性和可逆性Ⅹa因子抑制剂,利伐沙班生物利用度随食物摄入量的增加而增加,致使血浆浓度更容易预测。与CYP3A4抑制剂或诱导剂以及P-糖蛋白抑制剂联合治疗是(相对)禁忌,因为它可能导致利伐沙班的血浆浓度改变[20]。
依度沙班是一种直接、高度选择性和竞争性Ⅹa因子抑制剂。联合使用强P-糖蛋白抑制剂(如酮康唑)会增加依度沙班的效果,需要减量使用。低体重(<60 kg)或中度肾功能损害患者也需调整剂量[21]。
2.2 围手术期管理
在所有接受口服抗凝药物治疗的患者中,有10%的患者因有创性治疗在某一时刻不得不中断其使用。在目前的临床实践中,桥接疗法被广泛应用于口服抗凝剂的暂时替代。最近的数据表明,这种方法增加了围手术期出血的风险,而且对心房颤动患者血栓栓塞并发症的影响不大。最重要的是,需考虑两个主要方面情况:(1)干预有关的出血风险;(2)围手术期血栓栓塞的风险(见表2)[22]。
低出血风险患者不需要停止口服抗凝药,如孤立性心房颤动或CHA2DS2-VASc≤4,桥接是有问题的,因为出血风险超过患者血栓栓塞并发症的风险。高出血风险患者需桥接治疗,以弥补维生素K拮抗剂的停药。所有中等栓塞风险(CHA2DS2-VASc>4)并带有中度出血风险的患者干预措施都可能需要对个人出血和血栓栓塞风险进行估计[23]。
与维生素K拮抗剂的围手术期管理不同,目前的数据不支持用术前桥接治疗弥补NOACs的围手术期撤药。 NOACs中断的建议依赖于药物血浆半衰期和患者的合并症,尤其是肾功能。如果药物消除减少或围手术期出血风险增高,停药的时间应延长。对于小型外科手术可不间断抗凝治疗。对于出血风险高的外科手术应停用NOACs 。如果进行紧急手术,需对NOACs的适应证进行评估。如可行,建议手术延迟至少24 min[24]。

表2 手术患者动脉和静脉血栓栓塞风险分类方法
2.3 出血的管理
轻度出血可采用基本措施处理,包括压迫止血、硬化治疗、控制血压等,通常不需药物纠正凝血功能。如果发生严重出血(大于患者血容量的20%),应及时查明潜在原因,采取一般措施,包括避免和纠正酸中毒、低体温和低钙血症[25]。
部分情况下需要止血治疗,包括凝血酶原复合物或激活的前凝血酶原复合浓缩物,后者更有效,但也更容易引起血栓栓塞并发症。重组Ⅶa因子可作为抢救药物使用。诸如氨甲环酸或去氨加压素等药物可考虑应用,但关于其功效的临床资料较少。
2.4 药物监测和实验室试验
目前,临床上有许多凝血功能测试方法,例如:活化部分凝血酶时间、凝血酶抑制剂试验与凝血酶时间等。与维生素K拮抗剂相比,NOACs避免了常规实验室监测。最常用的凝血试验(活化部分凝血活酶时间和国际标准化比值)受NOACs的影响。凝血测定的变化程度取决于NOAC的血药浓度。此外,通常的检测结果表明缺乏显著的NOAC效应。对于检测服用达比加群酯的患者,活化部分凝血活酶时间尤其适用[26]。
3 联合使用抗血小板药物和NOACs
在临床工作中,接受抗血小板治疗和NOAC治疗的患者较多。数据显示,当使用单一抗血小板治疗时,NOACs对缺血性事件提供了更多益处。服用DAPT(阿司匹林和氯吡格雷)的患者,在没有进一步减少严重心血管意外的情况下,也会增加3倍的出血风险。使用更强的抗血小板药物(替格瑞洛和普拉格雷),潜在的出血风险更高,尽管证实这一结论的数据尚不充足。对于那些可能受到DAPT(包括普拉格雷和替格瑞洛)和NOACs联合治疗的患者来说,用个性化的治疗方案来权衡潜在的收益与出血风险是必要的。减少剂量可能是一个潜在的策略,但需研究证实,对于长期使用NOACs和DAPT的个别患者的适应证应被定期评估[27]。
4 结论
对于外科医生及麻醉师而言,了解新型抗血小板药物和NOACs的特性非常重要,因为他们对于围手术期出血患者的管理至关重要。因为围手术期伴随着明显的血栓风险,这种风险必须与使用抗血小板或抗凝药物治疗所导致的出血相平衡。两种情况都有较高的发病率和死亡率。随着越来越多抗血小板和抗凝药物的使用,大多数外科医生及麻醉师经常面对这一困境。
复杂的实验室检查在紧急情况下是不能及时发挥作用的,但标准的实验室测试,如活化部分凝血活酶时间、国际标准化比值、基本的血小板功能测试可快速完成,并对治疗策略提供相应的指导,对高危患者进行手术治疗前进行多学科的讨论也非常必要。

