EOFAZ抑制TNF-α诱导的血管新生和炎症损伤
付凌云, 杨 红,林 丹,黄妮雯,徐旖旎,陶 玲,沈祥春
(贵州医科大学药学院 1. 天然药物资源优效利用重点实验室、2. 药用植物功效与利用国家重点实验室、3. 贵州省普通高等学校天然药物药理与成药性评价重点实验室、4. 贵州省特色天然药物资源高效利用工程中心,贵州 贵阳 550025)
国内外研究表明,心血管疾病(cardiovascular diseases,CVDs)的高发病率和高死亡率已经严重威胁到人们的身心健康,预计到2020年,将成为世界首要致死原因[1]。动脉粥样硬化(atherosclerosis,AS)是CVDs的主要风险因素,以血管内膜形成纤维斑块为特征,主要累及大动脉和中动脉,使动脉壁变硬,管腔狭窄,中膜弹性减弱。已经证实AS是一种慢性炎症疾病,炎症是AS早期阶段的关键事件,贯穿AS病理过程的始终[2]。
AS斑块破裂是促进AS发展的一个重要原因,炎症诱导内皮细胞的血管新生是AS斑块由稳定转换为不稳定的首要因素[3]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是最关键的血管新生促进因子,在血管新生的过程中,它通过和自身的特异性受体结合而发挥生物活性。VEGF受体-2(VEGFR-2)是VEGF发挥生物活性最关键的受体,故VEGFR-2的表达在血管新生相关信号通路中具有重要的作用[4]。研究表明,在心血管系统中,血管内皮细胞是炎性细胞因子肿瘤坏死因子α(tumor necrosis factor α,TNF-α)重要的作用靶点,它能够诱导内皮细胞VEGFR-2分泌增加,促进血管新生,且该过程受到细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)的调控[5]。
贵州地产民族药艳山姜为姜科山姜属植物艳山姜Alpiniazerumbet(Pers.) Burttet Smith的干燥成熟果实,具有温中燥湿、行气止痛、截疟之功效[6]。研究表明,艳山姜的主要活性成分艳山姜挥发油(essential oil of FructusAlpiniaezerumbet,EOFAZ)具有广泛的抗炎、抗氧化、镇痛、防治心血管系统疾病等多方面的生物活性[7-9]。目前,国内只有本实验室在对EOFAZ进行相关实验研究,但EOFAZ对TNF-α诱导的血管新生及炎性损伤的作用及机制还未明确。因此,本研究主要探讨EOFAZ对TNF-α诱导的血管新生及炎性损伤的作用及机制,旨在为EOFAZ在预防和治疗CVDs方面提供新的治疗策略。
1 材料
1.1EOFAZ的提取和配制艳山姜的果实采集于贵州省贞丰县,经贵州医科大学药学院生药学与药用植物学教研室龙庆德教授鉴定为姜科山姜属植物Alpiniazerumbet(Pers.) Burttet Smith 的干燥成熟果实。水蒸气蒸馏法提取,无水硫酸钠除水后,于4 ℃长期保存。取50 μL(约为44.5 mg)EOFAZ于10 mL的EP管中,加入4 400 μL的二甲基亚砜完全溶解,即可得到浓度为1×107μg·L-1的EOFAZ母液,用1.5 mL的棕色EP管分装于4 ℃冰箱保存。临用时,用无血清培养基稀释成所需浓度。DMSO的终浓度不超过0.1%。
1.2实验动物与细胞昆明种♂小鼠,4~6周龄,体质量(20 ± 2)g,由贵州医科大学实验动物中心提供,动物生产许可证号:SCXK(黔2018-0001),使用许可证号:SYXK(黔2018-0001)。人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)购自美国ScienCell公司(批号:8000)。
1.3试剂内皮细胞培养基购自美国ScienCell公司;Matrigel基质胶购自美国BD公司;重组人/鼠TNF-α购自Peprotech公司;阿司匹林标准品购自中国食品检定研究所(批号:100113-201405);U0126购自Gene Operation Datasheet公司(批号:IMA1001-OO25MG);VEGFR-2抗体和GAPDH抗体购自Proteintech公司;VEGFR-2和GAPDH引物购自贵阳金工科技有限公司;小鼠VEGFR-2酶联免疫分析试剂盒,购自上海酶联生物科技有限公司。
1.4仪器3020-426多功能全波长酶标仪(Thermo公司);CFX型凝胶成像系统、Universal Hood Ⅱ型实时荧光定量PCR系统仪(Bio-Rad公司);XDS-2B倒置显微镜(日本尼康公司)。
2 方法
2.1动物模型的制备与分组60只昆明种小鼠按体质量随机分为5组:对照组、模型组(TNF-α 100 μg·kg-1)、单独EOFAZ组(0.18 g·kg-1)、EOFAZ组(TNF-α+EOFAZ 0.18 g·kg-1)、阿司匹林组(TNF-α+阿司匹林200 mg·kg-1),每组12只。对照组和模型组每日灌胃生理盐水1次,单独EOFAZ组和EOFAZ组每日灌胃EOFAZ 1次,阳性药组每日灌胃阿司匹林1次,各组连续给药7 d。各组末次给药2 h后,除对照组和单独EOFAZ组外,其余各组腹腔注射TNF-α建立小鼠急性炎症损伤模型。干预24 h后,颈动脉插管取血,室温3 500 r·min-1离心10 min收集血清,用于VEGFR-2酶联免疫分析实验,分离小鼠胸主动脉用于HE染色实验。
2.2细胞培养与分组用含有5%胎牛血清、1%内皮细胞生长因子、1%青霉素/链霉素的内皮细胞培养基,将HUVECs接种在25 cm2的培养瓶中,于37 ℃、5% CO2和95%湿度的细胞培养箱中培养。根据细胞生长情况进行细胞换液和常规传代培养,实验所用细胞均为3~6代。选取生长良好的细胞,经无血清培养基同步化6 h后,先用EOFAZ、阿司匹林或U0126预处理1 h,再用TNF-α诱导24 h。实验分为对照组、模型组(TNF-α 20 μg·L-1)、EOFAZ不同剂量组(TNF-α+EOFAZ 0.25、0.5、1.0 μg·L-1)、阳性药组(TNF-α+阿司匹林0.25 mmol·L-1)、ERK抑制剂组(TNF-α+U0126 10 μmol·L-1)、EOFAZ不同剂量组与ERK抑制剂联用组(TNF-α+EOFAZ 0.25、1.0 μg·L-1+U0126 10 μmol·L-1)。
2.3检测指标
2.3.1 HUVECs血管新生检测 细胞按“2.2”分组给药处理后,胰蛋白酶消化法制备成细胞悬液,以4×108·L-1的密度将细胞接种于包被了冷冻的基底膜基质(10 g·L-1)的24孔板中。将细胞培养板放入细胞培养箱,在37 ℃、5% CO2的条件下孵育6 h,小心将孔中培养基吸去,加入PBS洗3次,倒置显微镜采集照片,对小管成环数量进行统计。实验独立重复5次。
2.3.2 Western blot检测HUVECs中VEGFR-2蛋白表达 经药物干预后,每瓶细胞中加入适当的裂解液提取蛋白,用BCA蛋白定量试剂盒测定浓度。将25 μg的蛋白在10% SDS-PAGE中电泳,转膜,封闭,加入一抗(VEGFR-2为1 ∶1 000,GAPDH为1 ∶10 000)4 ℃孵育过夜。TBST洗膜3次后,二抗(1 ∶7 000)孵育1 h。再次洗膜后,ECL化学发光试剂盒显色,然后将膜置于凝胶成像系统曝光,随后用Image-Lab软件对数字图像进行量化。实验独立重复3次。
2.3.3 Real-time PCR检测HUVECs中VEGFR-2 mRNA表达 经药物干预后,根据试剂盒说明书提取总RNA,然后将提取的RNA进行反转录合成cDNA,最后按照两步法PCR扩增标准程序95 ℃、30 s进行预变性,95 ℃、5 s和62.5 ℃、30 s进行30个循环的扩增,检测VEGFR-2的基因表达。以GAPDH为内参基因,采用CFX-Manager软件进行统计。引物序列见Tab 1,实验独立重复3次。
2.3.4 小鼠胸主动脉HE染色分析 小鼠胸主动脉分离后,于10%中性福尔马林中固定,常规石蜡包埋,切片后HE染色,光学正置显微镜下采集照片。
2.3.5 ELISA法检测小鼠血清VEGFR-2水平 将经过药物干预的小鼠血清收集之后,根据试剂盒说明书操作。

Tab 1 Primer sequences of VEGFR-2 and GAPDH

3 结果
3.1EOFAZ和U0126对TNF-α诱导HUVECs中血管新生的影响病理性的血管新生是促进AS斑块不稳定的主要原因,ERK信号通路在血管新生中具有重要的调控作用[8]。通过体外血管新生实验,检测EOFAZ和ERK抑制剂U0126对TNF-α诱导HUVECs血管新生的影响。如Fig 1所示,与对照组相比,TNF-α干预细胞后,HUVECs血管新生小管成环数量明显增加,而给予EOFAZ和U0126预处理后,能明显抑制TNF-α诱导HUVECs血管新生小管成环的数量(P<0.01)。
3.2EOFAZ下调TNF-α诱导HUVECs中VEGFR-2的蛋白表达VEGFR-2是血管新生中一个重要的调控分子[10]。如Fig 2所示,与对照组相比,TNF-α能够上调HUVECs中VEGFR-2的蛋白表达,而EOFAZ预处理能明显抑制TNF-α诱导HUVECs中VEGFR-2的蛋白表达。
3.3EOFAZ下调TNF-α诱导小鼠血清中VEGFR-2的水平动物实验进一步分析EOFAZ对TNF-α诱导小鼠血清中VEGFR-2分泌水平的影响。如Fig 3所示,与对照组相比,单独给予EOFAZ时,对VEGFR-2的分泌水平没有影响,差异无显著性。提示EOFAZ本身对小鼠VEGFR-2的分泌水平没有影响。而TNF-α干预后,小鼠血清中VEGFR-2的水平明显升高,EOFAZ预处理能下调TNF-α诱导小鼠血清中VEGFR-2的水平,差异具有显著性(P<0.05)。以上结果提示,EOFAZ可能通过下调VEGFR-2的表达,抑制TNF-α诱导HUVECs血管新生。
3.4EOFAZ通过VEGFR-2-ERK信号通路抑制TNF-α诱导的HUVECs血管新生研究表明,VEGFR-2-ERK信号通路在血管新生中具有极为重要的作用[4],为了进一步研究EOFAZ抑制TNF-α诱导HUVECs血管新生的作用机制,采用EOFAZ和ERK抑制剂U0126联用处理HUVECs。如Fig 4所示,与TNF-α组相比,ERK抑制剂U0126能明显抑制TNF-α诱导HUVECs中VEGFR-2蛋白和mRNA的表达,提示ERK信号通路能够调控VEGFR-2的表达。

Fig 1 EOFAZ and U0126 inhibited number of tube formation in TNF-α-induced HUVECs n=5)
A: The tube formation figures (×50). a: Control group; b: TNF-α group (20 μg·L-1); c: EOFAZ group (1.0 μg·L-1); d: EOFAZ group (0.5 μg·L-1); e: EOFAZ group (0.25 μg·L-1); f: Aspirin group (0.25 mmol·L-1); g:U0126 group (10 μmol·L-1) ; B: The tube formation statistical figure.##P<0.01vscontrol group;**P<0.01vsTNF-α group.
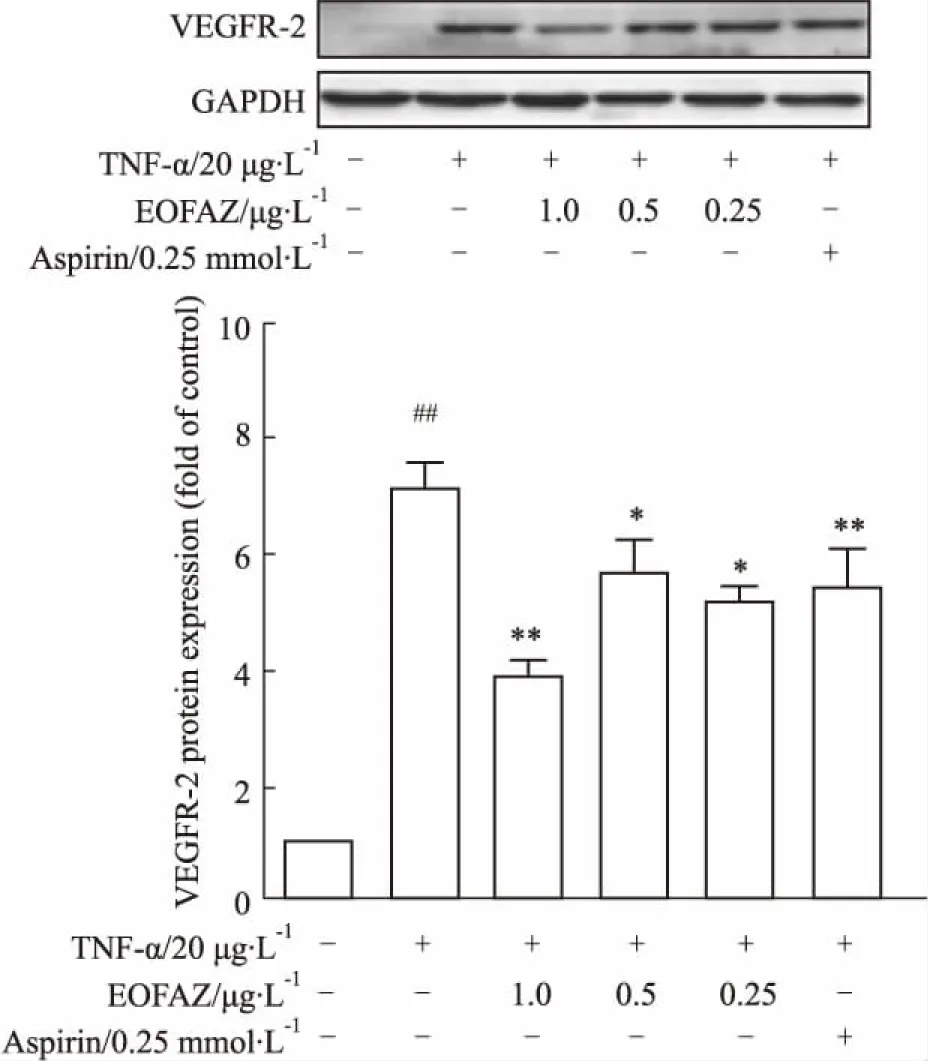
Fig 2 EOFAZ inhibited protein expression of VEGFR-2 in TNF-α-induced HUVECs n=3)
##P<0.01vscontrol group;*P<0.05,**P<0.01vsTNF-α group

Fig 3 EOFAZ down-regulated expression of VEGFR-2 in serum of TNF-α-induced mice n=12)
##P<0.01vscontrol group;*P<0.05,**P<0.01vsTNF-α group
单独的U0126干预组和EOFAZ与U0126联用干预组都能抑制VEGFR-2蛋白和mRNA表达,但差异无显著性,提示EOFAZ可能是通过ERK通路,下调VEGFR-2的表达。
3.5EOFAZ抑制TNF-α诱导小鼠胸主动脉中炎性细胞浸润动物实验研究EOFAZ对TNF-α诱导小鼠胸主动脉炎性损伤的作用。如Fig 5所示,对照组中小鼠胸主动脉外膜、中膜及内膜均未见炎性细胞浸润;TNF-α干预后,可见小鼠胸主动脉外膜和中膜有明显的炎性细胞浸润(图中红色箭头所指处),而给予EOFAZ预处理可明显抑制小鼠胸主动脉中炎性细胞的浸润。

Fig 4 Combination of EOFAZ and U0126 down-regulated protein and mRNA expressions of VEGFR-2 in TNF-α-induced HUVECs
A: The protein expression of VEGFR-2; B: The mRNA expression of VEGFR-2.##P<0.01vscontrol group;*P<0.05,**P<0.01vsTNF-α group.
4 讨论
血管新生是AS重要的病理学特征,在AS易损斑块中发现有大量的血管新生,血管新生对维持AS斑块的稳定性具有重要的作用[10]。VEGFR-2是VEGF的高亲和性受体,是调控血管新生的重要分子。正常的血管内皮细胞中,VEGFR-2也有表达,本研究通过体外培养HUVECs,采用血管新生实验,观察TNF-α对HUVECs血管新生的影响,并应用EOFAZ对上述过程进行干预。

Fig5EOFAZinhibitedinflammatorycellsinfiltrationinthoracicaortaofTNF-α-inducedmice(×400)
A: Control group; B: TNF- α group (100 μg·kg-1); C: EOFAZ group (0.18 g·kg-1); D: EOFAZ 0.18 g·kg-1+ TNF-α 100 μg·kg-1; E: Aspirin 200 mg·kg-1+ TNF-α 100 μg·kg-1.当细胞受到TNF-α等炎性细胞因子刺激时,会使细胞内VEGFR-2的表达上调,参与内皮细胞增殖,促进内皮细胞血管新生,加快AS进程[11-12]。因此,抑制炎性细胞因子诱导的内皮细胞血管新生,已经成为延缓AS斑块破裂的重要治疗靶点。
研究结果发现,TNF-α能够诱导HUVECs大量血管新生,可见小管成环数量明显增多,而EOFAZ干预后,HUVECs小管成环数量明显降低。同时,Western blot和动物实验发现,TNF-α能够上调HUVECs中VEGFR-2的蛋白表达及小鼠血清中VEGFR-2的水平,EOFAZ干预后,能够明显下调HUVECs中VEGFR-2的蛋白表达及小鼠血清中VEGFR-2的水平。提示EOFAZ对TNF-α诱导HUVECs血管新生的抑制作用可能与下调VEGFR-2表达有关。
ERK是丝裂原激活蛋白激酶家族中的主要成员之一,主要参与细胞的增殖过程。研究表明,TNF-α等炎性细胞因子刺激,能够激活内皮细胞中的ERK信号,从而对内皮细胞血管新生及VEGFR-2的表达进行调控[13]。我们采用ERK抑制剂U0126对细胞进行干预,进一步研究EOFAZ抑制TNF-α诱导HUVECs血管新生及VEGFR-2表达的作用机制。结果发现,U0126能够明显抑制HUVECs血管新生小管成环数量及VEGFR-2的表达。更重要的是,在Western blot和qRT-PCR实验中,单独U0126干预组和U0126与EOFAZ联用干预组都能够明显抑制TNF-α诱导HUVECs中VEGFR-2蛋白和mRNA的表达,但差异无显著性,提示EOFAZ下调TNF-α诱导HUVECs中 VEGFR-2的表达可能与ERK信号通路有关。
本研究还通过TNF-α干预小鼠,观察EOFAZ对TNF-α诱导小鼠炎性损伤的影响。结果表明,TNF-α干预后,增加了小鼠胸主动脉外膜和中膜炎性细胞的浸润,说明我们建立的炎性损伤模型是成功的。而给予EOFAZ干预后,能够明显抑制炎性细胞的浸润,提示EOFAZ能够抑制TNF-α诱导的小鼠炎性损伤。
综上所述,EOFAZ能够抑制TNF-α诱导的HUVECs中血管新生及小鼠炎性损伤,其机制可能与通过ERK信号通路抑制VEGFR-2的表达有关。
(致谢:本实验于贵州医科大学天然药物优效利用重点实验室完成,感谢实验室各位老师的悉心指导以及同学的帮助!)