不同微生物对魔芋低聚甘露糖的降解与利用比较
蒋敏,王苗,李恒,史劲松
(江南大学 药学院,江苏 无锡,214122)
功能性低聚糖是一种只能被结肠微生物发酵利用的重要功能因子。大量现代科学研究证明其可以通过调节肠道微生态预防、干预甚至治疗慢性代谢性疾病。随着对低聚糖研究的逐步深入,人们发现相同低聚糖对不同人群作用效果不同,这是由于不同人群的肠道微生物具有多样性和特异性,而不同肠道微生物对相同低聚糖利用的速率和程度各不相同,代谢产物也存在较大差异[1-2]。因此探究低聚糖与肠道微生物之间的关系,对实现低聚糖的个性化治疗具有重要意义。
魔芋低聚甘露糖(konjac mannon oligosaccharide, KMOS)是一种广泛存在于植物(如魔芋粉、瓜儿豆胶、田菁胶)与微生物(如酵母)新型功能低聚糖。据报道,其具有多种生理功能,包括降脂[3]、调节人体多部位(如皮肤[4]、肠道[5]、生殖器[6]等)的微生态环境等。机理研究表明KMOS可通过以下几条途径调节肠道菌群结构:(1)能够选择性地促进肠道内有益菌的增殖,秦清娟等[7]通过小鼠盲肠内容物体外厌氧发酵发现KMOS可被肠道菌有效利用,明显增加肠道益生菌(双歧杆菌、乳酸菌)的数量;王敏等[8]将KMOS掺入到饲料中饲喂大鼠30 d,发现与对照组相比,KMOS饲喂组大鼠盲肠内容物中双歧杆菌和乳酸菌明显增加。(2)能被代谢成有益的代谢产物,如挥发性脂肪酸等。(3)竞争性占据肠道上甘露糖受体,从而抑制有害菌在肠道内的吸附等。
尽管KMOS对益生菌的选择性增殖作用已被大量体外和体内研究证实,但KMOS对肠道微生物的具体影响机制,如不同肠道微生物对KMOS的利用规律、代谢产物的种类和含量等目前尚不明确。为了进一步解析KMOS益生机制,本研究选择了3株不同来源的、可降解利用KMOS的微生物(Bifidobacteriumadolescentis,Bacteroidesuniformis,Lactobacillusjohnsonii),研究比较三者对KMOS的降解利用规律及代谢产物,为开发KMOS为主体的功能性食品提供科学依据。
1 材料与方法
1.1 实验设备与材料
DG 250厌氧培养工作站,Don Whitley Science公司;高温灭菌锅,致微厦门仪器有限公司;pH计,梅特勒-托利多(上海)有限公司; GC-2010型气相色谱仪,日本Shimadzu公司;高效液相色谱仪(U 3000),赛默飞(中国)有限公司;酶标仪,美国分子有限公司。
KMOS由成都永安制药有限公司提供;乙酸、丙酸、丁酸(正丁酸、异丁酸)、戊酸(正戊酸、异戊酸)、己酸、乳酸、琥珀酸等标准品均购自上海源叶生物科技有限公司; G型薄层层析硅胶板购自青岛海洋化工有限公司;Bifidobacteriumadolescentis,Bacteroidesuniformis,Lactobacillusjohnsonii为本实验室分离筛选保藏的菌种。其他试剂均为分析纯,购自国药集团化学试剂有限公司。
1.2 培养基及试剂
种子培养基(g/L):葡萄糖8.0、 胰蛋白胨3.0、 酵母提取物4.5、 No.3胆盐0.4、L-半胱氨酸盐酸盐0.8、 氯化血红素0.05、 NaCl 4.5、 KCl 2.5、 MgCl2·6H2O 0.45、 CaCl2·6H2O 0.2、 KH2PO40.4、 1 mL Tween 80、2 mL微量元素(MgSO4·7H2O 3.0、 MnCl2·4H2O 0.32、 FeSO4·7H2O 0.1、CoSO4·7 H2O 0.18、CaCl2·2H2O 0.1、 ZnSO4·7H2O 0.18、 CuSO4·5H2O 0.01、 NiCl2·6H2O 0.092),pH值6.5,121 ℃湿热灭菌20 min,待用。
发酵培养基:上述种子培养基中以KMOS(0.22 μm过滤除菌)代替葡萄糖,其他成分均一致。
1.3 实验方法
1.3.1 菌种活化及静态培养
参考文献方法[9],取-80 ℃保菌管中保存的菌种,接种至种子培养基中,活化24 h后以0.1 g/L接种量转接至新鲜的50 mL除氧发酵培养基中,厌氧培养工作站(H2, CO2,N2的体积分数分别为10%,10%和80%)静态厌氧发酵72 h。定期取样,检测OD值,4 ℃,12 000 r/min离心,除去菌体,获得发酵上清,待测。每个样品设定3个平行。
1.3.2 检测
1.3.2.1 KMOS的降解情况
采用薄层层析色谱法(TLC)检测KMOS在厌氧发酵过程中被降解利用的情况。展开剂为V(正丁醇)∶V(乙酸)∶V(水)=2∶2∶1,显色剂为苯胺-二苯胺溶液磷酸溶液(精确称取4 g二苯胺,与4 mL苯胺、20 mL 8.5 g/L磷酸溶液共溶解于200 mL丙酮,现用现配,避光保存)。
取不同时间的发酵上清,在硅胶薄层板上点样,上样量为5 μL,点样后放入预饱和层析缸中密闭静置,层析结束后,将显色剂均匀的喷洒在硅胶板上,105 ℃加热10 min,显色拍照。随后立即采用Image J软件对薄层色谱的组分斑点进行灰度积分,用于表征组分相对含量(%)。
1.3.2.2 有机酸的测定
取500 μL待测液,加入200 μL的ZnSO4溶液(300 g/L)与200 μL亚铁氰化钾溶液(106 g/L),充分混匀后,12 000 r/min离心10 min,除去蛋白及杂质,取上清用0.22 μm的滤膜进行过滤,待测。
采用高效液相色谱仪检测有机酸含量,色谱柱:Waters Atlantis T3,4.6 mm×250 mm,5 μm;流动相:20 mmol/L NaH2PO4,pH 2.7(用磷酸调);流速:0.7 mL/min;柱温:30 ℃;检测波长:UV 210 nm。
1.3.2.3 短链脂肪酸(short chain fatty acid, SCFA)的测定
取8 mL待测液置于15 mL顶空瓶中,将老化后的75 μm Car/PDMS萃取头插入样品瓶顶空部分,50 ℃吸附30 min,吸附后的萃取头取出后插入气相色谱进样口,于250 ℃解吸3 min,同时启动仪器(SCION SQ 456-GC)采集数据。
采用气相色谱法检测发酵液中SCFA种类以及含量,色谱柱: DB-WAX 30 mol/L (I.D.0.32 mm,5 μm);升温程序为50 ℃保持3 min,然后以6 ℃/min升温速度升温至120 ℃,并保持0.5 min, 再以6 ℃/min升温速度至220 ℃,并保持5 min; 载气为N2和H2,流速分别设定为3 mL/min与47 mL/min;空气流量为400 mL/min;样品进样量为1.0 μL;分流比1∶3。
1.3.3 统计分析
统计学分析采用SPSS 19.0软件进行,实验结果以平均值±标准差表示。
2 结果与分析
2.1 微生物生长情况
微生物生长情况如图1所示。分析可见,3种菌在培养基中均生长良好,但增殖趋势差异较大。其中Bifidobacteriumadolescentis与BacteroidesuniformisU的生长曲线趋势相近,均可分为2个阶段,其中Bifidobacteriumadolescentis在0~36 h内处于对数期,36 h时菌体数量达到最大值(OD600约为0.45),随后进入稳定期,菌体数量保持稳定;与Bifidobacteriumadolescentis相比,BacteroidesuniformisU增长速度较快,0~6 h时处于生长对数期,6 h时OD600值已达到0.4左右,随后进入稳定期,OD600值基本保持稳定;与前两者不同的是,Lactobacillusjohnsonii的生长曲线分为3个阶段,即首先在0~6 h内快速增长,6~60 h内仍保持生长,但增长速度明显下降,在60~72 h时增殖速度又有所提高。由此可推测,3株菌对KMOS的利用存在明显的差异。
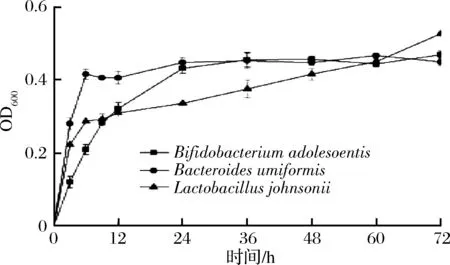
图1 不同菌株生长曲线(n=3)Fig.1 The growth curves of different bacteria in vitrofermentation (n=3)
2.2 不同菌株对KMOS组分利用情况
为了进一步了解这3株菌对KMOS组分利用的特性,采用TLC定性检测KMOS组分变化,并结合TLC斑点灰度积分对组分的相对含量进行半定量检测。结果如图2、图3和图4所示。综合可见,不同菌株对KMOS的利用存在异同点,其主要体现在三者均主要利用KMOS低分子组分,但对组分的利用规律存在明显差异。
由图2-A可见,Bifidobacteriumadolescentis能够利用DP 2、3、4的组分,但三者的利用速率和程度存在明显不同。相对含量分析图2-B显示,在发酵初期,Bifidobacteriumadolescentis优先快速利用DP 2组分,在24 h时,DP 2组分基本已经被消耗完全,而DP 3、4组分在此时才逐步开始被利用,且利用速率和利用程度明显低于DP 2组分,数据表明在72 h时DP 3组分被消耗80%,而DP 4组分仅被消耗50%。
由图3-A可见,72 h内,拟杆菌主要利用聚合度DP≤3的低分子组分,而DP>3的组分几乎不能被利用。图3-B数据表明,DP 2、3组分均在发酵初期就开始被BacteroidesuniformisU使用,其中DP 2组分在9 h内被利用完全,而DP 3组分则需要36 h才能消耗完全,说明BacteroidesuniformisU对DP 2组分的利用效率要明显大于DP 3组分。
由图4-A可见,Lactobacillusjohnsonii主要利用DP 2、3组分,从相对含量分析数据(图4-B)可见,Lactobacillusjohnsonii对组分的使用存在明显的迟滞性,其在36 h时才开始利用DP 2组分,在48 h时开始利用DP 3组分,但2个组分均在72 h时几乎被消耗结束。
2.3 有机酸的检测结果
大量文献表明,功能低聚糖在肠道内被微生物降解利用后可产生大量有机酸,其在肠道内既可以降低消化道pH值,改善生理环境,又可以发挥有效的抑菌杀菌效果,改善生态环境。3株菌产有机酸结果如图5所示。由图可知,随着发酵的进行,三者产物中乳酸持续积累,在发酵末期,乳酸积累量几乎一致,但是发酵产乳酸的规律明显不同。其中BacteroidesuniformisU产乳酸的速率明显高于其他两者,这与菌体生长曲线及KMOS利用规律相一致,说明BacteroidesuniformisU能在迅速利用KMOS用于生长并产生乳酸。由图可见,其乳酸积累曲线可分为两个阶段,即在0~24 h内乳酸产量快速增加,24 h时积累量达到4 mmol/L,随后乳酸积累量仍不断增长,但是增长速率显著减缓,72 h时达到最大积累量(5.03 mmol/L);而Bifidobacteriumadolescentis与Lactobacillusjohnsonii乳酸积累曲线趋势一致,两者均呈缓慢持续性增长,直至72 h时达到乳酸最大积累量(分别为5.06 mmol/L与4.79 mmol/L),结合生长曲线与KMOS利用情况,推测这可能是由于两者对KMOS组分的利用存在一定迟滞性造成。
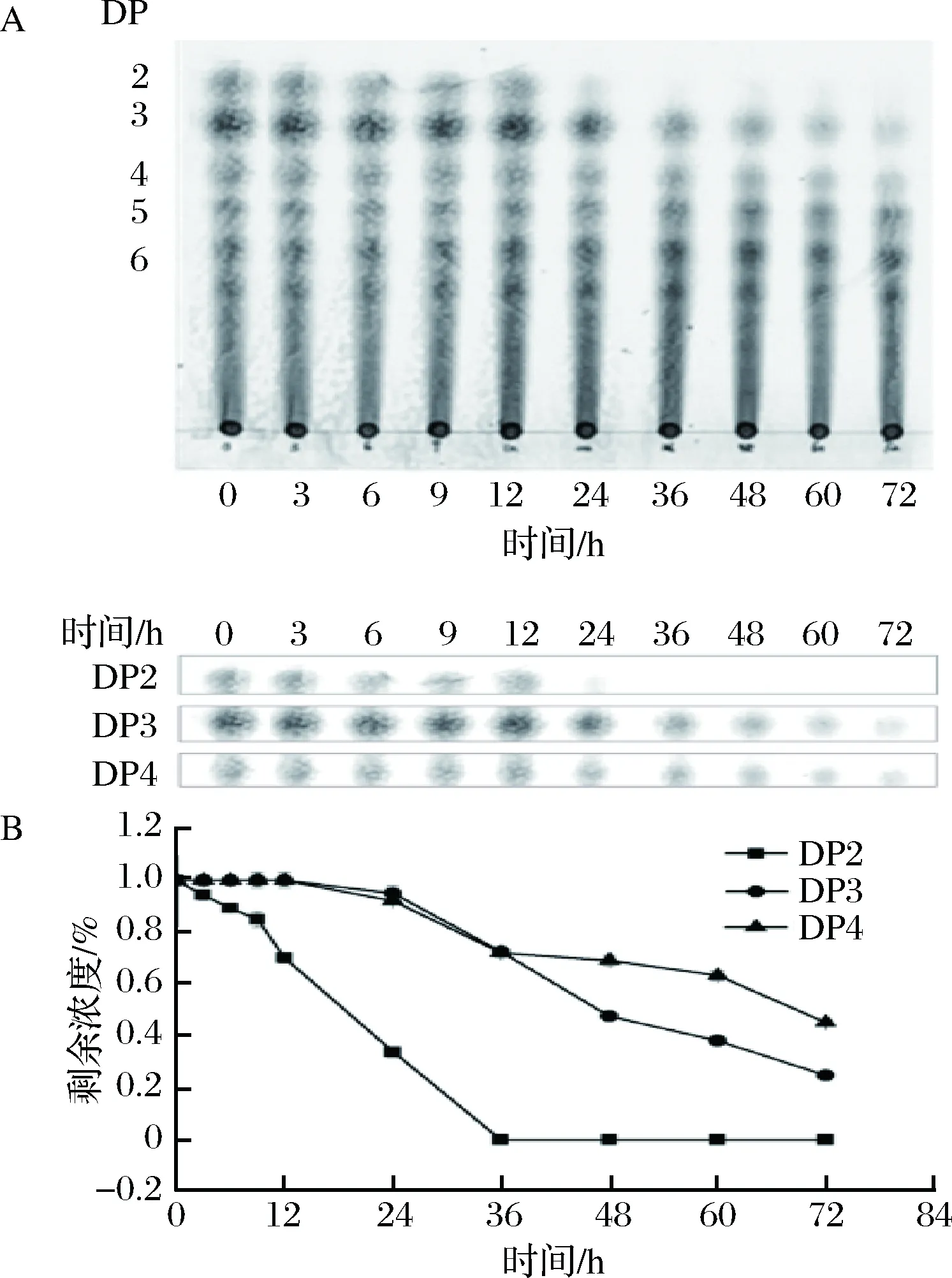
A-TLC; B-相对含量图2 TLC分析Bifidobacterium adolescentis在厌氧发酵过程中对KMOS的降解Fig.2 TLC analyze the degradation of KMOS by Bifidobac-terium adolescentis in vitro fermentation
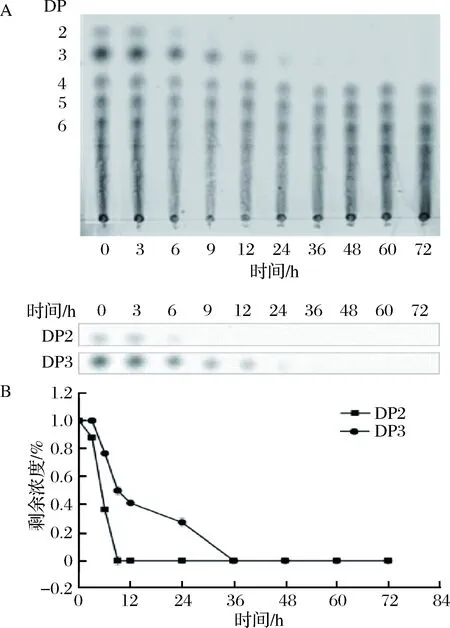
A-TLC; B-相对含量图3 TLC分析Bacteroides uniformis U在厌氧发酵过程中对KMOS的降解Fig.3 TLC analyze the degradation of KMOS by Bact-eroides uniformis in vitro fermentation

A-TLC; B-相对含量图4 TLC分析Lactobacillus johnsonii在厌氧发酵过程中对KMOS的降解Fig.4 TLC analyze the degradation of KMOS by Lacto-bacillus johnsonii in vitro fermentation

A-乳酸; B-琥珀酸图5 不同菌产有机酸情况分析(n=3)Fig.5 The production of organic acids in vitro fermentation(n=3)
对琥珀酸积累过程(图5-B)分析发现,三者均存在琥珀酸二次积累现象,但积累速率和积累量有明显差异。由图可见,0~12 h内三者快速积累琥珀酸,随后基本保持稳定,在36~72 h时琥珀酸又出现二次积累。比较发现,Lactobacillusjohnsonii两次产琥珀酸的速率明显高于其他两者,且在72 h时Lactobacillusjohnsonii琥珀酸积累量最高,达到5.38 mmol/L,分别是Bifidobacteriumadolescentis与BacteroidesuniformisU的3.6和5.5倍,说明Lactobacillusjohnsonii具有较强的产琥珀酸能力。此外,结合菌体生长曲线以及KMOS利用规律,推测Lactobacillusjohnsonii在发酵后期快速产生琥珀酸的原因是由于在48~72 h时,随着KMOS被Bifidobacteriumadolescentis与BacteroidesuniformisU的大量消耗,菌体生长已处于稳定期,而此时Lactobacillusjohnsonii不仅仍处于生长活跃期,且KMOS组分在此阶段才开始逐渐被利用。
2.4 SCFA检测结果
SCFA又称易挥发性酸,是肠道微生物发酵碳水化合物的主要代谢产物,主要包括乙酸、丙酸、丁酸、戊酸、己酸等,具有重要的生理活性,其可以降低结肠的pH值,控制有害酶的作用,抑制非耐酸的细菌,沉淀胆盐,降低血清胆固醇等,同时也可以抑制革兰阴性菌的生长,促进双歧杆菌和乳酸菌等有益菌的生长[10]。本实验采用气相色谱法(GC)检测不同肠道菌利用KMOS生长72 h产SCFA情况,结果如表1所示。数据表明,3株菌发酵均能产生乙酸、丁酸、戊酸、己酸,而未检测到丙酸,这与之前报道[1,11]不相一致,这可能是由于体外单菌发酵与菌群发酵差异所造成,也有可能是丙酸以乳酸(2-羟基丙酸)的形式存在[2]。乙酸均是3株菌主要SCFA产物,约占各自SCFA总量的90%~95%。比较可见,BacteroidesuniformisU乙酸产量最高,72 h达到(98.6±0.7)×10-5g/mL,Bifidobacteriumadolescentis乙酸产量次之,为(72.1±0.9)×10-5g/mL,Lactobacillusjohnsonii最低,为(55.0±0.9)×10-5g/mL。
对肠道菌产丁酸数据分析可知,72 h时,Bifidobacteriumadolescentis丁酸产量最高,最大值为(14.0±0.1)×10-5g/mL,其次是BacteroidesuniformisU,72 h达到(8.7±0.2)×10-5g/mL,Lactobacillusjohnsonii最低,产量为(4.8±0.1)×10-5g/mL。
Bifidobacteriumadolescentis戊酸产量最高,达到(5.4±0.7)×10-5g/mL,BacteroidesuniformisU与Lactobacillusjohnsonii戊酸产量相近,分别为(2.8±0.1)×10-5g/mL和(2.6±0.2)×10-5g/mL。
Bifidobacteriumadolescentis产己酸最高,72 h时达到(6.2±0.2) mg/100 mL,BacteroidesuniformisU次之,产量为(5.5±0.3)×10-5g/mL,Lactobacillusjohnsonii最低,为(3.1±0.2)×10-5g/mL。
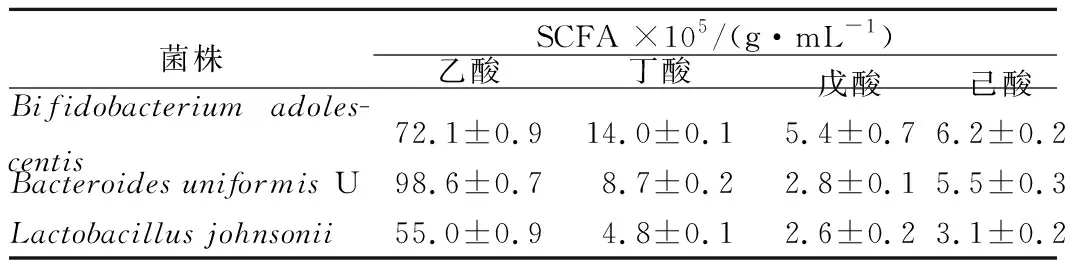
表1 不同微生物发酵过程中短链脂肪酸产生情况(n=3)Table 1 The production of SCFAs in vitro anaerobicfermentation by (n=3)
3 结论
本研究以KMOS为唯一碳源筛选获得的3株不同属源(双歧杆菌属、拟杆菌属、乳酸菌属)的,可降解KMOS的微生物(Bifidobacteriumadolescentis、BacteroidesuniformisU、Lactobacillusjohnsonii)为研究对象,通过体外静态培养的方式探讨了三者对KMOS的利用规律以及产酸情况。研究结果表明,Bifidobacteriumadolescentis能利用DP≤4组分,但只有DP 2组分能在24 h内被完全消耗,其他组分(DP 3~4)利用不完全且有迟滞性;BacteroidesuniformisU在初期就快速利用DP 2~3组分,且分别在6、36 h内消耗完全;Lactobacillusjohnsonii在三者中迟滞效应最显著,直至36、48 h时才开始分别利用DP 2~3组分,但是在72 h时两个组分均被其完全消耗,这说明微生物对KMOS的利用存在选择性和时效性,这与前期报导相一致[1-2]。可以认为,正是由于KMOS微生物代谢利用的特异性,导致了菌株间生长曲线和代谢产酸的差异,而不同的酸性产物在人体参与不同器官的代谢,发挥多种功效,如乙酸大部分能被血液吸收,主要参与肌肉、脾脏、心脏和脑的代谢,能为机体提供能量,同时也是胆固醇合成的主要底物;丙酸经肝代谢后为机体提供能量,并且能抑制胆固醇的合成,具有一定的辅助调节血脂的作用;丁酸在SCFA中所占比例较小但其尤为重要,它能够被结肠上皮细胞吸收利用,为结肠和盲肠提供能量,还能抑制肿瘤细胞的增殖分化、调节基因表达,对结肠炎和结肠癌起到预防作用[12-14],由此推测,通过改变低聚糖组成成分及相应含量有可能实现肠道菌群结构地定向调节,此外可以通过合理选择益生菌与益生元组合,可实现肠道代谢产物种类及含量可控化,从而实现合生元的精准化治疗,但由于本研究采用的静态培养仅能反应单一菌的代谢情况,与实际肠道菌群还有很大差距,因此还有待进一步研究与探索。
KMOS作为一种极具开发应用前景的益生元,在调节肠道菌群方面的作用具有很重要的研究意义。本研究揭示了3株菌对KMOS的降解利用规律及代谢产物产生情况,为KMOS益生元的开发提供了研究基础,同时也为其开发合生元组合提供相应的实验依据。

