放牧干扰对内蒙古草甸草原羊草光合特性的影响
张子荷,龚吉蕊,晏欣,黄永梅,安然,祁瑜,张梓瑜,刘敏
(北京师范大学地表过程与资源生态国家重点实验室, 北京师范大学地理科学学部, 北京 100875)
放牧是干扰草地生态系统的主要因素之一,同时,植物个体也会产生一系列避牧和耐牧机制来抵御不良环境的影响[5-6]。随放牧强度增加,植物的叶片生物量、分蘖数目、植株高度等形态学指标都有所降低[7]。植物个体也会通过改变光合作用、蒸腾、暗呼吸等生理学指标,使植物体内营养物质进行再分配,促进再生长,进一步提高其耐牧性[8-9]。放牧干扰直接影响了牧草的净光合速率(Pn,net photosynthetic rate)和水分关系,牲畜啃食叶片后,植物的光合器官受损,叶面积指数(LAI,leaf area index)减小,导致Pn下降[10]。牲畜的踩踏改变土壤的水分含量及理化性质,导致植物可利用水分含量下降,水分利用效率(WUE,water use efficiency)降低[8]。叶片啃食后刺激了植物的补偿效应,也会使Pn提高[11-12]。也有研究发现,放牧对植物Pn没有显著影响[13]。目前许多研究主要关注放牧干扰对植物光合表观特性的影响,而植物的光合表观特性取决于内部的光合机理,但对植物光合机理对放牧干扰的响应的研究还存在不足。
放牧干扰不仅改变植物的光合表观特性,还会进一步影响植物的内部生理特性。水分是限制植物生长发育的重要因子之一。当受到水分胁迫时,植物会改变体内的渗透调节物质(如可溶性糖、可溶性蛋白等)调节渗透势来维持膨压,调节气孔开闭,影响Pn[14]。当植物受到光照胁迫时,植物光合色素(如叶绿素a、b)合成受阻或者色素加速分解;植物体吸收过多光能时,以热耗散和叶绿素荧光等方式释放过多的光能避免光合器官损伤[15]。叶绿素荧光能够反映植物对光能的处理、适应调整能力,也能反映植物内部的光能利用与分配方式[16]。1,5-二磷酸核酮糖羧化酶(ribulose-1,5-bisphosphate carboxylase, RUBPCase, Rubisco)是C3植物中的3C化合物还原的关键酶,参与了多种光合生理过程,其活性可以用于评价植物的光合能力[17-18]。氮(N)和磷(P)是限制植物光合生产力的主要营养元素,N元素是叶绿素的组成部分之一,P元素是ATP和ADP生成以及Rubisco形成和输出所需要的元素,因此植物光合N、P利用效率(PNUE、PPUE,photosynthetic nitrogen and phosphorus utilization efficiency)可用于评估植物的光合能力[19-20]。因此,非常有必要把光合表观特性和内部生理机制结合起来探讨放牧对植物的光合特性的影响。
草地生态系统关键种是草地生态系统的重要组成部分,在草原生态系统的物质循环和能量流动中扮演着重要的角色。呼伦贝尔草甸草原的优势种主要有羊草(Leymuschinensis)、贝加尔针茅(Stipabaicalensis)、糙隐子草(Cleistogenessquarrosa)、线叶菊(Filifoliumsibiricum)等。羊草为多年生根茎型禾草,抗旱、抗寒、抗盐碱胁迫,适口性强,是优良的牧草种类。近年来,关于放牧干扰对羊草的影响研究主要包括物种多样性、形态特性、茎叶功能性状、气体交换特性、资源分配、叶片解剖结构、基因表达等方面[10, 21-26]。但目前对放牧干扰下草甸草原优势种羊草的生理生态特性的变化与响应机制并不完善。通过研究中度放牧干扰下,内蒙古草甸草原优势种羊草的水分关系、气体交换参数、叶绿素荧光特性、叶绿素含量、光合N、P利用效率、光合酶活性、渗透调节物质等相关参数,从羊草的表观和内在光合特性研究羊草对放牧干扰的响应机理,进一步为呼伦贝尔草甸草原退化草地的治理和生产力的恢复提供科学依据。
1 材料与方法
1.1 样地概况
研究区位于呼伦贝尔草原生态系统国家野外科学观测研究站内的贝加尔针茅草甸草原围封样地(1997年围封)和放牧样地,地处119°56′-119°57′ E、49°19′-49°20′ N,海拔627~649 m,属中温带半干旱大陆性气候,年平均降水350~400 mm,主要集中在植物生长季。年均气温-5~-2 ℃,大于10 ℃年积温1580~1800 ℃,无霜期110 d左右。年均降水量366 mm。土壤为黑钙土或栗钙土。选择放牧样地(中度)和围封样地(1997年围封)作为实验样地,放牧强度为4.2羊单位·hm-2。 两种处理的植物群落结构组成具体见表1。
样品采集和实验测定时间为2011年生长季8月。选择样地中3~5株长势较好、健康的羊草进行样品采集和实验测定。测定时标记位置,保证测量部位一致。样地的植物特性见表2。
1.2 试验设计和样品采集
1.2.1气体交换和叶绿素荧光参数的测定 气体交换和叶绿素荧光参数的测定时间选择2011年8月初羊草生长旺盛期,选择晴朗无风的天气,利用LI-6400光合测定系统(LI-COR, Lincoln,USA)进行测定。测定时间上午8点到下午6点,每次测量间隔2 h。选择3~5株生长良好的羊草进行测定,每株测定3~5个部位基本一致、生长状况相似的叶片,每次测定9个重复。每次测定叶片荧光参数前,待测叶片都进行了暗适应处理。经过测定,获得净光合速率(Pn)、蒸腾速率(Tr,transpiration rate)、气孔导度(Gs,stomatal conductance)、胞间CO2浓度(Ci,intercellular CO2concentration)等气体交换参数和最小荧光(Fo,minimal fluorescence)、最大荧光(Fm,maximum fluorescence)、光下稳定荧光(Fs,steady-state fluorescence)、光下最小荧光(Fo′,minimal fluorescence under light)和光下最大荧光(Fm′, maximum fluorescence under light)等荧光参数。通过计算得到PSⅡ最大光化学效率(Fv/Fm,maximum quantum efficiency of PSⅡ)、PSⅡ实际光化学效率(Fv′/Fm′,photochemical efficiency of PSⅡ in the light)、PSⅡ实际光化学量子产量(ΦPSⅡ,effective quantum yield of PSⅡ)、电子传递速率(ETR, electron transport rate)、光化学猝灭(qP,photochemical quenching)、非光化学猝灭(NPQ,non-photochemical quenching)、气孔限制值(Ls,limiting value of stomata)[27]。通过计算净光合速率与蒸腾速率的比值得到水分利用效率(WUE,water use efficiency)[8]。

表2 样地植物群落特征Table 2 The characteristics of plant community of fenced and grazing plots
注:同列不同字母表示差异显著(P<0.05)。
Note: Different small letters in the same column indicate significant differences at theP<0.05 level.
1.2.2叶片水势和含水量的测定 利用LI-COR WP4露点水势仪(Decagon Devices, Pullman, USA)测定叶片水势,选取健康的羊草叶片,在早上6点至下午6点每隔2 h进行测定,每次测定3个重复。在测定叶片水势的相同部位剪取一定量叶片,称取叶片鲜重后烘干至恒重(65 ℃),称取干重,根据公式计算叶片含水量[28]:
当前,电气自动化已经渗透到了生产生活的各个领域,为生产力的提高与人民生活的改善做出了巨大的贡献。本文从以下三个方面介绍电气自动化的发展现状:
叶片含水量=(叶片鲜重-叶片干重)/叶片鲜重×100%
(1)
1.2.3土壤含水量的测定 利用环刀法测定围封和放牧样地内的土壤含水量。采用环刀截取4个土层的土壤(0~10 cm、10~20 cm、20~30 cm、30~40 cm),称取土壤湿重后烘干至恒重(65 ℃),再称取土壤干重和环刀重量,每次测定3个重复,根据公式计算土壤含水量[29]:
土壤含水量=(土壤湿重-土壤干重)/土壤干重×100%
(2)
1.2.4生化指标的测定 将羊草测定气体交换参数同一部位叶片进行采集后,迅速保存在液氮中,用于生化指标的测定,每次测定3个重复。采用蒽酮比色法测定可溶性糖含量[29]。采用丙酮法测定叶片叶绿素含量[30-31]。采用考马斯亮蓝法测定可溶性蛋白含量[32]。按照Racker的方法(略有改进)制备RuBPCase提取液,在紫外分光光度计340 nm处测定Rubisco酶活性[33]。
1.2.5叶比重和光合氮、磷利用率的测定 将用于测定气体交换和荧光参数的叶片进行叶面积的测定(LI-3000, LI-COR, Lincoln, USA),然后在65 ℃烘干至恒重,称量干重,计算叶比重(SLW,specific leaf weight)(g·m-2)[34]:
叶比重 (SLW)=叶片干重/叶面积
(3)
采用凯氏定氮法测定叶片氮含量(Nmass,leaf nitrogen content)[34],每次测定3个重复,根据公式计算光合氮利用率(PNUE,photosynthetic nitrogen utilization efficiency)[34]:
PNUE=Pn/Nmass
(4)
在ICP-MS(ICPS-7510, Shimadzu Co., Kyoto, Japan)上测定单位质量叶磷含量(Pmass,leaf phosphorus content)[35],每次测定3个重复,根据公式计算光合磷利用率(PPUE,photosynthetic phosphorus utilization efficiency):
PPUE=Pn/Pmass
(5)
1.3 数据统计分析
采用Excel 2013和SPSS 13.0软件对数据进行统计分析。对围封和放牧样地之间的羊草气体交换参数、荧光参数、叶片水势、叶片含水量、叶绿素含量、叶比重、生化指标数据进行ANOVA单因素方差分析。对叶片PNUE、PPUE与叶比重之间进行相关性分析。统计显著水平为P=0.05。采用Origin 8.5 软件制图。
2 结果和分析
2.1 羊草水分关系变化
围封样地和放牧样地的土壤含水量存在显著差异,放牧样地各土层土壤含水量都低于围封样地(表3,P<0.05)。两种样地中羊草叶片水势、叶片含水量都呈先下降后上升趋势,放牧样地水势值在12:00和14:00低于围封样地(P<0.05);放牧样地叶片含水量高于围封处理(图1A、B)。两种样地中羊草的蒸腾速率呈“双峰型”曲线,在光照胁迫较强时,放牧样地羊草Tr低于围封样地(图1D,P<0.05),WUE高于围封样地,且两种样地的水分利用效率变化趋势基本一致(图1C)。
2.2 羊草气体交换参数变化

表3 围封和放牧样地的土壤含水量(平均值±标准误差,n=4)Table 3 The soil water content of the fenced and grazing plots (mean±SE, n=4)(%)
注:同行不同字母表示差异显著(P<0.05)。
Note: Different small letters in the same row indicate significant differences at theP<0.05 level.
围封和放牧样地中,羊草的Pn日变化动态规律呈“双峰型”,且放牧样地Pn高于围封样地(图2A,P<0.05)。Gs都呈先上升后下降趋势,放牧样地Gs在16:00时有跃升(图2B)。除8:00和12:00,放牧样地Ci值都显著高于围封样地,且变化趋势随Pn增加而下降(图2C,P<0.05)。围封样地羊草的Ci值变化规律符合Pn变化趋势(图2C)。围封样地气孔限制值(Ls,limiting value of stomata)与Pn变化趋势基本一致,放牧样地Ls在强光照胁迫时较高,在光照适宜时较低(图2D)。

图1 围封和放牧处理下羊草水分关系变化(平均值±标准误差)Fig.1 Changes of water relations of L. chinensis in fenced and grazing plots (mean±SE)

图2 围封和放牧处理下羊草气体交换参数变化(平均值±标准误差)Fig.2 Changes of gas exchange characteristics of L. chinensis in fenced and grazing plots (mean±SE)
2.3 羊草叶绿素荧光变化
围封和放牧样地中,羊草的Fv/Fm呈先下降后上升趋势,在光照辐射强度最大时达到最低值(图3A)。两种草地类型中羊草的qP总体变化趋势一致,都呈上升趋势(图3C)。放牧样地羊草NPQ呈“双峰型”,围封样地变化不大(图3D)。围封和放牧样地的ETR差异显著,围封样地中ETR先上升后降低;放牧样地中,ETR在10:00和16:00时较高,而在12:00时最低(图3E,P<0.05)。羊草ΦPSⅡ在两种草地类型中也呈现相似的变化规律,都与其qP值变化规律相一致(图3F)。
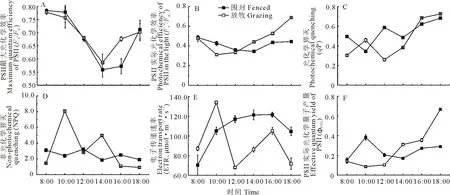
图3 围封和放牧处理下羊草的荧光特性变化(平均值±标准误差)Fig.3 Changes of fluorescence characteristics of L. chinensis in fenced and grazing plots (mean±SE)
2.4 羊草生理生化指标变化
羊草Chl a、Chl b、Chl a+b和Chl a/b的值在围封和放牧样地中呈相似的变化趋势,且放牧样地高于围封样地(图4A~D,P<0.05)。围封样地中可溶性糖含量逐渐上升,放牧样地中变化趋势平缓,无明显变化(图4E)。两种样地中羊草可溶性蛋白含量存在显著差异,但日变化趋势基本一致(图4F,P<0.05)。两种样地中羊草的PNUE、PPUE和Rubisco酶活性的变化趋势基本一致,在12:00达到最低;围封样地羊草SLW显著高于放牧样地,其中围封样地在16:00达到峰值,放牧样地在12:00达到峰值(图5A~D,P<0.05)。
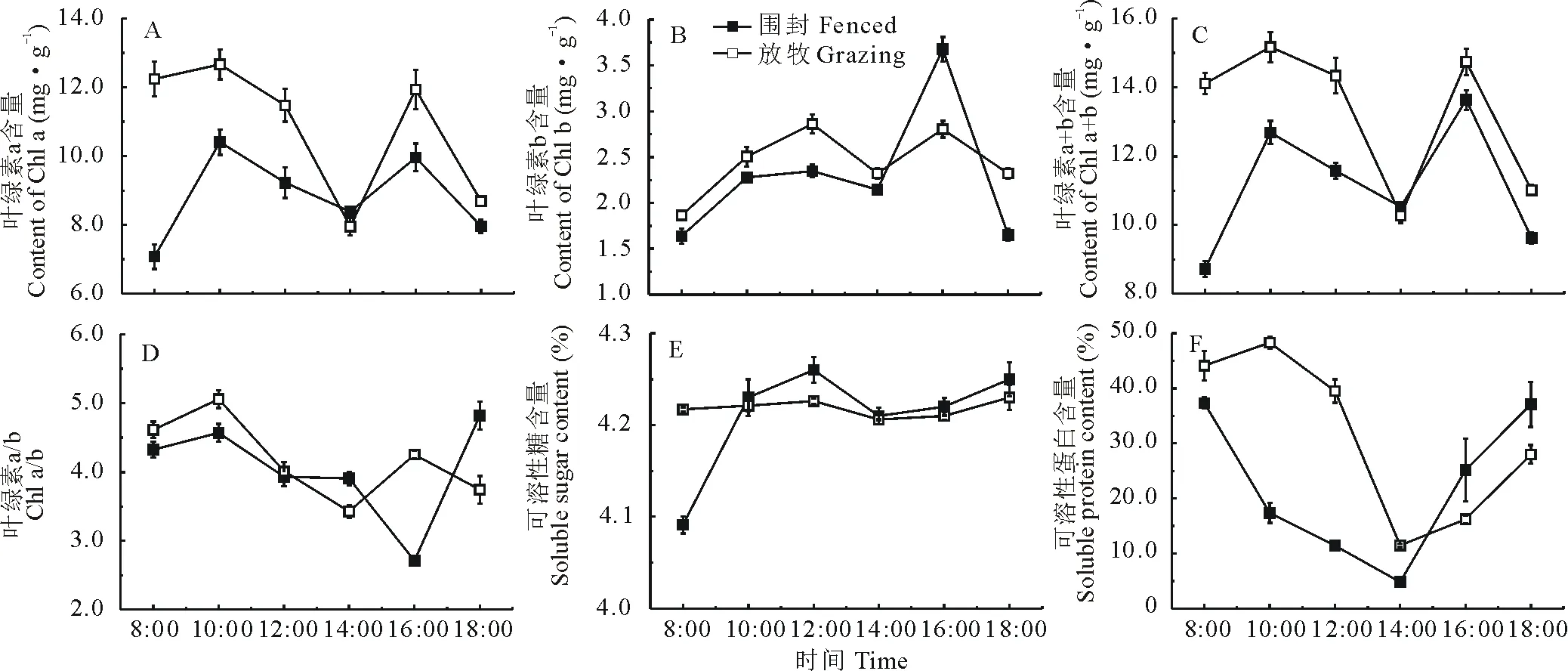
图4 围封和放牧处理下羊草叶绿素含量、可溶性糖及可溶性蛋白含量变化(平均值±标准误差)Fig.4 Changes of chlorophyll content, soluble sugar and soluble protein contents of L. chinensis in fenced and grazing plots (mean±SE)
2.5 羊草气体交换参数的相关性
围封处理下,羊草的Pn与Gs和Tr呈极显著正相关关系,与胞间CO2浓度呈极显著负相关关系(P<0.01),与WUE和土壤含水量关系不显著(表4)。WUE与Tr为极显著负相关关系,而与土壤含水量极显著相关(P<0.01)。放牧处理下,Pn与Gs、Tr和WUE都显著相关;WUE与Tr和土壤含水量存在一定的相关性,但不显著。

图5 围封和放牧处理下羊草光合氮、磷利用率、Rubisco酶活性和叶比重变化(平均值±标准误差)Fig.5 Changes of PNUE, PPUE, Rubisco activity and SLW in L. chinensis in fenced and grazing plots (mean±SE)

处理Plots参数Characteristics胞间CO2浓度Ci气孔导度Gs蒸腾速率Tr水分利用效率WUE土壤含水量SWC围封Fenced净光合速率 Pn-0.740**0.910**0.644**-0.140-0.192胞间CO2浓度 Ci-0.483*-0.640**0.506*0.694**气孔导度 Gs0.659**-0.1510.004蒸腾速率 Tr-0.738**0.620水分利用效率 WUE0.849**放牧Grazing净光合速率 Pn-0.2990.700**0.489*0.721**0.203胞间CO2浓度 Ci0.1820.190-0.2870.711**气孔导度 Gs0.883**0.1930.458蒸腾速率 Tr-0.1900.129水分利用效率 WUE0.569
注:*表示差异显著(P<0.05), **表示差异极显著(P<0.01)。下同。SWC:Soil water content.
Note: * indicates significant difference (P<0.05), ** indicates extremely significant difference (P<0.01). The same below.
2.6 羊草Pn与PNUE、PPUE、SLW的相关性
围封和放牧处理下,羊草Pn与PNUE、PPUE都呈极显著正相关关系(P<0.01,表5),但都与SLW之间存在一定的负相关关系,但未达到显著水平。两种处理羊草的PNUE与PPUE之间为极显著相关关系(P<0.01);PPUE与SLW之间存在一定相关关系,但并不显著。放牧处理下,羊草PNUE与SLW呈显著负相关(P<0.05)。

表5 围封和放牧样地羊草Pn和PNUE、PPUE、SLW的相关性Table 5 Correlations between Pn and PNUE, PPUE, SLW of L. chinensis in fenced and grazing plots
3 讨论
3.1 放牧干扰对羊草水分关系的影响
水分是限制植物生长的重要因素之一,植物的水势是表征植物水分关系的一个重要参数,可以反映植物水分的供求关系和受水分胁迫的程度[36]。两种样地羊草的水势日变化趋势一致,但在10:00至12:00阶段,温度升高,大气湿度下降,放牧样地羊草的水势急速下降,Tr最低值出现在12:00,说明当干旱胁迫的初期时段,放牧地羊草已经开始减少蒸腾来减少水分耗散,羊草能够快速对水分胁迫进行调整和适应[37-38]。放牧样地羊草的水势和蒸腾速率均低于围封草地,说明在水分亏缺比较严重时,羊草通过降低水势、减少蒸腾等方式适应干旱环境[39]。植物的WUE指植物消耗单位水分所生产的同化物质的量,取决于Pn与Tr的比值,实质上反映了植物耗水与其干物质生产之间的关系,是评价植物生长适宜程度的综合生理生态指标[40]。放牧样地羊草的WUE高于围封样地,Pn高于围封样地,Tr低于围封样地,相关分析也表明,放牧处理下羊草的Pn和WUE呈极显著正相关关系,说明羊草通过增加Pn和降低Tr来提高WUE以适应中度放牧胁迫[9, 41]。放牧样地土壤含水量显著低于围封样地,由于牲畜的践踏作用,土壤孔隙减少,土壤容重增加,渗透阻力加大,因此土壤的保水能力下降[42]。放牧样地羊草的Pn与土壤含水量存在一定的相关性,说明在水分不足条件下,羊草Pn主要受到内部光合机理(如Rubisco酶,PNUE等)的调节。有研究发现,随着放牧强度增加,多年生禾草WUE降低,说明经过多年的放牧干扰,多年生禾草通过提高植物的耐受性应对放牧干扰,减少水分利用,维持生存[8, 43]。由此可见,中度放牧干扰下羊草对水分胁迫更为敏感,通过降低Tr,减少水分消耗,提高WUE以适应放牧胁迫。
3.2 放牧干扰对羊草气体交换参数及叶绿素荧光的影响
植物的光合作用是植物生长和繁殖的重要过程,同时也会受到干旱、高温等因素的影响[15]。本研究中放牧处理下羊草Pn高于围封处理,可能是放牧的啃食和踩踏作用促进羊草根茎节上枝条生长,进而出现补偿生长[44]。有研究表明,中度放牧干扰下大针茅(Stipagrandis)通过提高光合速率促进同化物积累和补偿生长适应放牧干扰[34]。在过度放牧下,植物减少叶面积,降低Pn,光合作用补偿点增大,饱和点降低,Tr和Gs降低,光合能力显著下降[45]。说明适度放牧后,羊草的分蘖、萌芽数量等增加,导致羊草超补偿生长,进一步导致Pn增加[23]。日变化曲线大致分为两种类型,一种是其最大净光合速率出现在上午(或下午),称为单峰型;另一种其光合速率分别在上午和下午时段出现峰值,称为双峰型,两峰值之间光合速率较低,即为“光合午休”[46]。两种样地羊草的净光合速率日变化呈“双峰型”,这与前人研究一致[47]。由于中午光照强、温度高,羊草通过气孔部分关闭或光化学效率降低来避免水分过度损失和光合机构破坏,这是植物在长期演化过程中形成的应对环境胁迫的一种方法[48]。
导致光合“午休”现象的因素主要分为气孔因素和非气孔因素[49]。通常根据Ls和Ci的相对变化的趋势来分析导致光合速率下降的原因[50]。在导致光合午休的非气孔限制因素中,Rubisco酶活性下降是导致Pn下降的原因之一[51]。两种样地羊草均在正午12:00出现光合午休现象,此时,Gs、Ls和Rubisco酶活性都有所下降,可见,气孔因素和非气孔因素共同作用下导致羊草Pn下降。羊草通过关闭气孔、减少Tr、降低水分散失适应高温和光照胁迫,同时改变能量分配、Rubisco酶活性等影响光合作用能力[52-53]。ETR也是非气孔因素之一,并与Rubisco酶活性之间存在良好的正相关关系[54]。ETR主要流向有RuBP的氧化作用和C同化,放牧草地羊草在12:00时降低ETR,表明羊草可能改变电子传递方向和增加环式电子流抵御强光和高温胁迫[55]。但围封草地中羊草PSⅡ活性与光照强度变化趋势较为一致,表明其ETR随光照变化而较为稳定。由此可见,放牧干扰下,羊草光系统的光化学活性发生改变,对光合速率的调节方式更为多样化,增强了对强光等不利环境因素的防御能力。
光合机构吸收的光能有3个可能的去向:一是用于反应中心叶绿素分子的光化学反应;二是以热的形式耗散损失;三是叶绿素荧光的形式,三者之间存在此消彼长的关系[48]。叶绿素荧光参数Fv/Fm表示光合反应中心的开放程度,能够快速、敏感地反映植物受到强光胁迫的程度[56]。随着温度升高、光照增强,放牧样地和围封样地中羊草Fv/Fm值逐渐下降,且低于0.75,表明羊草产生了光抑制现象[57]。随后,两种样地羊草Fv/Fm值逐渐恢复,表明温度和光照的胁迫并没有导致光合机构不可逆的破坏,羊草可能会通过增加NPQ来缓解光抑制[58]。放牧样地羊草光化学猝灭(qP)逐渐升高,NPQ在光照胁迫较为严重的时刻较高而ETR较低,说明光照胁迫较强时羊草类囊体膜无法利用更多的光量子,通过增加NPQ将多余的光量子以热耗散的形式散发出去保护光合机构不受强光胁迫的损伤[59]。Fv′/Fm′值反映了PSⅡ反应中心吸收光量子的效率[27]。放牧样地Fv′/Fm′随时间升高且高于围封样地,表明放牧处理刺激羊草PSⅡ反应中心吸收更多的光量子提高Pn。放牧干扰下羊草对光照条件形成了一定的生理适应,在光照适宜时增加光化学反应,在光照胁迫较为严重时增加非光化学反应来降低胁迫,增强了对环境的适应能力,羊草对光能的分配利用较围封处理更为迅速灵敏[60]。
3.3 放牧干扰对羊草光合生理的影响
叶绿素含量被认为是影响光合速率的重要因素之一,并且易受多种因素影响[61]。Chl a更是直接与光合速率有关,Chl b是聚光色素蛋白的重要组分,所以其含量与植物叶片对光照强度的适应性相关[62]。放牧样地羊草Chl a、Chl b含量都高于围封样地,且两种样地的变化趋势基本一致。两种样地在14:00时Chl a、Chl b和Chl a+b含量都达到最低,表明植物此时受到强光、水分、温度等环境因素的胁迫,导致叶绿素有一定程度的降解[63]。随后16:00时,Chl a、Chl b逐渐恢复。其中,两种草地中羊草在经历水分胁迫较为严重的14:00后,Chl b都有一个明显跃升,之前对木龙葵(Solanumsuffruticosum)的研究表明,水分亏缺能够诱导植物叶片叶绿素的合成,尤其是Chl b[64]。渗透调节是植物受到水分胁迫时,为了保持植物细胞活性和水分吸收而维持植物细胞膨压的一种主要手段[65]。大量研究表明植物体内的可溶性糖和可溶性蛋白在水分胁迫下,会大量累积以增加渗透势,从而降低水势通过分析其含量变化方式,可以了解植物抗旱性强弱[14]。两种样地羊草可溶性蛋白含量变化趋势一致且与水势变化相似,大体呈先下降后上升趋势。已有研究表明,植物受到胁迫时,可溶性蛋白含量增加[66]。但本研究中光照胁迫最强时,可溶性蛋白含量达到最低值,随后又升高,推测是羊草的可溶性蛋白含量对光照胁迫的响应存在滞后。围封样地羊草可溶性糖含量随水势降低而升高,放牧样地可溶性糖含量没有显著变化,表明围封样地羊草通过增加可溶性糖含量抵御正午高温、干旱等不利条件的影响[67-68]。
N、P元素是限制植物生长的主要营养元素[69]。PNUE和PPUE可以反映植物叶片养分含量与生理特性的关系[35]。两种样地羊草PNUE和PPUE变化趋势基本一致,且放牧样地低于围封样地。有研究发现,植物被啃食后,提高PNUE获取更多的N元素恢复光合能力[70]。但本研究中放牧处理后羊草PNUE低于围封处理,原因可能是羊草在长期的放牧干扰下,会优先将能量分配到防御物质而不是恢复光合速率,但放牧后羊草Pn高于围封,表明羊草能够保持一定的碳同化能力同时吸收较多的N,这是羊草适应长期放牧的一种生存策略[16,71]。N元素在植物体内的循环与分配需要消耗大量能量,使得单位面积叶片同化物的累积减少,从而导致SLW下降;另一方面,N元素在植物体内的分配和循环方式非常灵活,其中最为典型的就是N元素在光合蛋白和结构蛋白中的动态分配,为使植物细胞获得更多的机械保护,大量的N元素会流向植物细胞壁上,使SLW升高,分配到Rubisco、捕光色素蛋白的N元素减少,使得植物PNUE下降[72]。放牧样地羊草PNUE与SLW呈显著负相关关系,且PNUE与Pn呈显著正相关,这与之前的研究结论一致[73]。放牧样地中羊草在一天当中SLW波动幅度明显,说明在维持植物体内C、N两种元素的动态分配过程中较灵敏,表明放牧干扰提升了羊草平衡体内C、N元素的能力。
P是陆地生态系统中限制植被第一生产力的重要营养元素[74]。植物个体对P元素的吸收、转运、同化成为探究植物生态适应性的重要方面[75]。在土壤中P元素亏缺时,植物叶片P元素也相应降低,作为对土壤中P元素亏缺的一种适应机制[76]。当流向结构途径的P元素较高时,SLW也随之升高,SLW升高使得CO2在叶片中的扩散更为受阻,从而使Pn下降,PPUE也随之下降,使得植物PPUE与SLW呈负相关关系[19,77]。放牧样地中羊草的Pn高于围封样地,但放牧样地PPUE低于围封样地,说明在放牧样地中,羊草积累了大量P元素。相关性分析表明,羊草体内P元素与Pn之间存在极显著正相关关系,这与之前的研究相一致[78]。这同样解释了放牧地羊草在Rubisco酶、ETR都比围封草地较弱的情形下,Pn较高的现象,且羊草Pn也与PPUE呈极显著正相关,表明中度放牧干扰增强了羊草对P元素的吸收和转运能力。
4 结论
羊草作为我国草甸草原优势种植物,对长期放牧干扰有着较强的适应能力。中度放牧干扰下,羊草光合速率有所提升,可以根据胁迫程度的变化改变光能利用方式和光合色素含量,增加热耗散以维持较高的光合能力,促进积累有机物。羊草也会改变渗透调节物质适应放牧和光照强度带来的干旱胁迫。同时,中度放牧干扰下,羊草的电子传递速率提高,PSⅡ活性增强,利于光合产物积累,促进对N、P元素的吸收。因此,中度放牧处理有利于牧草的补偿生长,能够保持一定的牧草生物量,利于维持较高的草地生产力,从而为草地生产力的恢复和放牧强度的选择提供一定的理论依据。
致谢:感谢中国农业科学院呼伦贝尔草原生态系统国家野外科学观测研究站在野外工作中提供的帮助。

