干旱胁迫对蜡质含量不同小麦近等基因系光合特性的影响
杨彦会,马晓,,张子山,郭军,李月楠,梁英,宋健民,赵世杰
干旱胁迫对蜡质含量不同小麦近等基因系光合特性的影响
杨彦会1,马晓1,2,张子山1,郭军2,李月楠1,梁英1,宋健民2,赵世杰1
(1山东农业大学生命科学学院/作物生物学国家重点实验室,山东泰安 271018;2山东省农业科学院作物研究所,济南 250100)
【目的】探讨叶片蜡质含量对干旱胁迫下小麦光合特性的影响。【方法】本研究以一对小麦近等基因系多蜡质品系JM205和少蜡质品系JM204为试验材料,将二者种植在同一盆中,在人工气候室采用逐渐干旱的方式模拟田间干旱过程中的土壤水分变化。随着干旱处理时间的延长,土壤相对含水量逐渐降低,同步测定了不同土壤相对含水量下小麦旗叶的水势、光合气体交换参数及荧光参数。【结果】轻度干旱胁迫(土壤相对含水量在60%—49%)下,多蜡质品系JM205与少蜡质品系JM204旗叶的光合速率(n)无显著差异,随着干旱程度的加重,多蜡和少蜡质品系的光合速率都逐渐降低,但少蜡质品系JM204下降幅度更大。在中度干旱胁迫(土壤相对含水量在49%—32%)下,多蜡质品系比少蜡质品系具有较高的水势和较大的气孔开度,因此CO2供应充足,光合速率更高;少蜡质品系的PSII实际光化学效率(ΦPSⅡ)和最大光化学效率(Fv/Fm)较多蜡质品系下降更快,说明少蜡质品系PSII电子传递受阻情况和光抑制比多蜡质品系更严重;快速叶绿素荧光动力学曲线参数分析(JIP-test)发现PSII电子传递受阻主要是因为受体侧QA到QB电子传递限制。在重度干旱胁迫(土壤相对含水量下降到32%以下)时,多蜡质与少蜡质品系的水势和光合能力都大幅下降且二者间没有明显差异。【结论】本研究表明,多蜡质品系JM205在中度干旱胁迫(土壤相对含水量49%—32%范围)下具有较高的光合优势;本研究为小麦抗旱性选育与利用提供了理论依据,并对进一步的研究提供了建议。
小麦;近等基因系;干旱胁迫;蜡质;光合特性
0 引言
【研究意义】小麦是世界上种植最广泛的作物之一,占谷物面积的30%,全球35%—40%的人口以小麦为主食[1-2]。在我国,冬小麦生长季节正值降水稀少的时期,干旱灾害频发,干旱胁迫对小麦的产量影响巨大[3]。研究小麦应对干旱胁迫的机制,对小麦的高产稳产具有重要意义。【前人研究进展】光合作用是作物产量的重要决定因素之一,也是绿色植物对环境最敏感的代谢途径之一。植物光合作用受到干旱胁迫的影响,主要表现在净光合速率(n)、蒸腾速率()、细胞间CO2浓度(i)、气孔导度(s)、水分利用效率(WUE)等方面[4]。不同的植物在受到干旱胁迫时光合速率都会有不同程度的降低,随着干旱胁迫程度的加重或者干旱时间的延长,植物光合速率下降的幅度越来越大。史玉炜等[5]认为植物生长及代谢的变化也会对其光合速率产生影响,在相同的干旱胁迫条件下,不同的植物或者同一植物的不同品种对干旱胁迫的响应也是不同的。研究表明,严重干旱可以导致植物叶绿体光合机构的破坏,PSII放氧复合体(OEC)的损伤[6],产生光抑制,直接影响光合作用的电子传递和CO2的同化过程[7]。叶片表皮的角质层具有减少水分散失的生理作用,它能够延迟干旱期间的细胞脱水,被认为是抵御干旱的重要组织[8-10]。植物角质层是表皮最外层的部分,由角质和蜡质组成。表皮蜡质可以分成最外层的蜡质晶体层和镶嵌于角质层中的内层蜡质。不同植物或同种植物不同器官的表皮蜡质常存在不同类型的晶体结构,如面包屑状、片状、柱状、管状等。这些不同的蜡质晶体形态是由不同的蜡质化学组分形成的。片状蜡层主要含有较多的伯醇或大量的三萜类成分,管状蜡质主要含有多种β-二酮、仲醇和二醇[11]。在植物生长过程中,蜡质晶体的形态结构会随成分的变化而转变,而表皮蜡质的成分和含量又与生长发育和环境条件密切相关[12-13]。已有研究表明蜡质对于植物抗旱具有重要作用[14-15],Yang等[16]发现,在拟南芥中叶片蜡质含量与抗旱能力呈正相关。Vogg等[17]研究发现,番茄表面蜡质具有蒸腾屏障的作用。过去关于蜡质的研究大多集中在模式植物上,针对蜡质对小麦抗旱性影响的研究较少,而且研究主要采用蜡质含量存在明显差异的不同品种[18-19],无法避免遗传背景对研究结果的影响。前期试验中我们获得了蜡质含量不同的小麦近等基因系,近等基因系是指除了某一两个基因外其他基因都相同的两个遗传材料,通常是经过饱和回交形成的除了目标性状有差异,其他遗传背景完全相同的两个遗传材料(品系)[20],这为我们研究蜡质对小麦干旱抗性的影响提供了材料基础。【本研究切入点】前期研究表明,多蜡质小麦品系对干旱胁迫的抗性明显高于少蜡质品系[21]。但前期研究仅采用单一干旱胁迫条件,不能探究多蜡质小麦品系抵御干旱胁迫的能力范围,且其抗旱机理尚不清楚。【拟解决的关键问题】本研究以蜡质含量不同的2个小麦近等基因系多蜡质品系JM205和少蜡质品系JM204为材料,在人工气候室通过逐渐干旱的方法模拟田间干旱胁迫的过程,研究不同干旱胁迫程度对蜡质含量不同小麦叶片水势及光合性能的影响,为生产中抗旱小麦品种的选择,以及抗旱小麦品种育种提供了理论基础。
1 材料与方法
试验于2016年10月至2017年3月在山东农业大学作物生物学国家重点实验室人工气候室进行。
1.1 材料种植
试验材料为藁城9411(母本)和ATHLET(父本)杂交选育出的F6代姊妹株系中蜡质含量不同的一对小麦近等基因系:多蜡品系JM205和少蜡品系JM204(图1-A),通过扫描电镜观察发现JM205叶片表面有较多的蜡质(图1-B),而JM204表面蜡质较少(图1-C)。前期试验结果表明,多蜡质小麦品系旗叶蜡质含量(平均7.05 mg·g-1)显著高于少蜡质品系(平均为3.38mg·g-1)[21]。2016年10月取饱满的种子育苗后,移栽到直径为32 cm的盆中,土壤为田间土壤与蛭石的混合物,3﹕2的体积比例混合。每盆种植多蜡质品系JM205和少蜡质品系JM204各2株,共12盆,在室外自然环境下,经过低温春化后于2016年12月转移到人工气候室进行培养。人工气候室日间(12 h)温度26℃,光照强度约800 μmol·m-2·s-1,夜间(12 h)温度17℃。水肥充足培养至开花期。

图1 两个小麦品系的照片(A)以及扫描电镜图片(B,C)
1.2 干旱处理及土壤相对含水量的测定
开花4 d后选取小麦植株长势良好的6盆,其中3盆正常浇水,作为对照,每天傍晚称重并浇水,使其重量维持不变;其余3盆在傍晚充分浇水至水从盆底流出,第二天上午8:30称盆重,此时重量为土壤饱和重量。从此不再浇水,使其逐渐干旱直至试验结束,在此过程中每天上午8:30称盆重,此时重量为土壤重量,试验结束后将植株和土壤烘干并称重,即为土壤干重。土壤相对湿度=(土壤重量-土壤干重)/(土壤饱和重量-土壤干重)[22]。根据土壤相对湿度(R)的干旱等级[23]指标,可以分为60%<R为无旱,50%<R≤60%为轻度干旱,40%<R≤50%为中度干旱,30%<R≤40%为重度干旱,R≤30%为严重干旱。
1.3 旗叶水势的测定
叶片水势的测定采用露点水势仪(PSYPRO,美国WESCOR公司)测定,操作方法参照露点水势仪使用说明书,于每天上午9:00测定旗叶水势。用直径0.6 cm的打孔器打取叶圆片,将叶圆片放入C-52样品室密封,平衡30 min以上,干旱处理的植株叶片平衡1—2 h,然后将样品室连接到露点水势仪主机上测定叶片水势。
1.4 旗叶气体交换参数的测定
利用CIRAS-3光合作用测定系统(PP Systems,美国),在每天上午9:30至下午14:00分别测定旗叶的光合气体交换参数。用内置LED光源照光,光强为1 200 μmol·m-2·s-1,CO2浓度为400 μmol·mol-1,采用大气湿度和温度,仪器自动记录叶片净光合速率(n)、气孔导度(s)、胞间CO2浓度(i)、蒸腾速率(E)等参数。处理和对照植株各测定10次重复。
1.5 旗叶叶绿素荧光参数的测定
利用FMS-2脉冲调制式荧光仪(Hansatech,英国)测定Fo、Fm、Fm′、Fs等荧光参数。叶片在生长光(约800 μmol·m-2·s-1)下进行光适应后,再用荧光仪内置光源(1 200 μmol·m-2·s-1)对叶片照射300 s,测定光适应条件下的稳态荧光Fs,再打饱和脉冲光(6 000 μmol·m-2·s-1),测定光适应下最大荧光Fm´,然后对叶片进行暗适应30 min,测定叶片的暗适应下的最小荧光Fo和暗适应下的最大荧光Fm。按照如下公式计算荧光参数:
PSⅡ的实际光化学效率ΦPSⅡ=(Fm′-Fs)/Fm′
PSⅡ的最大光化学效率Fv/Fm=(Fm-Fo)/Fm
用Handy-PEA植物效率仪(Hansatech,英国)测定小麦旗叶的快速叶绿素荧光动力学曲线(OJIP曲线),测定前将叶片暗适应30 min。OJIP曲线由3 000 μmol·m-2·s-1的红光诱导,测定时间为2 s,记录的初始速率为每秒钟105个数据。按照Zhang[24]和Strasser[25]方法,将OJIP曲线进行O-P点和O-J点标准化。O点是10 μs,K点是30 μs,J点是2 ms,P点是荧光最大值对应的时刻。标准化公式如下:
O-P点标准化VO-P=(Ft-Fo)/(Fm-Fo)
O-J点标准化VO-J=(Ft-Fo)/(FJ-Fo)
1.6 统计分析
利用Sigmaplot 12.0软件对相关数据进行绘图,并利用PhotoShop CS 6.0软件对相关图片进行处理。
2 结果
2.1 不同程度干旱胁迫下土壤含水量和小麦叶片水势的变化
在充分灌溉情况下,土壤相对含水量保持稳定,一直维持在72%左右。干旱处理后,随着处理时间的延长,土壤相对含水量逐渐降低,第3天降到49%,为中度干旱程度,第6天降到26%左右,达到严重干旱程度(图2-A)。
植物叶片水势是植物水分状况最直接的表现。在正常浇水的条件下,多蜡质品系JM205和少蜡质品系JM204旗叶水势差异不显著(图2-B)。随着干旱胁迫时间的延长,多蜡质品系和少蜡质品系的旗叶水势逐渐下降,但是少蜡品系下降更明显。特别是在处理第3天到第5天,土壤相对含水量在49%—32%时,多蜡品系JM205和少蜡质品系JM204旗叶水势差异显著,如第5天,当土壤相对含水量降至32%时,多蜡品系JM205旗叶水势为-1.42 MPa,而少蜡品系旗JM204叶水势降至-1.845 MPa。当土壤相对含水量进一步下降到26%时,2个品系旗叶水势均大幅度下降,叶片失水严重,出现萎焉,叶片功能受损。

图2 干旱过程中土壤相对含水量的变化(A),不同干旱程度对小麦叶片水势(B)的影响
2.2 不同干旱胁迫程度对光合气体交换参数的影响
从图3可见,当土壤相对含水量高于49%时,多蜡质品系JM205与少蜡质品系JM204旗叶的光合速率(n)无显著差异,随着干旱程度的加重,多蜡质和少蜡质品系的光合速率都逐渐降低,但少蜡质品系JM204下降幅度更大,如土壤相对含水量下降到32%时,少蜡品系n下降了37%,而多蜡品系仅下降了15%,少蜡质品系下降的幅度显著大于多蜡质品系。蒸腾速率()和胞间CO2浓度(i)变化趋势与光合速率类似;气孔导度(s)的变化趋势略有差异,当土壤含水量高于50%时,少蜡质品系JM204的气孔导度高于多蜡质品系,随着干旱程度加重,少蜡质品系和多蜡质品系都逐渐降低,但少蜡质品系下降的更快并逐渐低于多蜡质品系JM205。当土壤含水量为32%时,各气体交换参数差异最显著。随着干旱程度继续加重,各参数急剧下降,当土壤相对含水量下降至28%左右时,所有气体参数都降低得很小,不同品系之间无显著性差异。在整个试验期间,始终保持充足浇水的对照组植株,无论是多蜡质品系JM205还是少蜡质品系JM204,其光合气体交换参数都基本保持稳定。
2.3 不同程度干旱胁迫对Fv/Fm和ФPSII的影响
在干旱条件下,随着干旱程度的增加,多蜡质品系JM205与少蜡质品系JM204的Fv/Fm的变化趋势基本相同(图4)。在土壤相对含水量下降初期,无明显变化,随着土壤相对含水量继续下降,最大光化学效率快速降低,少蜡质品系下降出现早、下降速度更快,在土壤含水量约为49%时,少蜡质品系开始出现下降趋势,而多蜡质品系在土壤相对含水量约32%时才开始下降。这表明,在相同干旱胁迫条件下多蜡质品系叶片的PSII光抑制较轻。

图3 充足浇水(CK)与不同程度干旱胁迫(D)对蜡质含量不同小麦近等基因系(JM204,JM205)气体交换参数的影响

图4 充足浇水(CK)与不同程度干旱胁迫(D)对蜡质含量不同小麦近等基因系(JM204,JM205)旗叶Fv/Fm和ΦPSII 的影响
随着土壤相对含水量的减少,多蜡质品系JM205和少蜡质品系JM204的PSII实际光化学效率(ΦPSII)都逐渐降低,但是少蜡质品系JM204降低的幅度更大,当土壤相对含水量低于49%的时候,少蜡质品系JM204与多蜡质品系JM205相比差异显著,随着土壤相对含水量继续下降,二者大幅度下降,表明不同程度干旱条件下多蜡质品系叶片的PSII电子传递更通畅。
在整个试验期间,始终保持充足浇水的对照组植株,无论是多蜡质品系JM205还是少蜡质品系JM204,其Fv/Fm和ΦPSII都基本保持稳定。
2.4 不同程度干旱胁迫对快速叶绿素荧光诱导动力学曲线的影响
为了进一步研究叶片蜡质是如何缓解PSII光抑制发生的,试验测定了不同干旱程度下旗叶的快速叶绿素荧光诱导动力学曲线(图5—6)。
快速叶绿素荧光诱导动力学曲线中蕴含着PSII原初光化学反应的丰富信息,被广泛应用于PSII活性研究[26-28]。2 ms的J点被认为反映了PSII受体侧QA向QB的电子传递,J点增加反映了QA向QB的电子传递受阻。在进行O-P点标准化的VO-P曲线中,多蜡质品系JM205与少蜡质品系JM204的OJIP曲线在轻度干旱时均无明显差异(图5),但随着干旱程度的加重,少蜡质品系J点荧光比多蜡质品系上升更快,当土壤相对含水量降至39%时,少蜡质品系JM204的J点开始逐渐上升,但多蜡质品系JM205无明显变化;当土壤相对含水量低于32%时,2个品系旗叶的J点荧光均大幅增加,且二者无显著差异(图5)。

B、D由图A、C中不同干旱程度时的曲线减去干旱处理前曲线得出。下同
OJIP 曲线300 μs处被称为K点,K点的上升被作为PSII受体测光抑制的特异性标志[29]。为了更好的观察K点,对OJIP曲线进行了O-J点的标准化(图6)。在不同程度干旱胁迫条件下,土壤相对含水量从72%下降到32%过程中,多蜡质品系JM205和少蜡质品系JM204的K点荧光几乎无变化(图6),表明此时PSII受体测没有发生明显伤害,当土壤相对含水量低于32%时,继续干旱,K点荧光均上升,但多蜡质品系K点荧光始终低于少蜡质品系。
2.5 不同程度干旱胁迫对植株干重的影响
本研究发现,在充足浇水情况下,蜡质含量不同的小麦品系的生物量无明显差异(图7)。在6 d干旱胁迫处理后,多蜡质小麦品系JM205的干重与充足浇水的对照组相比没有明显变化,而少蜡质小麦品系JM204的干重则明显低于充足浇水的对照组(图7)。这表明少蜡品系在干旱下较低光合机构的活性限制了其干物质的积累。
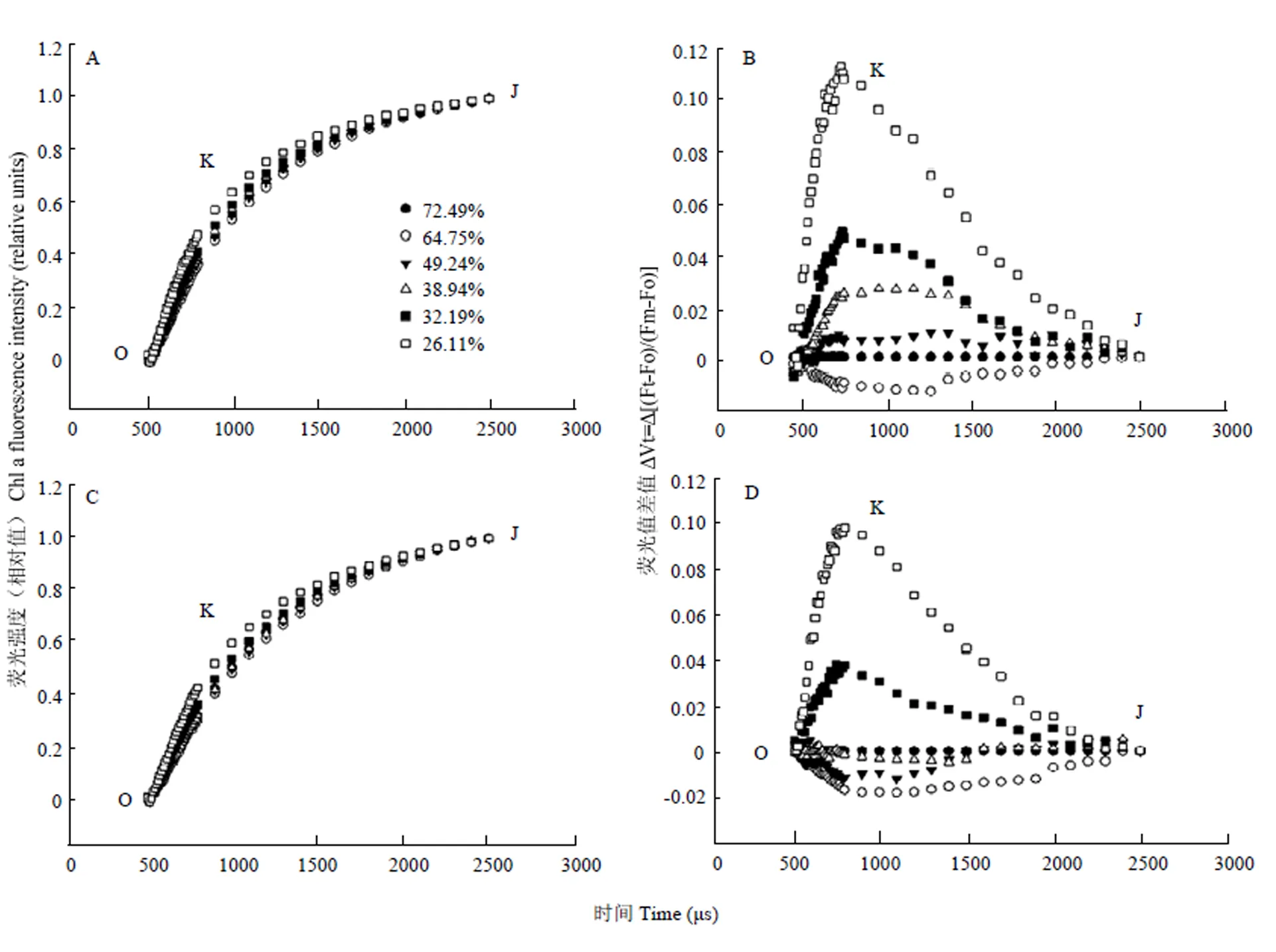
图6 不同程度干旱胁迫对多蜡质小麦JM205(A,B)与少蜡质小麦JM204(C,D)旗叶的快速叶绿素荧光诱导动力学曲线O-J段标准化曲线的影响
3 讨论
表皮蜡质层在植物抗旱过程中起着重要的作用,大量研究发现,表皮蜡质可以作为植物表皮细胞内水分或溶解物向外扩散的屏障,其含量和厚度会影响植物的水分蒸腾[30-32]。但是,这些研究所用的材料来自不同的国家和地区,遗传背景差异较大。而本试验所用的研究材料为两个蜡质含量不同的小麦近等基因系,其遗传背景相同。前期试验发现多蜡质小麦品系旗叶保水能力强,蜡质能够减轻干旱胁迫造成的光抑制,使旗叶维持较高的光合速率[21]。本研究进行不同程度的干旱胁迫,探讨多蜡质小麦的抗旱范围和抗旱机理。为了减少天气变化对试验的影响,试验在人工气候室控制温度、湿度和光照条件下进行,采用逐渐干旱的方式,从开始干旱至完全干旱期间测定了6个不同时间点的干旱梯度,在一定程度上模拟田间干旱的过程。前人对于蜡质抗旱性的研究往往只设置1个或者2个干旱梯度,很难得出蜡质对抗旱的有效范围,而本研究包含了从开始干旱至严重干旱的所有过程,较详细的描述了蜡质在不同干旱程度下对小麦光合性能的影响,明确了多蜡质品系和少蜡质品系各自的抗旱能力范围,对于抗旱小麦品种的选育和田间栽培均有借鉴意义,并对进一步的研究提供了建议。

*表示P<0.05水平差异显著
叶片水势是表示植物水分亏缺或水分状况的一个直接指标[33],通过研究不同土壤供水条件下的植物水势的变化特征,可以了解植物的抗旱特性以及植物对环境变化的生理适应特点。笔者之前的研究发现,在干旱条件下,小麦叶片蜡质含量与旗叶水势、光合速率、蒸腾速率呈显著正相关[21],表明蜡质具有一定的抗旱功能,本研究发现当土壤相对含水量为49%—32%时抗旱效果最明显。根据Farquhar等[34]提出的光合速率气孔限制的判断标准,光合速率与气孔导度同时下降时,如果i也下降,则说明光合速率的下降是气孔限制。笔者的研究表明,随着干旱程度加重,n和s下降,同时i也下降,这表明光合速率下降的原因是气孔限制而不是叶肉因素的限制。多蜡质品系旗叶光合作用在干旱胁迫处理后下降的幅度小,气孔限制轻。这可能是由于蜡质含量多的品系,旗叶细胞膜的结构相对稳定,干旱胁迫后,失水较慢,叶片水势相对较高,气孔导度下降慢,因此保持了较高的光合速率、蒸腾速率及水分利用效率。本研究结果与黄玲等[3]的研究结果部分一致,但与郭彦军等[35]研究结果不同,这可能与不同试验的胁迫程度和其他环境因素不同有关,也可能与品种间气孔调节的遗传差异有关,这也说明蜡质和抗旱节水性状的关系非常复杂,还有待深入研究。
植物本身的生理变化如衰老以及逆境的干旱[36]、高温[37]、低温[38]和盐胁迫[39]等都能够直接或间接地影响植物PSⅡ的功能。前人的研究表明,干旱胁迫主要伤害PSII反应中心,通过调节电子传递速率和光化学速率,降低光合同化力。本研究结果表明,随着干旱程度加重,多蜡质及少蜡质品系Fv/Fm和ФPSⅡ均下降,说明天线色素吸收的光能被反应中心捕获的概率降低,叶片吸收的光能不能有效转化为化学能,但多蜡质品系JM205下降幅度小,少蜡质品系JM204下降幅度大,说明干旱胁迫下,多蜡质品系对光能的捕获和转化能力受干旱胁迫影响较小,可维持相对较高的光合能力。PSII是光抑制的主要场所,JIP-test可以解析PSII光能吸收、转换、电子传递、PSII作用中心以及受体侧和供体侧的活性、电子传递体氧化还原状态动态变化,是目前常用的非破坏性技术手段。本研究结果表明,随着干旱程度的加重,OJIP曲线J点和K点的荧光均上升,但J点荧光上升更明显,而且多蜡质品系比少蜡质品系上升速度慢,说明干旱胁迫后受体侧受伤害程度重于供体侧,QA到QB的电子传递受阻,使电子传递活性降低。PSII的破坏常伴随着Mn2+的丧失,脂肪酸的增加及ATP和蛋白质的降解[40],因此PSII受到损害,必然影响到光合作用的正常进行。但多蜡质品系可以在干旱胁迫条件下维持相对较高的光能转换效率和实际光化学效率,电子传递更通畅,更多的能量被反应中心捕获并进入电子传递链,过剩光能少,减少了活性氧的产生,具有相对较高的光合能力。因此,有利于光合产物的积累,从而维持较高的产量[21]。
关于蜡质与植物抗旱性关系方面,近年来已有较多研究,大多数研究者认为蜡质与植物的抗旱节水性密切相关[41-43],但也有一些研究者认为,蜡质含量与植株蒸腾速率及抗旱性没有必然的联系[44]。本研究发现,在干旱条件下,多蜡质品系较少蜡质品系旗叶水势更高,PSII电子传递更通畅,光合能力更强,蜡质含量对提高小麦的抗旱性有积极影响。通过模拟田间充分灌水后土壤逐渐干旱的过程,笔者发现在轻度干旱胁迫条件下,蜡质的抗旱效果并不明显,但在中度和重度干旱胁迫条件下,即土壤相对含水量约为49%—32%时,蜡质的抗旱节水性更加显著。所以前人关于蜡质在抗旱方面的争议也有可能是由于干旱程度的差异引起的。
4 结论
轻度干旱胁迫条件下,多蜡质品系JM205抗旱优势不明显,但是随着干旱程度逐渐加重,多蜡质品系旗叶的水势和光合速率都高于少蜡质品系,n和s下降的同时,i下降,可见光合速率的下降主要是由气孔因素导致的。中度干旱胁迫条件下,多蜡质品系比少蜡质品系具有更高的ΦPSII和Fv/Fm,表明多蜡质品系电子传递更通畅,叶片光抑制较轻,抗旱功能较强。JIP-test分析发现OEC受伤害程度小于QA到QB电子传递受阻程度,表明PSⅡ电子传递主要是受体侧受到抑制。经不同程度干旱胁迫处理分析,当土壤相对含水量在49%—32%时,多蜡和少蜡品系各项指标差异最大,抗旱效果最明显,这对于抗旱小麦品种的选育和田间栽培均有借鉴意义。
[1] CHOULET F, ALBERTI A, THEIL S, GLOVER N, BARBE V, DARON J, PINGAULT L, SOURDILLE P, COULOUX A, PAUX E, LEROY P, MANGENOT S, GUILHOT N, LE GOUIS J, BALFOURIER F, ALAUX M, JAMILLOUX V, POULAIN J, DURAND C, BELLEC A, GASPIN C, SAFAR J, DOLEZEL J, ROGERS J, VANDEPOELE K, AURY J M, MAYER K, BERGES H, QUESNEVILLE H, WINCKER P, FEUILLET C. Structural and functional partitioning of bread wheat chromosome 3B., 2014, 345(6194): 1249721.
[2] EVERSOLE K, FEUILLET C, MAYER K F X, ROGERS J. Slicing the wheat genome., 2014, 345(6194): 285-287.
[3] 黄玲, 张正斌, 崔玉亭, 刘孟雨, 柴守玺, 陈兆波. 小麦叶片蜡质含量与水分利用效率和产量的关系. 麦类作物学报, 2003, 23(3): 41-44.
HUANG L, ZHANG Z B, CUI Y T, LIU M Y, CHAI S X, CHEN Z B. Relationship between wax content and water use efficiency of leaf and yield in wheat.2003, 23(3): 41-44. (in Chinese)
[4] Chen Q, Tao S, Bi X, Xu X, Wang L, Li X. Research progress in physiological and molecular biology mechanism of drought resistance in rice., 2015, 3(2): 102-107
[5] 史玉炜, 王燕凌, 李文兵, 高述民, 李霞. 水分胁迫对刚毛柽柳可溶性蛋白、可溶性糖和脯氦酸含量变化的影响. 新疆农业大学学报, 2007, 30(2): 5-8.
SHI Y W, WANG Y L, LI W B, GAO S M, LI X.Effects of water stress on soluble protein, soluble sugar and proline content in., 2007, 30(2): 5-8. (in Chinese)
[6] LIU X, LI L, LI M, SU L, LIAN S, ZHANG B, LI X, GE K, LI L. AhGLK1 affects chlorophyll biosynthesis and photosynthesis in peanut leaves during recovery from drought.,2018, 8(1): 2250.
[7] 张永强, 毛学森, 孙宏勇, 李文杰, 于沪宁. 干旱胁迫对冬小麦叶绿素荧光的影响. 中国生态农业学报, 2002, 10(4): 13-15.
ZHANG Y Q, MAO X S, SUN H Y, LI W J, YU H N. Effects of drought stress on chlorophyll fluorescence of winter wheat., 2002, 10(4): 13-15. (in Chinese)
[8] WOLFE D W, HENDERSON D W, HSIAO T C, Alvino A. Interactive water and nitrogen effects on senescence of maize. I. leaf area duration, nitrogen distribution, and yield., 1988, 80(6): 859-864.
[9] 陈文峻, 蒯本科. 植物的滞绿突变. 植物生理学通讯, 1999, 35(4): 321-324.
CHEN W J, KUAI B K. Stay-green mutations in plants., 1999, 35(4): 321-324. (in Chinese)
[10] PORRA R J. The chequered history of the development and use of simultaneous equations for the accurate determination of chlorophyll a and b., 2002, 73(1/3): 149-156.
[11] KOCH K,EESIKAT H J. The hydrophobic coatings of plant surfaces: epicuticular wax crystals and their morphologies, crystallinity and molecular self-assembly., 2008, 39(7): 759-772.
[12] JETTER R, SCHAFFER S. Chemical composition of theleaf surface. Dynamic changes of the epicuticular wax film during leaf development., 2001, 126(4): 1725-1737.
[13] CAMERON K D, TEECE M A, SMART L B. Increased accumulation of cuticular wax and expression of lipid transfer protein in response to periodic drying events in leaves of tree tobacco., 2006, 140(1): 176-183.
[14] 张志飞, 饶力群, 向佐湘, 胡晓敏, 王晓杰. 高羊茅叶片表皮蜡质含量与其抗旱性的关系. 西北植物学报, 2007, 27(7): 1417-1421.
ZHANG Z F, RAO L Q, XIANG Z X, HU X M, WANG X J. Epidermis wax content and drought resistance among different tall fescue (Schreb.) varieties., 2007, 27(7): 1417-1421. (in Chinese)
[15] 张正斌, 山仑. 小麦抗旱生理指标与叶片卷曲度和蜡质关系研究. 作物学报, 1998, 24(5): 608-612.
ZHANG Z B, SHAN L. Studies on relationship between drought resistance physiological traits and leaf curl degree and wax of wheat., 1998, 24(5): 608-612. (in Chinese)
[16] YANG M G, YANG Q Y, FU T D, ZHOU Y M. Overexpression of thegene in Arabidopsis affects plant development and increases drought tolerance., 2011, 30(3): 373-388.
[17] VOGG G, FISCHER S, LEIDW J, EMMANUEL E, JETTER R, LEVY A A, RIEDERER M. Tomato fruit cuticular waxes and their effects on transpiration barrier properties: Functional characterization of a mutant deficient in a very-long-chain fatty acid beta-ketoacyl- COA synthase.,2004, 55: 1401-1410.
[18] 王美芳, 陈巨莲, 原国辉, 雷振生, 吴政卿, 赵献林. 植物表面蜡质对植食性昆虫的影响研究进展. 生态环境学报, 2009, 18(3): 1155-1160.
WANG M F, CHEN J L, YUAN G H, LEI Z S, WU Z Q, ZHAO X L. Effects of plant epicuticular cuticular waxes on phytophagous insects behavior., 2009, 18(3): 1155-1160. (in Chinese)
[19] 刘勇, 陈巨莲, 程登发. 不同小麦品种(系)叶片表面蜡质对两种麦蚜取食的影响. 应用生态学报, 2007, 18(8): 1785-1788.
LIU Y, CHEN J L, CHENG D F. Effects of wheat leaf surface waxes on the feeding of two wheat aphid species., 2007, 18(8): 1785-1788. (in Chinese)
[20] 李希峰, 董娜. 小麦近等基因系的构建及应用进展. 安徽农业科学, 2012, 40(5): 2577-2579.
LI X F, DONG N. Progress in construction and application of near-isogenic line in wheat., 2012, 40(5): 2577-2579. (in Chinese)
[21] 徐文, 申浩, 郭军, 余晓丛, 李祥, 杨彦会, 马晓, 赵世杰, 宋健民. 旗叶蜡质含量不同小麦近等基因系的抗旱性. 作物学报, 2016, 42(11): 1700-1707.
XU W, SHEN H, GUO J, YU X C, LI X, YANG Y H, MA X, ZHAO S J, SONG J M. Drought resistance of wheat NILs with different cuticular wax contents in flag leaf., 2016, 42(11): 1700-1707. (in Chinese)
[22] 常永义, 吴红, 牛军强. 干旱胁迫对葡萄叶片生理指标的影响. 中外葡萄与葡萄酒, 2005(2): 11-14.
CHANG Y Y, WU H, NIU J Q. Effect of water stress on physiological index of grapevine leaves.. 2005(2): 11-14. (in Chinese)
[23] 中华人民共和国国家质量监督检验检疫总局. 气象干旱等级: GB/T20481-2006. 北京: 中国标准出版社, 2006: 12-17.
General administration of quality supervision, inspection and quarantine of the people's republic of China.:. Beijing: Standards Press of China, 2006: 12-17. (in Chinese)
[24] ZHANG L T, GAO H Y, ZHANG Z S, XUE Z C, MENG Q W. Multiple effects of inhibition of mitochondrial alternative oxidase pathway on photosynthetic apparatus in Rumex K-1 leaves., 2012, 56(2): 365-368.
[25] STRAAER B J. Measuring fast fluorescence transients to address environmental questions: the JIP-test., 1995, 5: 977-980.
[26] YUSUF M A, KUMAR D, RAJWANSHI R, STRASSER R J, TSIMILLI-MICHAEL M, GOVINDJEE, SARIN N B. Overexpression of γ-tocopherol methyl transferase gene in transgenicplants alleviates abiotic stress: physiological and chlorophyll a fluorescence measurements., 2010, 1797(8): 1428-1438.
[27] MATHUR S, ALLAKHVERDIEV S I, JAJOO A. Analysis of high temperature stress on the dynamics of antenna size and reducing side heterogeneity of photosystem II in wheat leaves ()., 2010, 1807: 22-29.
[28] 孙山, 王少敏, 王家喜, 高辉远. 黑暗中脱水对'金太阳'杏离体叶片PSⅠ和PSⅡ功能的影响. 园艺学报, 2008, 35(1): 1-6.
SUN S, WANG S M, WANG J X, GAO H Y. Effects of dehydration in the dark in functions of PSI and PSII in apricot (L. “JinTaiyang”) leaves., 2008, 35(1): 1-6. (in Chinese)
[29] LI P M, CHENG L L, GAO H Y, JIANG C D, PENG T. Hetero generous behavior of PSII in soybean () leaves with identical PSII photochemistry efficiency under different high temperature treatments., 2009, 166(15): 1607-1615.
[30] PREMACHANDRA G S, SANEOKA H, FUJITA K, OJATA S. Leaf water relations, osmotic adjustment, cell membrane stability, epicuticular wax load and growth as affected by increasing water deficits in Sorghum., 1992, 43(12): 1569-1576.
[31] BUROW G B, FRANKS C D, XIN Z. Genetic and physiological analysis of an irradiated bloomless mutant (epicuticular wax mutant) of sorghum., 2008, 48(1): 41-48.
[32] PARK J J, JIN P, YOON J, YANG J I, JEONG H J, RANATHUNGE K, SCHREIBER L, FRANKE R, LEE I J, AN G. Mutation in Wilted Dwarf and Lethal 1 (WDL1) causes abnormal cuticle formation and rapid water loss in rice., 2010, 74(1/2): 91-103.
[33] 单长卷, 梁宗锁. 土壤干旱对刺槐幼苗水分生理特征的影响. 山东农业大学学报(自然科学版), 2006, 37(4): 598-602.
SHAN C J,LIANG Z S. Study on water physiological characteristics of black locust seedling under soil drought condition.(), 2006, 37(4): 598-602. (in Chinese)
[34] FARQUHAR G D, SHARKEY T D. Stomatal conductance and photosynthesis., 1982, 33: 317-345.
[35] 郭彦军, 倪郁, 郭芸江, 韩龙, 唐华. 空气湿度与土壤水分胁迫对紫花苜蓿叶表皮蜡质特性的影响. 生态学报, 2011, 31(18): 5273-5280.
GUO Y J, NI Y, GUO Y J, HAN L, TANG H. Effects of air humidity and soil water deficit on characteristics of leaf cuticular waxes in alfalfa ()., 2011, 31(18): 527-5280. (in Chinese)
[36] LU C M, ZHANG J H. Effects of water stress on photosynthesis, chlorophyll fluorescence and photoinhibition in wheat plants., 1998(8), 25: 883-892.
[37] 杨卫丽, 黄福灯, 曹珍珍, 雷炳婷, 胡东维, 程方民. 高温胁迫对水稻光合PSⅡ系统伤害及其与叶绿体D1蛋白间关系. 作物学报, 2013, 39(6): 1060-1068.
YANG W L, HUANG F D, CAO Z Z, LEI B T, HU D W, CHENG F M. Effects of high temperature stress on PSII function and its relation to D1 protein in chloroplast thylakoid in rice flag leaves., 2013, 39(6): 1060-1068. (in Chinese)
[38] FRYER M J, ANDREWS J R, OXBOROUGH K, BLOWERS D A, BAKER N RRelationship between CO2assimilation, photosynthetic electron transport, and active O2metabolism in leaves of maize in the field during periods of low temperature., 1998, 116: 571-580.
[39] LU C M, JIANG G M, WANG B S, KUANG T YPhotosystemⅡ photochemistry and photosynthetic pigment composition in salt- adapted halophytegrown under outdoor conditions.,2003, 160(4): 403-408.
[40] 山仑, 陈培元. 旱地农业生理生态基础. 北京: 北京科学技术出版社, 1998: 70-71.
SHAN L, CHEN P Y.. Beijing: Beijing Scientific and Technical Publishers, 1998: 70-71. (in Chinese)
[41] NIZAM U M, MARSHALL D R. Variation in epicuticular wax content in wheat.,1988, 38(1): 3-9 .
[42] PRIOR S A, PRITCHARD S G, RUNION G B, ROGERS H H, MITCHELL R J. Influence of atmospheric CO2enrichment, soil N, and water stress on needle surface wax formation in(Pinaceae)., 1997, 84(8): 1070-1077.
[43] 戴双, 郭军, 徐文, 赵世杰, 宋建民. 蜡质组成形态及其合成调控对小麦抗旱性的影响. 植物生理学报, 2016, 52(7): 979-988.
DAI S, GUO J, XU W, ZHAO S J, SONG J M. Biosynthesis and regulation of cuticular wax and its effects on drought resistance of wheat., 2016, 52(7): 979-988. (in Chinese)
[44] Kim M S, Shim K B, Park S H, Kim K S. Changes in cuticular waxes of developing leaves in sesame (L.)., 2009, 12(3): 161-167..
(责任编辑 杨鑫浩)
Effects of Drought Stress on Photosynthetic Characteristics of Wheat Near-isogenic Lines with Different Wax Contents
YANG YanHui1, MA Xiao1,2, ZHANG ZiShan1, GUO Jun2, LI YueNan1, LIANG Ying1, SONG JianMin2, ZHAO ShiJie1
(1College of Life Sciences, Shandong Agricultural University/State Key Laboratory of Crop Biology, Tai’an 271018, Shandong;2Crop Research Institute, Shandong Academy of Agricultural Sciences, Jinan 250100)
【Objective】The objective of this paper was to investigate the effects of different drought levels on the photosynthetic characteristics of wheat with different wax contents. 【Method】A pair of wheat near-isogenic lines (NILs), including high-wax line JM205 and low-wax line JM204, were used as experimental materials to simulate the process of soil moisture change in the field by means of gradual drought stress in the artificial climate chamber. The two wheat near-isogenic lines with different waxy contents were planted in the same pot to ensure the same drought degree. With the prolongation of drought treatment, the relative soil water content decreased gradually. Water potential, photosynthetic gas exchange parameters and fluorescence parameters of wheat flag leaf under different soil water contents were measured. 【Result】Under low water stress (60%-49% of relative soil water content), there was no significant difference in photosynthetic rate (n) between flag leaf of JM205 and JM204, however, the photosynthetic rate of both wax and waxy lines decreased gradually, but the less waxy line JM204 showed a greater decline. Under moderate drought stress (Relative soil water content between 49% and 32%), the high-wax plant had higher water potential and larger stomatal opening than that of the low-wax one, so the CO2supply was sufficient and the photosynthetic rate was higher. Under moderate drought stress, the PSII actual photochemical efficiency (ΦPSⅡ) and maximum photochemical efficiency (Fv/Fm) decreased more rapidly in the low-wax line, which indicated that PSII electron transfer inhibition and light inhibition were more serious. The JIP-test analysis found that blocked PSII electron transport was mainly due to QAto QBreceptor-side electron transfer restrictions. In contrast, the high-wax line maintained relatively higher photosynthetic capacity under drought conditions, with a smoother electron transfer and less excess light energy, resulting in less light suppression. When relative soil water content dropped below 32%, the water potential and photosynthetic capacity of both NILs decreased significantly and there was no significant difference between them. 【Conclusion】This study preliminarily improved understanding of the physiological mechanism of leaf wax improving drought tolerance of plants, and the high-wax line JM205 has significant drought resistance in the soil moisture range of 49%-32%, providing theoretical basis for selection and cultivation of drought-resistant wheat varieties.
common wheat (L); nearly isogenetic lines; drought stress; wax; photosynthetic characteristics
2018-06-04;
2018-09-20
国家自然科学基金(31871544)、国家农业产业技术体系专项(CARS-03-1-8)、山东省自主创新重大关键技术计划(2014GJJS0201-1)
杨彦会,E-mail:yyh20160113@163.com。
赵世杰,E-mail:sjzhao@sdau.edu.cn。通信作者宋健民,E-mail:song_jianmin@163.com
10.3864/j.issn.0578-1752.2018.22.003
