襄阳大头菜酱液中酵母菌多样性分析
赵慧君,董蕴,刘伟,胡事成,郭壮*
(1.湖北文理学院食品科学技术学院鄂西北传统发酵食品研究所,湖北 襄阳 441053;2.襄阳市食品药品检验所,湖北 襄阳 441021;3.湖北襄阳孔明菜食品有限公司,湖北 襄阳 441104)
湖北襄阳大头菜是湖北襄阳的农家品种[1],更是我国四大名腌菜之一。襄阳大头菜历史悠久,为诸葛亮隐居襄阳隆中时所创,在民间享有“诸葛菜”、“孔明菜”之美称[2]。但是襄阳大头菜的生产总体处于粗放式加工状态,由于雨水和尘土等因素的影响,腌制池或缸表面会形成一层白色的生物膜。随着生物膜的出现,大头菜的脆度明显降低且产生刺激性气味,最终导致产品品质下降直至失去经济价值。
目前关于食品中微生物的研究多集中在传统纯培养手段。胡怀容等[3,4]从袋装腐败的大头菜中分离微生物进行纯培养,分离出7株细菌和2株酵母菌,并对其生理特性进行了研究。饶瑜等[5]对泡菜生物膜中真菌进行分离,研究表明Pichiakluyveri和Geotrichumcandidum是导致生物膜形成的主要原因。值得一提的是,徐婷等[6]使用YPD培养基,采用纯培养的方法从长有生物膜的襄阳大头菜卤水中分离了1株嗜盐酵母菌,并将其鉴定为Zygosaccharomycesrouxii。葡萄酒发酵过程中也会出现生物膜,Volleková等[7]采用纯培养的方法从红酒的表面生物膜中分离到4株酵母菌;Sergio等[8]从巴西葡萄酒中分离得到了6个种的酵母菌,结果发现其均可以在不同的碳源下形成生物膜。
本研究对长膜襄阳大头菜酱液中的微生物多样性进行了研究,不仅能够了解可能导致襄阳大头菜长膜的微生物组成和种类,亦可为后续因形成生物膜而导致大头菜产品品质下降这一产业化问题的解决提供参考。
1 材料与方法
1.1 样品来源
本试验所用材料采集于襄阳孔明菜食品有限公司。分别在3个正常发酵大头菜池和3个长膜的大头菜池里采集酱液和生物膜,采集后低温保存,带回实验室进行后续试验。
1.2 培养基及主要试剂
PDA固体培养基:北京博奥星生物技术有限公司;蛋白胨、酵母提取物:英国OXOID公司;葡萄糖:天津福星化学试剂厂;琼脂粉:上海国药集团;DNA Marker:Fermentas公司;PCR清洁试剂盒(AXYGEN):购于北京科博汇智生物科技发展有限公司;2×PCR Mix:购于南京诺唯赞生物科技有限公司;rTaq、dNTP、pMD18-T vector:购于大连宝生物技术有限公司(TaKaRa);PCR引物的合成和测序:由武汉天一辉远生物科技有限公司完成。
1.3 样品中酵母菌的分离与纯化
在无菌条件下分别将正常发酵大头菜酱液和长膜大头菜酱液用生理盐水进行稀释,稀释梯度分别为10-2,10-3,10-4,10-5,10-6,每个梯度各取0.5 mL均匀涂布于PDA培养基上,在28 ℃条件下培养1天左右。取长出的单菌落划线,纯化2次,进行形态观察和镜检,将纯化后的菌株保存在-80 ℃冰箱中待用。
1.4 酵母菌基因组DNA的提取及检测
采用消解酶-氯化苄法提取酵母菌DNA[9],并用0.8%琼脂糖凝胶电泳对提取的DNA进行检测。
1.5 酵母菌28S rDNA基因的PCR扩增
以所提取的大头菜酵母菌总DNA为模板进行分离菌株D1/D2可变区基因的PCR扩增,引物为NL1和NL4(序列见表1)[10]。PCR扩增体系为2.5 μL10×PCR Buffer(含Mg2+),2 μL dNTP(2.5 mol/L),0.5 μL NL1(10 mmol/L),0.5 μL NL4 (10 mmol/L),0.5 μL rTaq(5 U/μL),1 μL DNA模板,18 μL无菌水。PCR反应条件:95 ℃ 4 min预变性,95 ℃ 1 min,58 ℃ 30 s,72 ℃ 1 min,30个循环,72 ℃延伸10 min。PCR扩增结束,取扩增产物5 μL用1%的琼脂糖凝胶电泳检测。

表1 引物名称及序列Table 1 Primers' names and sequences
1.6 PCR产物的纯化、克隆及测序
将扩增成功的PCR产物进行纯化,纯化后的PCR产物与pMD18-T vector连接并转化,挑取转化后的单菌落进行PCR鉴定,所用的引物为M13F(-47)和M13R(-48)。PCR扩增体系为10 μL 2×PCR Mix,0.5 μL M13F(-47)(10 mmol/L),0.5 μL M13R(-48)(10 mmol/L),1 μL菌液为模板,8 μL无菌水。PCR反应条件:95 ℃预变性4 min,93 ℃ 1 min,55 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃延伸10 min。PCR结束后用1%的琼脂糖进行凝胶检测。阳性克隆送往武汉天一辉远生物科技有限公司进行测序。
1.7 测序产物的比对及进化树构建
将测序结果除去两端载体序列,然后利用NCBI Blast从GenBank数据库中提取相似度比较高的相似序列,用MEGA 4.0软件制作系统发育树,采用Neighbor-joining(邻位相连法)制作系统进化树[11],利用Bootstrap(自展法)检测制作的系统树[12],自展数据集为1000次。
2 结果与分析
2.1 酵母菌菌落形态观察
从正常发酵大头菜酱液(标号为N)中和长膜大头菜酱液(标号为M)中共20株酵母菌株培养于YPD液体培养基,在28 ℃培养1天,肉眼观察菌落形态为:部分试管内溶液澄清,表面无膜生成,底部没有沉淀;部分试管液体表面有膜形成,底部有沉淀存在,溶液有一定程度的浑浊。将20株酵母菌划线在PDA琼脂培养基上,28 ℃培养1天,菌落形态为:菌落颜色呈乳白色;菌落从侧面观察有凸起也有扁平,表面粗糙有褶皱,也有表面光滑;菌落边缘有长出毛边,也有呈现锯齿状,或者整齐无边。分离菌株菌落形态观察结果汇总入表2,菌落形态见图1。
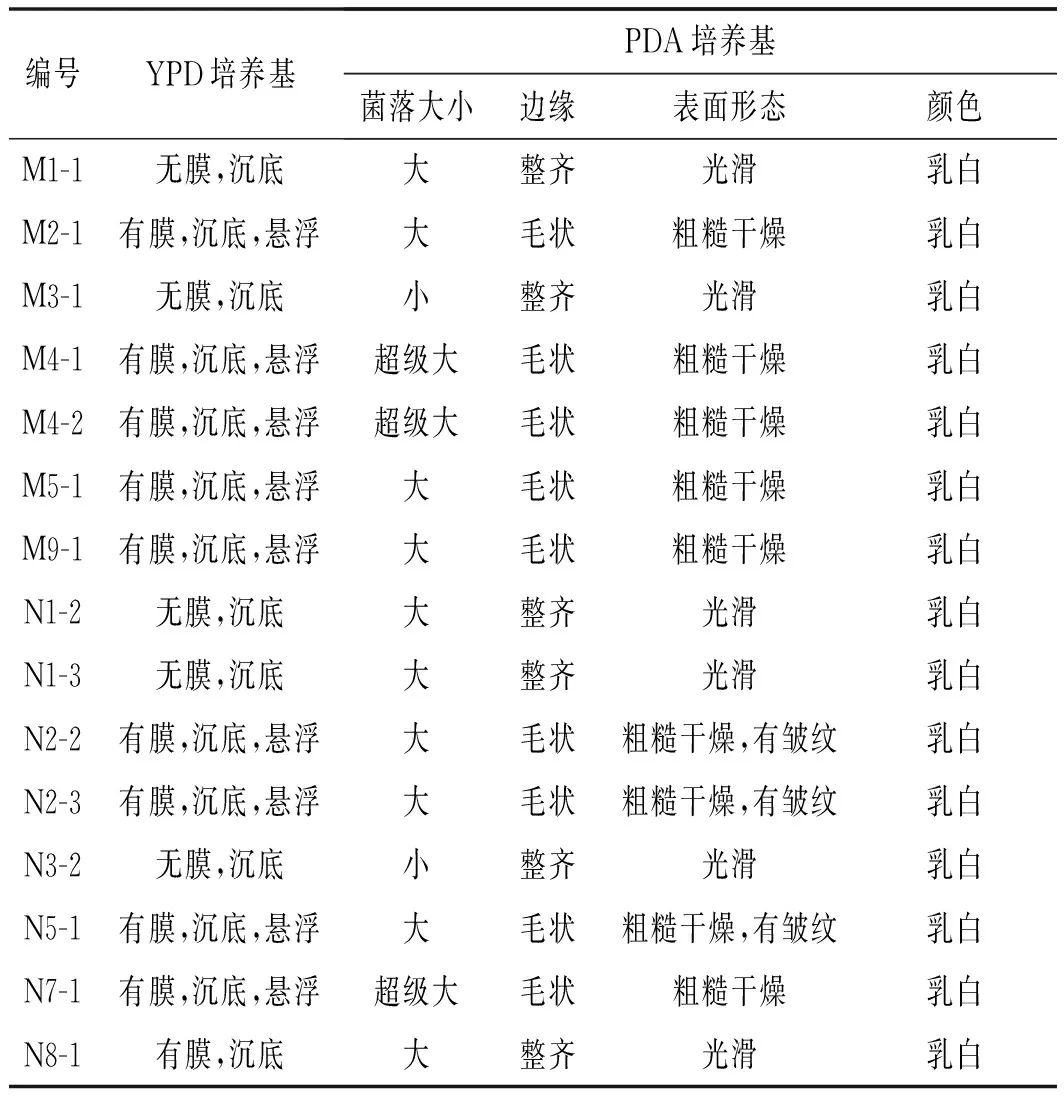
表2 菌落形态观察Table 2 Observation of colonial morphology

续 表
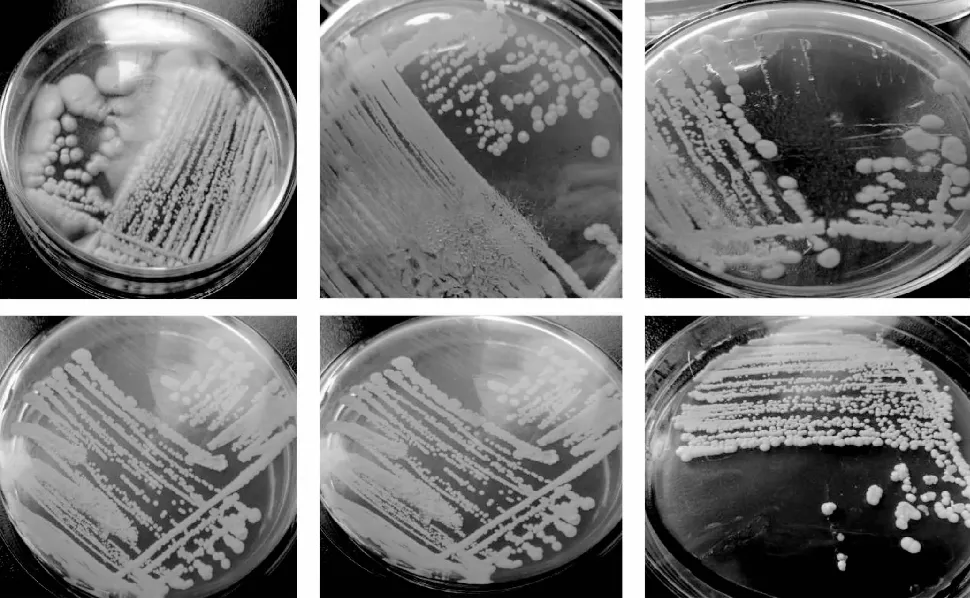
图1 酵母分离菌株在PDA上的培养Fig.1 Culture of yeasts isolated strains on PDA
2.2 显微镜下大头菜分离菌株的观察结果
分离到的20株酵母菌用结晶紫染色后进行镜检,在显微镜下可以看到分离菌株的细胞形态:存在杆状,球状,椭圆形,见图2。

图2 大头菜分离菌株在显微镜下的细胞形态(10×100)Fig.2 Cell morphology of strains isolated from mustard root under microscope (10×100)
2.3 酵母菌的DNA提取及28S rDNA扩增
提取的酵母菌DNA进行琼脂糖凝胶电泳检测后为单一条带,无拖尾。说明提取的DNA完整无降解,可用于下一步酵母菌28S rDNA的PCR扩增。扩增结束后,使用1.0%琼脂糖凝胶电泳检测,发现在650 bp左右位置有一条明亮清晰的条带,与目的条带相符。将PCR产物进行纯化与T-A克隆,并将阳性克隆送往武汉天一辉远生物科技有限公司进行测序。
2.4 NCBI比对结果及系统发育树构建
大头菜20株酵母分离菌株经28S r DNA D1/D2区测序后,将结果在NCBI用Blast进行比对,具体对比结果及序列相似性见表3。
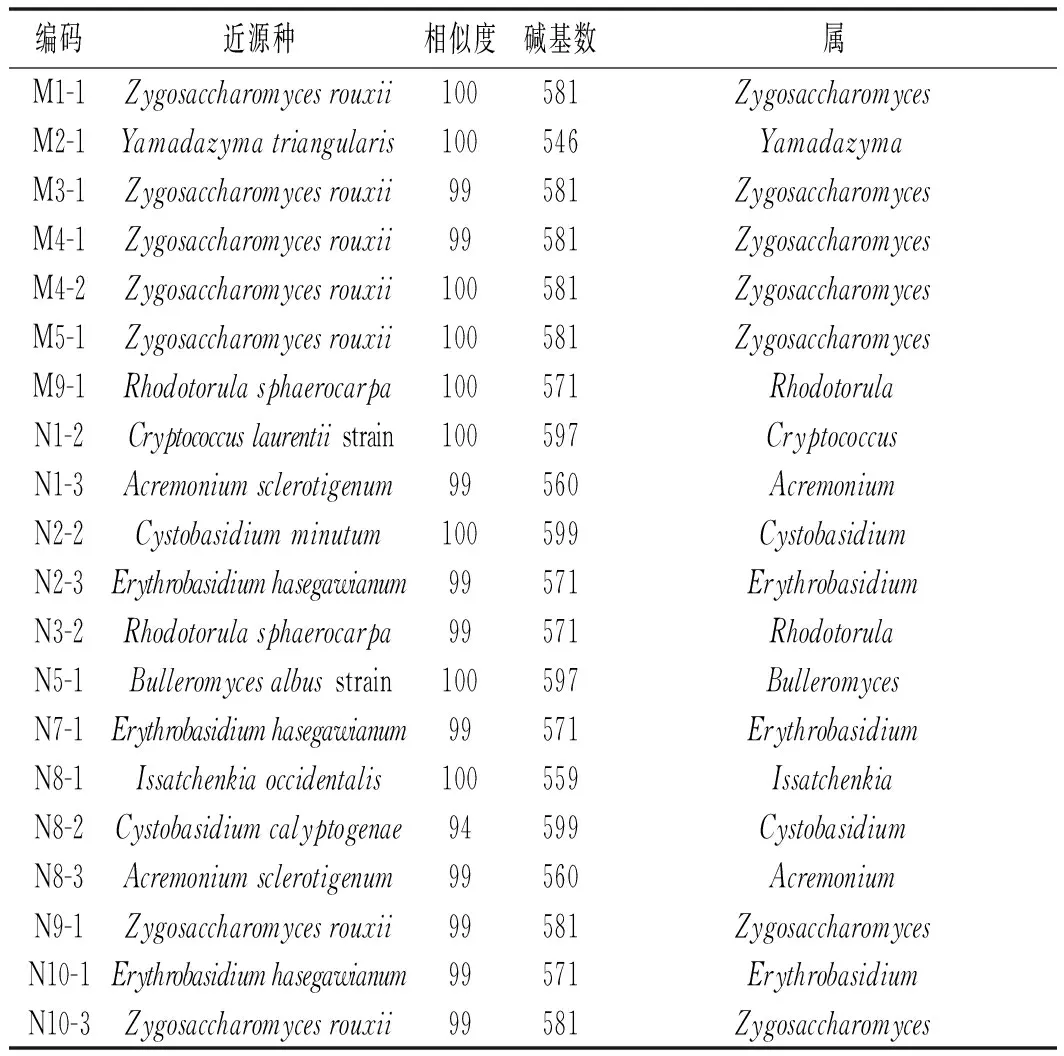
表3 分离菌株的比对结果Table 3 Comparison results of the isolated strains
由表3可知,除了Cystobasidiumcalyptogenae(FJ515245)只有94%相似度(可能为新种,目前实验室正在进行验证),其他分离菌株相似度≥99%。从3份正常发酵襄阳大头菜酱液中分离出13株酵母菌,其中2株Zygosaccharomyces属,3株Cystobasidium属,3株Erythrobasidium属,2株Acremonium属,1株Rhodotorula属,1株Bulleromyces属,1株Issatchenkia属。从3份长膜襄阳大头菜酱液中共分离出7株酵母菌,其中5株Zygosaccharomyces属,1株Yamadazyma属,1株Rhodotorula属。
根据20株酵母菌在NCBI上的比对结果选取相似度高的已知序列菌株,利用MEGA 4.0做出系统发育树,找出待测菌株与已知酵母种属菌株的关系。
2.5 正常发酵大头菜与长膜大头菜酱液中酵母菌的比较
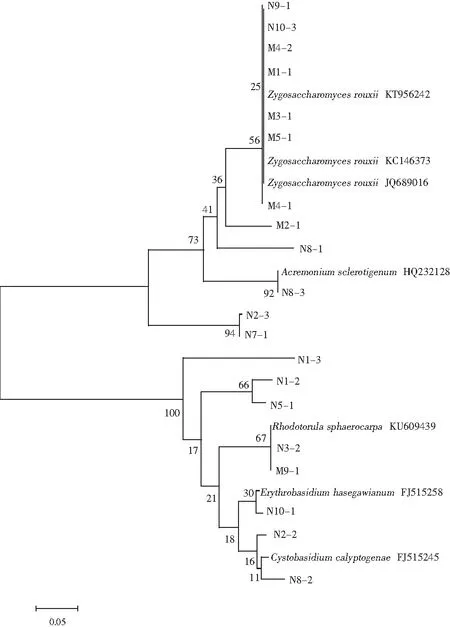
图3 28S rDNA D1/D2 区域序列的系统发育树Fig.3 Phylogenetic tree of 28S rDNA D1/D2 region sequence
20株酵母菌中7株是从长膜大头菜酱液中分离的,13株是从正常发酵大头菜酱液中分离的。长膜大头菜酱液中分离的酵母菌5株属于Zygosaccharomyces属,占总分离菌株的71.4%,为长膜大头菜中酵母菌的优势菌属,其中3株在培养1天后可以看到在YPD培养基的表面长膜,推测可能是引起大头菜长膜的酵母菌株。泡菜中也存在长膜的现象,俗称“生花”。从泡菜中分离的腐败真菌主要为毕赤酵母(Pichiamembranefaciens)[13,14],这与襄阳大头菜中分离的酵母是不同的,两者的腐败机制可能存在着差异,需要进一步的试验验证。正常发酵大头菜酱液中13株酵母菌属于9个属,多样性高于长膜大头菜酱液。Zygosaccharomyces属菌株也存在于正常发酵大头菜酱液中,占分离菌株的15.3%,非优势菌株。
3 结论
本研究分别从3份正常发酵大头菜酱液和3份长膜大头菜酱液中进行了酵母菌的分离,共分离20株菌。通过28S rDNA D1/D2可变区同源性比较及系统发育树分析,20株菌属于10个属2个门。从比对结果可以看出,正常发酵大头菜酱液中的酵母菌多样性高于长膜大头菜酱液,其中长膜大头菜酱液中的优势菌属为Zygosaccharomyces,推测是引起大头菜酱液长膜的酵母菌属。
在泡菜和肉类的腐败过程中,细菌起到了重要的作用[15-17],但是在襄阳大头菜中细菌对大头菜长膜的贡献目前还没有人研究,这是本实验室下一步要进行的工作。

