裂殖壶菌制备二十二碳六烯酸油脂的研究历程及发展前景
胡学超,任路静,胡耀池,纪晓俊,黄和
(南京工业大学药学院,南京工业大学生物与制药工程学院,南京,211816)
二十二碳六烯酸(decosahexaeonic acid,DHA)是一种重要的ω-3长链多不饱和脂肪酸,具有促进脑细胞发育,降血脂,保护视力,抗癌,提高免疫力等重要生理功能[1],广泛应用在婴幼儿食品及医药行业。世界卫生组织早在1994年就规定婴幼儿奶粉中必须添加DHA,市场需求量大。
传统的DHA生产原料主要来源于鱼油,但鱼的种类、季节、地理位置等因素的差异造成了油含量和油中不饱和脂肪酸含量的不稳定;鱼油提取获得的DHA含有大量的EPA(eicosapetaenoic acid, 22∶5),腥味大,且DHA初始含量低,约为10%~20%左右,远远低于使用要求(35%),因此需要将鱼油中的DHA纯化以提高含量。天然的DHA为甘油三酯型,沸点较高,目前最常用的方法是利用甲醇或乙醇进行置换,形成甲酯或乙酯型DHA,沸点降低后提纯[2],但甲酯或乙酯型DHA的人体吸收率相对于甘油酯型DHA低;再加上鱼油来源日渐紧缺,难以实现此种高价值产品在食品和医药行业中的广泛应用。为满足DHA不断增长的市场需求,近年来,科学工作者开展了利用海洋微生物发酵生产DHA的研究。常用的微生物包括隐甲藻 (Cryptheconidiumcohnii)、裂殖壶菌 (Schizochytriumsp.)、吾肯氏藻(Ulkeniaamoeboida)等,裂殖壶菌因其生长速度快、油含量高、DHA比例高,是当前DHA产业化的主要生产菌。本文主要针对生物制备DHA的过程进行综述,以裂殖壶菌为重点,从菌种特性、安全性认证、发酵水平提升、油脂精炼技术的革新等角度论述生物法制备DHA油脂的研究历程及发展前景。
1 DHA的生产菌
1.1 隐甲藻
隐甲藻是一种生活在海洋,没有叶绿素,不能进行自养的双鞭毛甲藻,在腐败的大型褐藻及海藻上易于生长繁殖[3]。隐甲藻的分类地位属于Eukaryota域,Protozoa界,Dinophyta门,Dinophyceae纲,Peridiniales目,Crypthecodiniaceae科,Crypthecodinium属的一类椭球形单细胞海洋微生物。早在1968年HARRINGTON[4]首次发现隐甲藻产DHA的能力后,BEACH等进行了培养条件和环境方面的优化来提高其生产能力。1994年,KYLE等[5]取得了较好的结果,培养60~90 h生物量可达40 g/L,藻种含油量为15%~30%,DHA占总脂肪酸的20%~35%,随后在美国Martek公司实现产业化,创建了Life’s DHA品牌,并在世界范围内进行销售。以de Swaaf代表的荷兰农业研究所团队在21世纪初开发了除葡萄糖外以乙酸[6]、乙醇[7]为底物对C.cohniiATCC 30772进行培养的研究,最高细胞干重达109 g/L,总脂含量61 g/L,DHA含量19 g/L,为至今为止隐甲藻生产DHA报道的最高产量。
1.2 裂殖壶菌
由于隐甲藻发酵生产DHA周期长,产率不高,且生产技术和应用被美国Martek公司垄断,人们将目光转向了海洋真菌——破囊壶菌和裂殖壶菌。裂殖壶菌又称裂壶藻,属于真菌门(Eumycota)、卵菌纲(Oomycetes)、水霉目(Saprolegniales)、破囊壶菌科(Thraustochytriaceae)的一类海洋真菌,单细胞、球形[8]。1964年,HASKINS等人[9]报道,破囊壶菌Traustochytriumaureum总脂中含有高达34%的DHA,揭示了破囊壶菌属微生物产DHA的能力。随后的研究多集中在不同海域中菌种的筛选和培养条件的改进方面。如1990年WILLIAM[10]等也在海水中筛选出一系列破囊壶菌菌属的裂殖壶菌和破囊壶菌菌株,经工艺优化后被应用于Omega Tech公司的后续生产中;1996年NAKAHARA等[11]从日本Yap群岛珊瑚礁附近海水分离到1株裂殖壶菌Schizochytriumsp. SR21,培养56 h,生物量即可达到21 g/L,DHA产量高达4.7 g/L,随后为Sundory公司所用。我国研究者也陆续在中国海域筛选获得了多株裂殖壶菌菌株等,如本团队所筛选的Schizochytriumsp. HX-308[12],中国海洋大学的OUC88[13]等,为国内DHA产业的发展奠定了基础。
1.3 不同DHA生产菌的生产能力差异
除隐甲藻和裂殖壶菌外,破囊壶菌、吾肯氏藻等菌株也可生产DHA。不同菌种生产的DHA其脂肪酸组分和生产能力不同。隐甲藻生产的DHA油脂中C14∶0(月桂酸)含量较高,但不含有DPA(二十二碳五烯酸,ω-6),而海洋真菌中C16∶0(软脂酸)含量较高,含有DPA。
2 微生物来源DHA的安全性认证
2.1 安全性认证
作为婴幼儿食品的DHA油脂,安全性至关重要。世界各国对于DHA油脂的安全性认证主要集中在3种菌,隐甲藻、裂殖壶菌和吾肯氏藻(Ulkeniasp.)。所有的认证都是以公司产品为主,在某个国家申请新资源认证,证明其可以通过安全性评价而作为食品添加剂应用在某些特定的领域。最早的安全认证来自美国马泰克。2000年,其对2个主打产品DHASCO和ARASCO在美国提出GRAS认证,明确指明DHASCO由隐甲藻生产,ARASCO由高山被孢霉生产。而裂殖壶菌的安全认证经历了漫长的历史,直至2010年我国卫生部才颁布相关条文批准来源于双鞭甲藻、裂殖壶菌、吾肯氏藻的DHA藻油可作为新资源食品,添加到食品中,此类规定的出台是国内DHA产业的重要里程碑,促进了国内DHA产业的快速发展。随后,2011年,GB24600—2011关于二十二碳六烯酸油脂(发酵法)的国家标准正式出台,预示着发酵法生产DHA产业的规范化程度日渐成熟。此外,近年来国内也出现了多个DHA的行业标准,如《DHA藻油》、《DHA微囊粉》等,这些行标主要对产品某些特殊的指标又进行了限定。而对于吾肯氏藻的安全性认证,由Nutrinva公司2004年提出申请,最终也通过了美国GRAS认证。
2.2 DHA应用的法律法规
国内外权威部门对DHA的使用量做出了明确的规定。1994年,世界卫生组织推荐每天婴幼儿每公斤体重应该补充20 mg DHA,早产婴儿每天每公斤体重补充40 mg DHA;国际脂肪酸和类脂研究学会(ISSFAL)指出:妊娠和哺乳期妇女每天补充300 mg DHA,欧盟相关组织也做出类似规定,指出妊娠和哺乳期妇女每天至少补充200 mg DHA[14]。在我国,卫生部在2003年食品添加剂使用卫生标准增补品种中,首次将二十二碳六烯酸单细胞油(DHASCO)作为营养素强化剂添加到婴幼儿食品中(添加量在0.09%~0.15%)。2004年在《食品添加剂使用卫生标准》(GB—2760)2004年增补内容中将添加量增加到10~126 mg/100g。2006年在卫生部公告第12号文件中将DHA的添加量增加到30~100 mg/100g,以上法规的出台也使得DHA的使用更加规范。
3 裂殖壶菌发酵产DHA的研究概况
3.1 发酵水平
生产效率的提高是实现裂殖壶菌规模化制备DHA产业化的前提,评价DHA发酵的主要指标包括生物量、油脂产量、DHA占总油脂的百分比。围绕裂殖壶菌发酵水平的提升,国内外研究主要集中在菌种性能提升、发酵过程调控和规模化放大3个方面。
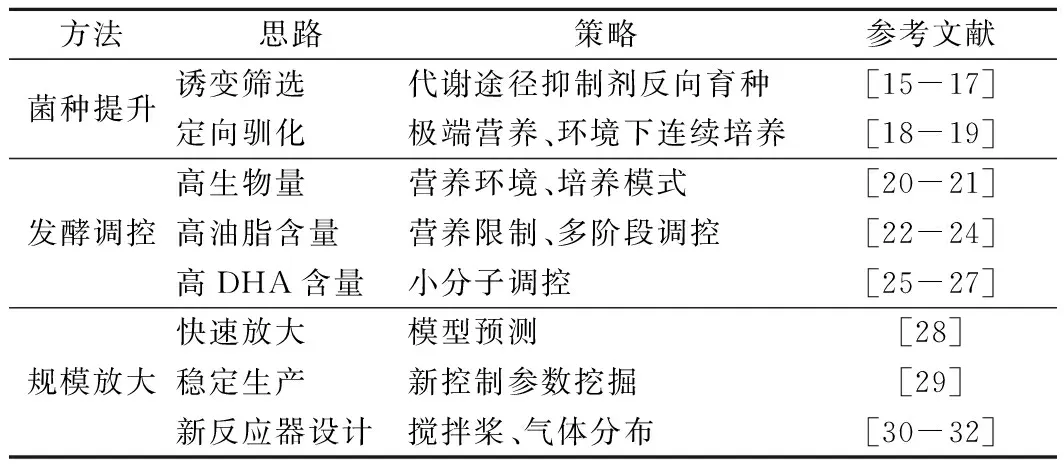
表1 裂殖壶菌发酵水平提升常用的研究策略Table 1 Common research strategies for the improvementof DHA production
在菌种提升方面,诱变育种和菌种驯化是2个主要的研究策略。练敏等[15]提出了利用丙二酸限制三羧酸循环的分流、碘乙酸抑制3-磷酸甘油脱氢酶的定向菌种选育方法,提升柠檬酸从线粒体向胞浆的分流和磷酸戊糖途径的通量,获得了多株高油脂含量生产菌株,其中DHA产量较原始菌提高了35%,油脂含量达到38.6 g/L。除此之外,乙酰辅酶A羧化酶催化乙酰CoA生成丙二酰CoA,而喹禾灵是乙酰辅酶A羧化酶的抑制剂。许永等[16]采用紫外诱变和喹禾灵反向筛选高产DHA的裂殖壶菌,生物量和DHA含量分别提高了11.57%和28.75%。FU等[17]利用低能离子束诱变结合苏丹黑染色的方法进行筛选,DHA产量提高了60%。此外,微生物的适应性进化,又称菌种驯化,是目前备受瞩目的菌种改良技术,通过长期将微生物培养在胁迫环境中,在较短时间内有效地改变菌株的某些表型或者生理特性。孙小曼等[18]开发了不同环境刺激的裂殖壶菌驯化技术,利用高供氧(搅拌转速230 r/min)连续驯化菌种的方法,迫使细胞长期处于氧化损伤状态,改变了裂殖壶菌的氧适应性,在高供氧下也能保证高的DHA含量,同时角鲨烯含量降低了63%。采用高渗和低温双胁迫驯化技术[19],也可提升裂殖壶菌的产油能力和菌种的抗氧化胁迫能力。
在发酵调控方面,高密度发酵、油脂含量的提高、DHA占油脂比例的提升是研究的关键。高密度发酵是胞内产物高效积累的前提,分批补料发酵可以缓解高浓度底物的抑制作用,提高生产效率,分批补加碳源是常规手段。QU等[20]探究了不同补料方式对DHA产量的影响,发现反复分批补料效果最佳。LING等[21]创新性地采用氮源补加策略将细胞干重进一步提高了1倍。其次,营养限制和环境刺激是油脂积累的调控点,但细胞的快速增殖又需要丰富的营养物质和良好的环境条件,因此双阶段的发酵调控工艺在DHA生产中较为普遍,如双阶段控温[22]既可以保证高的细胞生长速率又可以增加不饱和脂肪酸的比例,多阶段氧供应[23]可解决生长的高氧需求和低氧消耗,双阶段渗透压[24]可利用种子阶段高渗刺激分裂、发酵阶段低渗促进油脂积累提高油脂产率。此外,DHA合成的代谢途径需要大量的ATP、NADPH、乙酰辅酶A等辅因子的参与,小分子添加也是常用的研究手段。本研究团队[25]通过在发酵过程中添加苹果酸和乙酸钠的方法提高裂殖壶菌的NADPH和乙酰CoA供应,其中油DHA含量提高至60%;通过添加抗环血酸钠[26]缓解发酵过程中的氧化损伤,胞内ROS降低了35%,DHA含量提高了44%。另外,考虑到裂殖壶菌的微藻属性,一些植物激素如茉莉酸、萘氧基乙酸也用来调控裂殖壶菌的生长,提高油脂产率[27]。
在规模化放大方面,如何做到大规模发酵罐的精准放大并稳定生产是关键。瞿亮等[28]通过逐级放大的方法,建立了裂殖壶菌发酵产DHA的过程放大经验方程,基于经验方程设定大规模发酵罐下的工艺参数,发酵规模从10 L放大到7 t。在DHA生产稳定控制方面,郭东升等[29]研究了不同氧环境下DHA发酵过程中呼吸商RQ、氧气吸收速率OUR、二氧化碳释放速率CER的变化规律,提出OUR可以作为DHA生产过程中的精准控制指标,比溶氧DO有更好的指导意义。由于DHA发酵的高需氧性,DHA的发酵通常在多层桨叶生物反应器中进行,此类反应器中,搅拌桨的改变对发酵结果的影响至关重要。赵晓艳等[30]结合CFD模拟技术研究了3种不同搅拌桨组合对反应器流场和DHA产量的影响,发现直叶、箭叶、直叶的径向流式搅拌桨组合混合效果较好,且能获得较高的DHA产量。此外,近年来一些新型反应器,如膜曝气生物反应器[31]、通气强化膜反应器[32]等也应用到DHA的生产中,其中利用膜曝气生物反应器,DHA发酵的细胞密度达到了151 g/L以上,油脂占细胞干重达到了68%,生产效率提高了83.77%。
3.2 裂殖壶菌合成DHA特殊的代谢途径
传统的多不饱和脂肪酸合成是在线粒体或内质网上通过脂肪酸延长酶和脂肪酸去饱和酶进行碳链延伸和双键引入。但该途径需要多种延长酶和去饱和酶的参与,伴随着多种中间副产物的积累。除了这种常规合成途径外,JAMES等[33]在 Science期刊上首次发现报道裂殖壶菌还存在一种类似迭代型聚酮合酶的复合酶催化合成长链多不饱和脂肪酸。近年来,人们也陆续在自然界发现多种催化不同多不饱和脂肪酸合成的迭代型聚酮合酶[34],并将此类利用聚酮合酶合成的脂肪酸定义为次级脂质,将此类基因簇称之为脂肪酸聚酮合酶(FAS/PKS )基因簇[35]。脂肪酸聚酮合酶(FAS/PKS)包括β-酮酰合成酶(KS)、β-酮酰-ACP还原酶(KR)、烯酰还原酶(ER)、脱水酶/异构酶(DH/I)、酰基转移酶(AT)和酰基载体蛋白(ACP)等功能模块。类似于经典的脂肪酸合成酶催化过程,该酶以乙酰 ACP 为起始单元,以丙酰 ACP 为延伸单元,通过 KS、KR、DH、ER功能域的循环延伸碳链,但脂肪酸聚酮合酶会选择性的缺失最后一步酰基还原(ER )步骤而在脂肪酸链中引入双键[36]。对于DHA的合成,脂肪酸聚酮合酶需要引入6个双键,但是目前对于该酶引入双键的时机和次数控制机制仍然不够清晰。脂肪酸聚酮合酶途径可直接从头合成长链多不饱和脂肪酸产品,与传统的延长去饱和途径相比,具有更高的能量利用效率。以DHA为例,延长去饱和途径需要26个NADPH,聚酮合酶途径仅需要14个,因此,裂殖壶菌胞内这种特殊的不饱和脂肪酸合成途径具有更大的改造空间和应用价值。
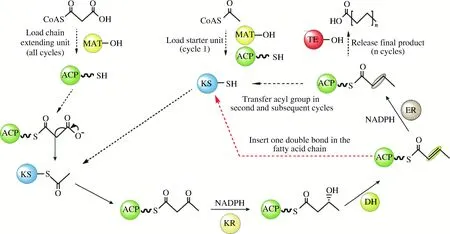
图1 脂肪酸聚酮合酶催化合成不饱和脂肪酸的过程Fig.1 Polyunsaturated fatty acid biosynthesis catalysed by PUFA-PKS synthase
4 DHA油脂的提炼工艺
油脂为胞内产物,细胞破碎是油脂提取的前提,目前已报道的细胞破碎方法有多种,主要分为物理法(微波法、超声法、均质法等)、化学法(酸热法、碱法等)及生物法(酶法等)[37-39]。在DHA产业发展初期,均质法是工业上最常用的细胞破碎方法,但其能耗高,操作复杂,所需人力多。后续人们开发了酶法破碎工艺,筛选不同的酶进行破碎,该方法可直接在发酵罐中进行,无需增加设备,破碎效率比机械破碎高。一般来讲,酶法提取主要利用蛋白酶进行破碎细胞,用量少,约为发酵液质量的0.1%~0.2%,每吨发酵液的处理成本约为100元左右。对于油脂的提取,溶剂提取是常规手段,溶剂的使用和回收使得提取工段的设备投入和成本巨大,同时也给生产过程带来巨大的安全隐患,生产车间也需要防爆。近年来,无溶剂提取工艺[40]逐渐应用到裂殖壶菌的油脂提取过程(如图2),该工艺操作简单,生产效率大大提升。DHA毛油一般通过脱胶、碱炼、脱色、脱臭等工序,除去油脂中的蛋白胶质、皂角、色素和气味性物质,最终获得DHA精油。
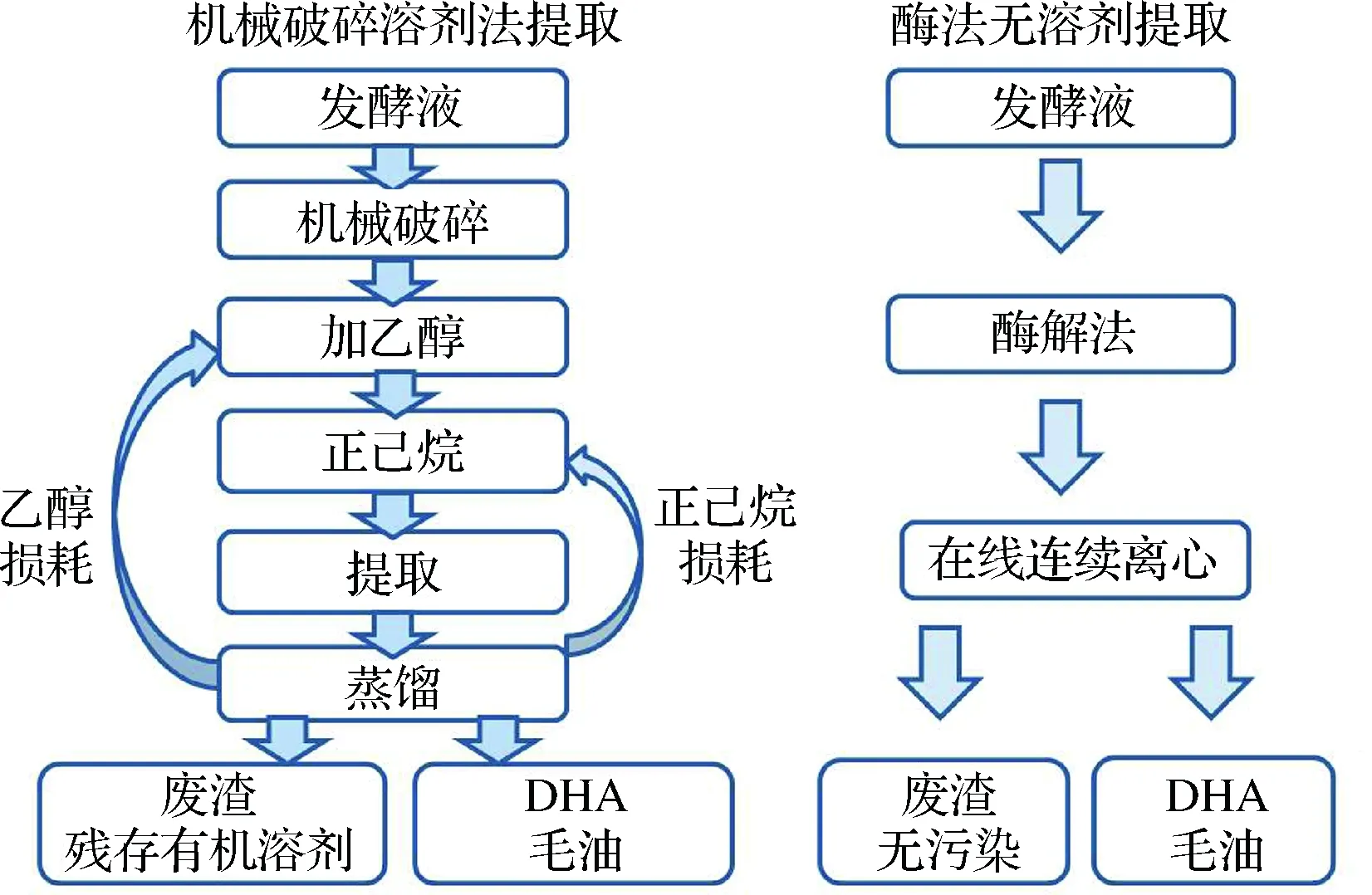
图2 机械破碎溶剂法与酶法无溶剂油脂提取工艺比较Fig.2 Comparison of lipid extraction process between mechanical crushing-solvent method and enzymatic free solvent method
5 发展前景
随着社会各界对婴幼儿健康的关注,以及中国逐步进入老龄化社会,国民的健康需求不断增长,DHA在营养强化剂领域的应用将继续扩大。DHA藻粉还可作为饲料添加剂广泛应用在养殖业,如利用DHA藻粉饲养禽类,获得富含DHA的鸡蛋,鸡蛋中DHA存在于磷脂中,人体吸收率高达100%,还可应用于高档鱼虾类的养殖,前景广阔。此外,目前DHA油脂含量一般在50%以上,更高DHA含量的产品开发也将推进其在医药行业中的应用。鱼油2015年需求量达到10.9亿t,全球市场达到110亿美元,进一步降低藻油价格,加快藻油DHA产品的国外认证,开发既含DHA又含EPA的藻油产品,替代部分鱼油,也具有重要的推广意义。
此外,裂殖壶菌生物量可达到200 g/L,油脂含量占60%以上,且具有独立的饱和脂肪酸和不饱和脂肪酸合成系统,是极具潜力的微生物油脂加工厂。近年来,随着裂殖壶菌全基因组测序、胞内代谢机制的解析以及裂殖壶菌遗传操作体系的建立,在裂殖壶菌中构建其他脂质化学品的代谢途径,有望推进更多的脂溶性营养化学品的开发。

