基于银离子和[β-Mo8O26]4-构筑的二维层状杂化化合物的合成、结构与电化学性质研究
赵琦史振雨张国义彭军龙巍然郑玉国郭晴晴赵婕
(1.兴义民族师范学院贵州省化学合成及环境污染控制和修复技术特色重点实验室,贵州 兴义 562400 2.东北师范大学化学学院多酸科学教育部重点实验室, 吉林 长春 130024)
有机-无机杂化化合物作为一种新型的复合材料,因结构的多样性在很多方面有着广泛的应用,如传感器、气体储存、催化、离子交换、磁学、医药和发光等。[1-4]因此,利用自组装原理和分子设计方法,设计和合成有机-无机杂化化合物在无机化学领域受到持续关注。
多金属氧酸盐是一类无机多核金属-氧簇化合物,具有良好的物理化学性质,且可在分子水平上进行修饰。[5-7]因而,将多金属氧酸盐引入到有机-无机杂化化合物是近代化学研究领域的一个热点。多金属氧酸盐的引入,不仅丰富了该类化合物的结构类型,而且拓宽了其应用前景。[8-10]因此,多金属氧酸盐基有机-无机杂化材料的合成与性能研究就显得十分有意义。同多钼酸盐是多酸家族的中的一个重要组成部分。因为其种类较多,如[Mo6O19]2-、[Mo7O24]6-、[Mo8O26]4-等。同多钼酸根离子表面含有较多的氧原子,表现出较强的配位和键合能力,有利于与有机组分和金属离子相结合,所以,在构筑结构新颖、性能优良的有机-无机杂化材料时,同多钼酸阴离子是一类优选的无机构筑单元,既可以充当模板剂,也可以作为构筑主体。[11-12]
影响有机-无机杂化化合物结构和性质的另一个重要因素就是有机配体。配体的性质,如空间结构、配位点的分布等,可以有效地调节化合物的拓扑结构。多齿有机配体具有多样的键合模式和丰富的构象,增加了结构的复杂性,为形成多维孔材料(链状、层状、三维孔结构)提供了有利条件。[13]
本文中,我们选用多齿含氮配体3,3',5,5'-四甲基-4,4'-联邻二氮杂茂(H2X)作为有机组分,在水热条件下同七钼酸铵和硝酸银作用,得到了一个二维层状的有机-无机杂化化合物[Ag2(H3X)2](β-Mo8O26)。借助红外光谱、热重分析、X-射线单晶衍射等手段确定了该化合物的晶体结构。检测结果表明该化合物属于单斜晶系,P21/c空间群。而且,我们将此化合物制成碳糊电极,对其电化学性能进行了研究。
1 实验部分
1.1 仪器和试剂
C,H,N元素分析使用Perkin-Elmer2400元素分析仪;红外光谱使用Alpha Centaurt FT/IR红外光谱仪,采用KBr压片,光谱仪的波数范围为4000~400cm-1;热重分析使用在 N2氛围的Perkin-Elmer TGA7热分析仪,升温速率为10℃/min,测试温度范围为20℃~800℃;晶体结构分析是在室温条件下使用Brucker SMART-CCD X-射线单晶衍射仪,采用MoKα靶;荧光光谱分析使用FLSP920爱丁堡荧光光谱仪;电化学性能分析使用郑州世瑞思仪器科技有限公司生产的RST5200F电化学工作站,采用常规三电极体系:工作电极为化合物修饰的碳糊电极,铂丝作为对极,饱和甘汞电极作为参比电极。
实验中均使用去离子水,所有试剂均为分析纯。
1.2 单晶的合成
在室温条件下,称取 AgNO3(0.051g),(NH4)6Mo7O24·4H2O(0.124g) 和 H2X(0.019g),溶解在8.0mL去离子水中。然后用磁力搅拌器将悬浊液搅拌30min,并用0.1mol/L HCl溶液将体系的pH值调节至2.6,装入18mL内衬为聚四氟乙烯的不锈钢反应釜中,在160℃恒温鼓风干燥箱中晶化5d,自然冷却至室温后,得到黄色块状晶体,产率为41%(以Mo元素为基准)。C20H30Ag2Mo8N8O26(1781.75)的元素分析理论值(实验值):C13.48(13.34),H1.70(1.79),N6.29(6.18),Ag12.11(12.01)。
1.3 晶体结构的测定
挑选大小为0.25mm×0.22mm×0.18mm的黄色单晶样品粘在玻璃纤维上,室温条件下置于Brucker SMART-CCD单晶X-射线衍射仪,用石墨单色化的 Mo-Kα射线(λ=0.071073nm)收集数据。化合物的晶体结构解析利用SHELXTL-97程序中的直接法,通过差值傅立叶图,先后确定出Mo、Ag、O、C、N 原子的位置,并对所有非氢原子的坐标和各向异性参数采用全矩阵最小二乘法修正,碳原子上的氢原子则采用理论加氢的办法来确定。化合物的晶体学参数列于表1。
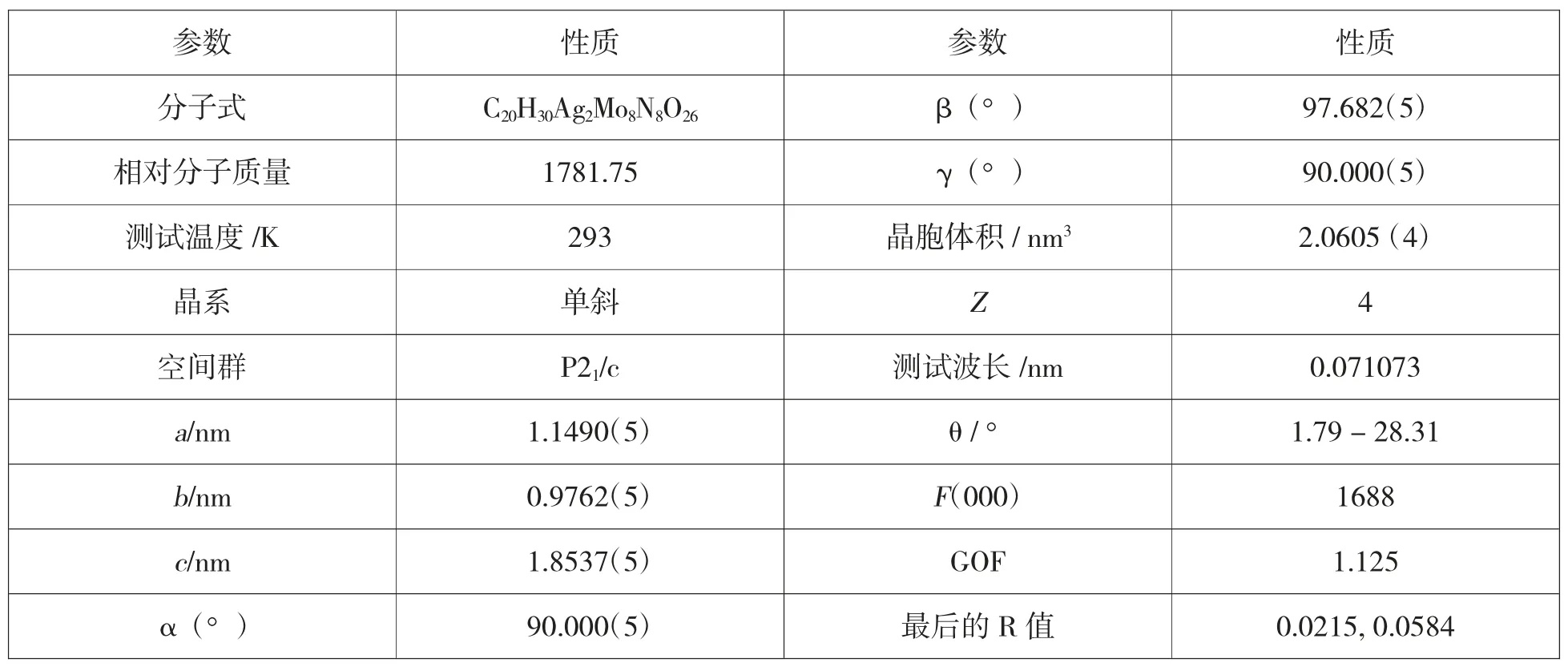
表1 化合物的晶体学参数
1.4 化合物修饰的碳糊电极(1-CPE)的制备
称取20mg化合物和200mg石墨粉,在玛瑙研钵中混合后研磨40min,再加入0.2mL液态石蜡油,用玻璃棒搅拌均匀。将所得的均相混合物装入内径为5mm的电极管中,用铜棒从后面缓缓压紧并作为电极导体,固定好之后再用称量纸把电极表面轻轻磨平。
2 结果与讨论
2.1 化合物的红外光谱和热重分析
从红外光谱图中可以看出标题化合物中含有多酸阴离子β-[Mo8O26]4-和H2X有机配体。在1628~1166cm-1范围内出现的三个强的吸收峰可以归结为H2X有机配体基团上C=C、C=N双键的伸缩振动峰,在964m-1出现的特征峰归属于β-[Mo8O26]4-中的Mo-Ot(端氧)的反对称伸缩振动吸收峰,在888、824、677cm-1处出现的吸收峰则归属为Mo-Ob-Mo(桥氧)的伸缩振动吸收峰。IR谱的分析结果表明,该化合物的结构与单晶结构分析的结果一致。
热重曲线显示化合物在温度低于220℃以下保持稳定,在225-781℃有一个明显的失重过程,对应为配体H2X的分解,并且伴随着晶体骨架的坍塌。该过程总失重为21.82%,与理论值21.33%相一致。
2.2 化合物的晶体结构
单晶X-射线衍射结果如图1所示,标题化合物的每个不对称单元中包括一个Ag(I)离子、一个质子化的有机配体H3X+和半个八钼酸根离子[β-Mo8O26]4-。化合物的银离子采用五配位的三角双锥构型,Ag离子与一个H3X+配体上的氮原子N1(Ag1-N1=2.217(3))和两个[β-Mo8O26]4-上的四个氧原子(O4、O8、O12和 O13)配位。其中有三个氧原子O4、O12和O13来自同一个[β-Mo8O26]4-簇,平均 Ag-O 键长为 2.57(5))。[β-Mo8O26]4-簇由八个共边的MoO6八面体紧密堆积形成,呈现出中心对称的状态。而且,该簇中含有四种氧原子:14个端基氧原子(Mo-Ot平均键长1.702(1)),6个μ2-桥氧原子(Mo-Ob平均键长1.955(8)),4个μ3-桥氧原子(Mo-Ob平均键长2.095(7))以及 2个 μ5-桥氧原子(Mo-Ob平均键长2.357(4))。[β-Mo8O26]4-簇的六个端基氧原子采用螯合配位的形式与两个Ag离子配位,充当六齿配体。有机配体H2X上未配位的氮原子被质子化,从而使化合物整体呈现电中性。
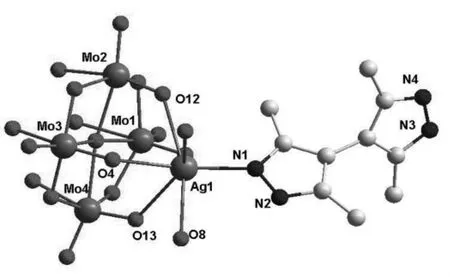
图1 标题化合物的单胞结构图
相邻的 [β-Mo8O26]4-簇通过Ag1-O8键连接起来,沿着c轴伸展形成1D结构(图2)。
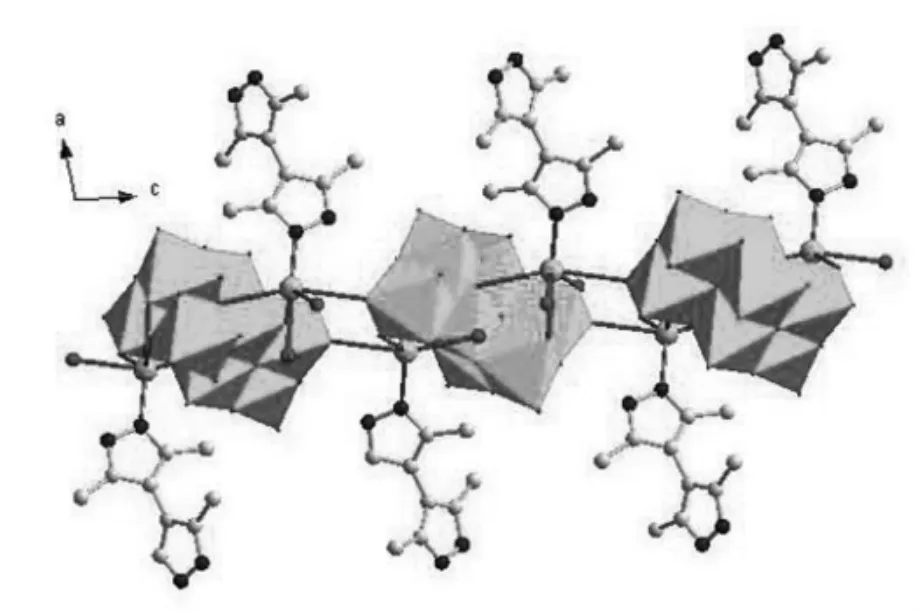
图2 标题化合物的1D链结构(有机配体部分除了配位的氮原子以外其它部分均被省略,浅蓝色的球为银离子,深蓝色的球为氮原子,红色的球为氧原子,[β-Mo8O26]4-用绿色多面体表示。)

图3 标题化合物的2D层结构(沿a轴方向观察)
如图3所示,[β-Mo8O26]4-簇通过共价键与四个[Ag(H3X)]2+络合物片段连接在一起,在bc平面上形成2D层状结构。
2.3 化合物的荧光性质
化合物中的银离子为d10组态,该组态电子和共轭体系的配合物通常具有良好的荧光性能,因此,在光学领域有着广泛的应用。在室温条件下,在波长345nm的光对配体H2X激发下,在441nm处出现最大发射峰,可以归属于配体的π*→π电子跃迁;用波长365nm的光激发标题化合物时,荧光发射峰的最大值出现在421nm。与配体的发射情况相比较,标题化合物的荧光发射峰发生了明显的蓝移现象,大约位移20nm。而且,标题的荧光强度远远低于配体H2X,这可能是由于Ag离子和有机配体H2X配位所导致的。
2.4 化合物的电化学行为及电催化性能
标题化合物修饰的碳糊电极(1-CPE)在1.0 mol/L H2SO4溶液中的电化学行为如图4所示。图4a为1-CPE在不同扫速下的循环伏安曲线,从图中可以清楚地看到在-200~+600mV范围内存在3对可逆的氧化还原峰I-I',II-II'以及III-III',所对应的半波电位分别为-65.93mV,167.60mV,349.53mV。当扫速为120mV/s时,其氧化还原峰的电位分别为 I-I′(Epred=-93.61mV,Epox=-38.24mV),Ⅱ -Ⅱ '(Epred=140.45mV,Epox=194.75mV),Ⅲ-Ⅲ(Epred=322.39mV,Epox=376.66mV);根据计算结果可知三对峰的峰电位差 ΔEp分别为 55.37mV、54.30mV、54.27mV,即ΔEp<59mV,充分证明了这三对氧化还原峰是可逆的。按照公式ΔEp=59/n,可得知转移的电子数依次为 1.06,1.09,1.08,对应于[β-Mo8O26]4-簇中Mo原子的三个连续的单电子氧化还原过程,对应的电对分别为Mo(VI)/Mo(V),Mo(V)/Mo(IV)以及 Mo(IV)/Mo(III)。
当扫速由120mV/s升至280mV/s时,从图4(a)中可以观察到:随着扫速的增加,三对氧化还原峰的峰电流不断增大,阴极峰的电位向着更负的方向偏移,而阳极峰的电位变化恰好相反,朝着更正的方向移动,从而使峰位差不断增大。图4b为峰I-I′对扫速曲线图,从图4b中可以发现,随着扫速的不断增加,阳极峰的峰电流与其相对应的阴极峰的峰电流几乎同等程度地增大,而且,峰电流与扫速成正比,表明1-CPE的氧化还原过程是表面控制的。
同时,我们也研究了1-CPE对NO2-还原的电催化性能,测试了1-CPE在1.0mol/L H2SO4溶液中加入不同浓度的NaNO2时的循环伏安曲线。如图5所示,1-CPE对NO2-离子的还原展示出了良好的催化效果:随着NO2-离子浓度的增加,1-CPE的所有还原峰的电流随之增加,而氧化峰的电流均逐渐减小,这说明了[β-Mo8O26]4-簇作为催化剂,对NO2-的还原有着良好的催化性能。

图4(a)1-CPE在1.0mol/L的H2SO4电解质溶液中,不同扫速下(扫速由里向外为 120,140,160,180,200,220,240,260mV/s) 的循环伏安图;(b)1-CPE 中氧化还原峰I-I′的峰电流随扫速变化的曲线图。

图5 扫速为 120mV/s时,1-CPE在在不同浓度NaNO2溶液中的循环伏安图
3 结论
利用水热合成方法,我们通过选用3,3',5,5'-四甲基-4,4'-联邻二氮杂茂为有机配体和七钼酸铵作用,成功地合成了一个二维有机-无机杂化化合物,并对其结构进行了一系列表征。荧光分析和电化学实验的结果表明,该化合物有着良好的荧光和电催化性能,在荧光材料和电催化领域有着潜在的应用价值。

