绿萝花及其多糖对S180荷瘤小鼠免疫细胞的影响
李 琦,孙翠翠,2,朱子凤,刘 群*
(1.西南民族大学生命科学与技术学院,四川成都 610041;2.南通大学实验动物中心,江苏南通 226000;3.西南民族大学校医院,四川成都 610041)
绿萝花(ScindapsusaureusLinden ex Andre,Engl)为天南星科(Araceae)喜林芋属植物绿萝花的干燥花蕾(别名石柑子、马蹄金、黄金葛等),产于西藏和喜马拉雅山脉寒冷地带。藏区习俗泡茶饮用于预防和治疗高血压、高血脂、糖尿病及各类血管炎症。现代药理研究表明,绿萝花具有降血糖[1-4]、降血脂[5-6]、抗氧化[7-9]和增强机体免疫功能的作用。本研究在杨荣等[10]和孙翠翠等[11]的体外抗肿瘤和诱导肿瘤细胞凋亡的研究成果基础之上,以水萃取和醇沉法制备绿萝花浸膏和粗多糖为研究材料,流式细胞术为检测手段,S180荷瘤小鼠CTL、HTL、NK细胞为检测指标,探讨绿萝花对机体肿瘤免疫功能的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 S180肉瘤小鼠,购自中国医学科学院基础医学研究所基础医学细胞中心。清洁级KMRI小鼠,雄性,6周龄,体重18 g~22 g,购自四川省达硕有限公司,动物生产许可证号:SCXK(川2015-030)。
1.1.2 研究材料 绿萝花干燥花蕾,购自四川宇妥藏药药业有限责任公司,由西南大学园艺园林学院鉴定(鉴定人:李先源)。绿萝花浸膏和粗多糖的提取参考文献[12]和[13]进行,由本研究室制备、保存。
1.1.3 试剂及仪器 FITC标记的抗鼠单克隆抗体CD3、APC标记的抗鼠单克隆抗体CD4、APC-CY7标记的抗鼠单克隆抗体CD8、PE标记的抗鼠单克隆抗体CD335、FITc标记的小鼠IgGI(553971)美国BD公司产品;APC标记的小鼠IgGI、APC-CY7标记的小鼠IgGI、PE标记的小鼠IgGI、流式上样管,美国BD公司产品;流式细胞仪,Beckman公司产品。
1.2 方法
1.2.1 绿萝花浸膏和粗多糖口服液的制备 绿萝花浸膏口服液:将浸膏换算成生药含量并配制成50%、100%、200%浓度的口服液,4℃冰箱保存备用。绿萝花粗多糖口服液:将粗多糖换算成生药含量并配制成100 mg/mL浓度的口服液,4℃冰箱保存备用。
1.2.2 荷瘤S180小鼠建立 取S180肉瘤生长良好小鼠,取瘤体制备瘤细胞悬液。取10 μL瘤细胞悬液稀释10倍后加入等体积的4 g/L台酚蓝染色进行细胞计数,调整瘤细胞浓度为1×106个/mL。无菌接种于小鼠右前肢腋部皮下(0.2 mL/只)。
1.2.3 实验动物分组及处理 小鼠接种S180瘤细胞24 h后,随机分为6组,每组21只,另设空白对照组。各组处理如下(注:除健康对照组外,其余各组的肿瘤大于1 g,为荷瘤小鼠):健康对照组:每天灌胃生理盐水0.2 mL,连续28 d;模型对照组:每天灌胃生理盐水0.2 mL,连续28 d;高剂量组:每天灌胃绿萝花口服液(2.0 g/kg),连续28d;中剂量组:每天灌胃绿萝花口服液(1.0 g/kg),连续28 d;低剂量组:每天灌胃绿萝花口服液(0.5 g/kg),连续28 d;多糖组:每天灌胃绿萝花多糖口服液(100 mg/kg),连续28 d;阳性对照组:每天灌胃环磷酰胺(20 mg/kg),连续28 d。
接种24 h后开始灌服药物,每日1次。在给药的第7、14、28天,每组随机抽取7只小鼠,摘眼球采血,用于检测CTL、HTL、NK细胞活性。
1.2.4 肿瘤免疫相关活性细胞检测 具体操作流程(淋巴细胞表面标记-溶血-洗涤-重悬-检测)按照测试试剂盒说明书进行。同型对照管作为定标,检测10 000个细胞;以前向散射角(FSC)为横坐标,侧向散射角(SSC)为纵坐标的二维散点图上,按照外周血中血细胞大小和细胞内结构的复杂程度,分为细胞碎片、淋巴细胞、单核细胞和中性粒细胞;应用flowjo 10.1软件计算淋巴细胞中各标记细胞的百分率。
2 结果
2.1 绿萝花对CD3+T细胞的影响
不同剂量绿萝花浸膏口服液、绿萝花多糖口服液在不同检测点对S180荷瘤小鼠CD3+T细胞影响见表1和表2。健康小鼠血液中的CD3+T细胞数量稳定,接种S180瘤细胞7 d后,荷瘤对照组小鼠CD3+T细胞数量出现极显著降低(P<0.01),且随着时间的延长(14 d和28 d)呈极显著下降(P<0.01);口服低浓度绿萝花口服液7 d后,荷瘤小鼠CD3+T细胞数量低于健康小鼠(P<0.05),随着给药时间的延长(14 d和28 d)也呈极显著下降(P<0.01),但在给药28 d时,CD3+T细胞数量极显著高于荷瘤对照组小鼠(P<0.01);口服中浓度绿萝花口服液7 d后,荷瘤小鼠CD3+T细胞数量与健康小鼠相当(P>0.05),且随着给药时间的延长(14 d和28 d)也呈极显著和显著升高(P<0.01,P<0.05)并极显著高于低浓度绿萝花组(P<0.01);口服高浓度绿萝花口服液7 d后,荷瘤小鼠CD3+T细胞数量与健康小鼠相当(P>0.05),且随着给药时间的延长(14 d和28 d)呈极显著升高(P<0.01)并与中浓度绿萝花组相当(P>0.05);口服绿萝花多糖口服液7 d后,荷瘤小鼠CD3+T细胞数量显著高于健康小鼠(P<0.05),极显著高于荷瘤对照组小鼠(P<0.01),随着给药时间的延长(14 d和28 d)也呈极显著升高(P<0.01)并极显著高于3个浓度的绿萝花浸膏口服液组(P<0.01);口服环磷酰胺7 d后,荷瘤小鼠CD3+T细胞数量均极显著高于其他各组(P<0.01),但随着给药时间的延长(14 d和28 d)呈极显著下降趋势(P<0.01),虽与高浓度绿萝花组相当(P>0.05),但极显著低于绿萝花多糖组(P<0.01)。结果表明,小鼠接种S180瘤细胞后,血液中CD3+T细胞数量下降,口服不同剂量绿萝花口服液、绿萝花多糖和环磷酰胺后,在不同检测时间点,荷瘤小鼠血液中CD3+T细胞数量升高,中、高剂量绿萝花、绿萝花多糖、环磷酰胺作用明显,尤其以多糖升高效果最佳,且随着给药时间的延长,效果越明显,说明绿萝花(1 g/kg~2.0 g/kg)及绿萝花多糖(100 mg/kg)连续口服7 d~28 d,具有升高由S180瘤细胞引起的小鼠血液中CD3+T细胞数量下降趋势的作用。
2.2 绿萝花对CD4+/CD8+比值的影响
不同剂量绿萝花浸膏口服液、绿萝花多糖口服液在不同检测点对S180荷瘤小鼠CD4+/CD8+T细胞比值影响见表3和表4。
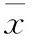
表1 各组CD3+T细胞数量组间比较(%,±SD,n=7)
注:同行数据肩上标有相同小写字母表示差异不显著(P>0.05),标有不同小写字母表示差异显著(P<0.05),标有不同大写字母表示差异极显著(P<0.01)。
Note:The data marked with the same lowercase letters in the same row indicate no significant difference (P>0.05),with different small letters mean significant difference (P<0.05) and with different capital letters mean extremely significant difference (P<0.01).
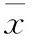
表2 各组CD3+T细胞数量组内比较(%,±SD,n=7)
注:同列数据肩上标有相同小写字母表示差异不显著(P>0.05),标有不同小写字母表示差异显著(P<0.05),标有不同大写字母表示差异极显著(P<0.01)。
Note:The data marked with the same lowercase letters in the same column indicate no significant difference (P>0.05),with different small letters mean significant difference (P<0.05) and with different capital letters mean extremely significant difference (P<0.01).
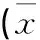
表3 各组CD4+/CD8+T细胞比值组间比较±SD,n=7)
注:同行数据肩上标有相同小写字母表示差异不显著(P>0.05),标有不同小写字母表示差异显著(P<0.05),标有不同大写字母表示差异极显著(P<0.01)。
Note:The data marked with the same lowercase letters in the same row indicate no significant difference (P>0.05),with different small letters mean significant difference (P<0.05) and with different capital letters mean extremely significant difference (P<0.01).
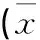
表4 各组CD4+/CD8+T细胞比值组内比较±SD,n=7)
注:同列数据肩上标有相同小写字母表示差异不显著(P>0.05),标有不同小写字母表示差异显著(P<0.05),标有不同大写字母表示差异极显著(P<0.01)。
Note:The data marked with the same lowercase letters in the same column indicate no significant difference (P>0.05),with different small letters mean significant difference (P<0.05) and with different capital letters mean extremely significant difference (P<0.01).
表3和表4表明,荷瘤对照组,低、中剂量绿萝花组荷瘤小鼠血液HTL/CTL细胞比值(CD4+/CD8+T细胞),在接种S180瘤细胞7 d~28 d与健康小鼠比较差异不显著(P>0.05);口服高浓度绿萝花口服液7 d后,CD4+/CD8+T细胞比值升高后呈下降趋势(P<0.05)并与其他各组差异不显著(P>0.05);口服绿萝花多糖口服液及环磷酰胺7 d~28 d后,CD4+/CD8+T细胞比值在各检测时间的组间组内比较差异不显著(P>0.05)。试验结果表明,在接种S180瘤细胞后,小鼠血液中的CD4+/CD8+T细胞比值无变化,同样各给药组CD4+/CD8+T细胞比值差异不显著,说明接种S180瘤细胞及绿萝花(0.5 g/kg~2.0 g/kg)及绿萝花多糖(100 mg/kg)连续口服28 d,对 S180荷瘤小鼠和健康小鼠血液中CD4+/CD8+T细胞比值无影响。
2.3 绿萝花对CD335+细胞的影响
不同剂量绿萝花浸膏口服液、绿萝花多糖口服液在不同检测点对S180荷瘤小鼠CD335+T淋巴细胞影响见表5和表6。
表5 各组CD335+T细胞数量组间比较(%,±SD,n=7)
注:同行数据肩上标有相同小写字母表示差异不显著(P>0.05),标有不同小写字母表示差异显著(P<0.05),标有不同大写字母表示差异极显著(P<0.01)。
Note:The data marked with the same lowercase letters in the same row indicate no significant difference (P>0.05),with different small letters mean significant difference (P<0.05) and with different capital letters mean extremely significant difference (P<0.01).
表6 各组CD335+T细胞数量组内比较(%,±SD,n=4)
注:同列数据肩上标有相同小写字母表示差异不显著(P>0.05),标有不同小写字母表示差异显著(P<0.05),标有不同大写字母表示差异极显著(P<0.01)。
Note:The data marked with the same lowercase letters in the same column indicate no significant difference (P>0.05),with different small letters mean significant difference (P<0.05) and with different capital letters mean extremely significant difference (P<0.01).
表5和表6表明,健康小鼠血液中的CD335+T细胞数量稳定,接种S180瘤细胞7 d后,荷瘤对照组小鼠CD335+T细胞数量下降,虽无统计学意义(P>0.05),但随着时间的延长(14 d和28 d)呈下降趋势;口服低浓度绿萝花口服液7 d后,荷瘤小鼠CD335+T细胞数量虽与健康小鼠、荷瘤对照组小鼠相当(P>0.05),但随着给药时间的延长(14 d和28 d)呈上升趋势,在给药28 d时,CD335+T细胞数量显著高于荷瘤对照组小鼠(P<0.05);口服中浓度绿萝花口服液7 d后,荷瘤小鼠CD335+T细胞数量虽与健康小鼠、荷瘤对照组小鼠相当(P>0.05),但随着给药时间的延长(14 d和28 d)呈上升趋势,在给药28 d时,CD335+T细胞数量达到显著升高(P<0.05)并极显著高于健康小鼠和荷瘤对照组小鼠(P<0.01);口服高浓度绿萝花口服液7 d后,荷瘤小鼠CD335+T细胞数量虽与健康小鼠、荷瘤对照组小鼠相当(P>0.05),随着给药时间的延长(14 d和28 d)呈下降和上升趋势,但差异不显著(与低、中绿萝花组也无统计学意义);口服绿萝花多糖口服液7 d后,荷瘤小鼠CD335+T细胞数量虽与健康小鼠、荷瘤对照组小鼠相当(P>0.05),但随着给药时间的延长(14 d、28 d)CD335+T细胞数量呈上升趋势,28 d时达到极显著差异(P<0.01)且极显著高于其他各组(P<0.01);口服环磷酰胺7 d后,荷瘤小鼠CD335+T细胞数量虽与健康小鼠、荷瘤对照组小鼠相当(P>0.05),随着给药时间的延长,CD335+T细胞数量变化不大,但在给药的28 d,显著低于绿萝花多糖组(P<0.05)。试验结果表明,接种S180瘤细胞后,小鼠血液中CD335+T细胞数量虽有下降,但差异并不显著;口服环磷酰胺后,荷瘤小鼠血液中CD335+T细胞数量变化不大;口服不同剂量绿萝花及绿萝花多糖均能提高荷瘤小鼠血液中CD335+T细胞数量,以中浓度绿萝花和绿萝花多糖效果最佳,且随着给药时间延长,效果越明显,说明绿萝花(1.0 g/kg)及绿萝花多糖(100 mg/kg)连续口服14~28 d,具有升高S180瘤荷小鼠和健康小鼠CD335+T细胞数量的作用。
3 讨论
3.1 肿瘤免疫相关活性细胞
淋巴细胞在机体的免疫应答中起着重要的作用,特别是在天然免疫应答和获得性免疫应答转换中起着重要的桥梁作用。在天然免疫系统中重要的抗肿瘤效应细胞主要有T淋巴细胞和自然杀伤细胞。T淋巴细胞亚群主管细胞免疫,具有抵抗病毒和调节免疫系统功能的作用,其细胞功能取决于T淋巴细胞总值(CD3+)及其亚群细胞毒T淋巴细胞(CD8+)和辅助性T淋巴细胞(CD4+)的相对组成,CD3+T细胞数量的变化可反应机体细胞免疫功能状态;CD4+T细胞是调控免疫反应重要枢纽细胞,起诱导和辅助作用;CD8+T细胞是免疫反应中直接杀伤性细胞,起抑制和毒杀作用;CD4+/CD8+T细胞比值(免疫平衡水平)是判断机体免疫功能紊乱的敏感指标,生理情况下,亚群间互相拮抗达到平衡,比值维持在一定范围,当免疫失衡,比值发生异常[14]。自然杀伤细胞具有部分T细胞分化抗原和IL-2受体,在IL-2刺激下可诱发产生IFN-γ并与靶细胞接触释放穿孔素,导致细胞溶解并分泌颗粒酶,诱发细胞凋亡,是天然免疫系统中重要的抗肿瘤效应细胞[15]。测定肿瘤动物T淋巴细胞和NK细胞数量及活性是评价药物的抗肿瘤作用重要指标。
3.2 藏药绿萝花及多糖对肿瘤免疫功能的影响
T淋巴细胞表面分布着CD3+,CD3+连接T淋巴细胞与抗原受体信号的传递,故可将CD3+数目用来衡量T淋巴细胞数目[16]。肿瘤会导致外周血T淋巴细胞数下降、CD4+/CD8+T细胞的比值降低及小鼠CD3+、NK细胞数降低,机体免疫功能下降[17]。本研究表明,小鼠接种S180瘤细胞后,血液中CD3+T细胞数量下降,CD335+T细胞下降变化不明显,CD4+/CD8+T细胞比值变化无统计学意义;不同剂量绿萝花及绿萝花多糖能有效抑制T淋巴细胞增殖能力的下降,表现为CD3+、CD335+T细胞数量上升,CD4+/CD8+T细胞比值相对稳定,从而达到提高机体的肿瘤免疫功能,尤其是绿萝花(1 g/kg~2.0 g/kg)及绿萝花多糖(100 mg/kg)连续口服7 d~28 d升高CD3+T细胞效果明显,且随着给药时间的延长,效果越佳;绿萝花(1.0 g/kg)及绿萝花多糖(100 mg/kg)连续口服14 d~28 d,升高S180瘤荷小鼠和健康小鼠CD335+T细胞数量效果明显,且随着给药时间的延长,效果越佳;接种S180瘤细胞及绿萝花(0.5 g/kg~2.0 g/kg)及绿萝花多糖(100 mg/kg)连续口服28 d,对 S180荷瘤小鼠和健康小鼠血液中CD4+/CD8+T细胞比值无影响。由于肿瘤发病率的日益增加,人类对健康的渴望越来越急切,对副作用小的抗肿瘤药物的研究备受瞩目,鉴于绿萝花富含多种生物活性成分及其良好的生物安全性,能够较好的调节机体免疫力,更加突显研究绿萝花活性成分——多糖对机体抗肿瘤及其调节免疫功能作用的意义。

