酒当归水煎液各极性部位制备方法、成分分析与补血活性研究
何 建,纪 鹏,李琛琛,华永丽,姚万玲,魏彦明
(甘肃农业大学动物医学院,甘肃兰州 730070)
当归别名岷归,为伞形科(Umbelliferae)多年生草本植物当归[Angelicasinensis(Oliv.)Diels]的干燥根,是甘肃省道地药材,味甘、辛、微苦,性温,既可扶正补养又可攻邪治病[1-2],主要功效为补血活血、调经止痛、润肠通便,具有极高的药用和保健价值[3],被广泛用于兽医临床上。其所含成分丰富,包括多糖、阿魏酸、香豆素、挥发油、黄酮、微量元素等[4]。资料记载,当归多炮制后使用,临床常用的炮制品有酒当归、土当归、当归炭等[5]。酒当归补血效果最佳,在兽医临床上使用较多,且往往以水煎液的形式使用。为促进兽医临床上酒当归补血产品开发应用,筛选酒当归水煎液中最佳补血活性部位具有重要意义。
超声辅助液液萃取法是基于液-液萃取法并辅以超声技术的一种新方法,它主要是用超声波在超声过程中产生的一系列效应,来对萃取过程中的传质作用进行加速[6],最终提高萃取效率。索氏提取是一种液固萃取方法,其用在沸腾时冷凝下来的萃取溶剂对被萃取样品进行反复萃取[7]。两者相比,各具优点[7]。为筛选酒当归水煎液中较优补血活性部位,本试验基于酒当归水煎液中化学成分极性大小,依据超声辅助萃取与索氏提取两种方法,从酒当归水煎液中分别制备乙酸乙酯部位、正丁醇部位与水部位。通过综合比较各部位的得率,筛选出最佳制备方案,采用高效液相色谱法对各部位成分进行初步分析,另采用动物试验,比较各部位的补血效果,为兽医临床补血药物的开发提供理论依据。
1 材料与方法
1.1 材料
1.1.1 药材与主要试剂 当归购自甘肃岷县,经甘肃农业大学中兽医教研室鉴定为当归Angelicasinensis(Oliv.) Diels。经切制、清洗与晒干后,按《甘肃省中药炮制规范》制备成酒当归,存放于实验室备用。甲醇、乙腈、冰乙酸(均为色谱纯),Sigma公司产品;乙酸乙酯(分析纯)、正丁醇(分析纯),烟台市双双化工有限公司产品。
1.1.2 实验动物 清洁级昆明小鼠80只,雌雄各半,体重23 g±2 g,由兰州兽医研究所实验动物中心提供(许可证编号 SCXK (甘) 2015-0001)。
1.1.3 主要仪器 1260型高效液相色谱仪,美国Agilent公司产品;YP 1102H型分析天平,上海精密科学有限公司产品;RE-6000旋转蒸发仪,上海亚荣生化仪器厂产品;真空干燥箱,上海一恒科学仪器有限公司产品;玻璃蛇形脂肪提取器,郑州赛克斯玻璃仪器有限公司产品;BC5300Vet五分类动物血液细胞分析仪,迈瑞生物医疗电子股份有限公司产品。
1.2 方法
1.2.1 酒当归水煎液样品的制备 根据前期单因素结合响应面分析法得到的酒当归水煎液最佳提取条件进行酒当归水煎液的制备[8]。共提取3次,3次得到的水煎液置于旋转蒸发仪中浓缩,浓缩至浸膏后置于真空干燥箱中干燥,得到干粉。
1.2.2 酒当归水煎液各极性部位提取
1.2.2.1 超声辅助萃取法
(1)乙酸乙酯部位:精密称取酒当归水煎液干粉(过40目筛)10 g,溶于100 mL蒸馏水中,加入100 mL乙酸乙酯,超声辅助萃取1 h。重复萃取3次,每次萃取完后置于分液漏斗中静置1 h,收集上层溶液。合并萃取液,浓缩到一定体积后真空干燥至恒重,所得物质即为酒当归水煎液的乙酸乙酯部位。
(2)正丁醇部位:上述乙酸乙酯部位提取后,下层液体置于通风橱中,在微控数显电热板上使其挥发至无乙酸乙酯。加入正丁醇100 mL,同样采用上述超声辅助萃取3次,合并萃取液体,并浓缩到一定体积后真空干燥至恒重,所得淡黄色干粉物质即为酒当归水煎液的正丁醇部位。
(3)水部位:上述正丁醇部位提取后,采用以上操作最终制备出的棕褐色干粉物质即为酒当归水煎液的水部位。
1.2.2.2 索氏提取法
(1)乙酸乙酯部位:精密称取酒当归水煎液干粉(过40目筛)10 g,将其置于脱脂滤纸包内,放入玻璃蛇形脂肪提取器中。在圆底烧瓶内加入300 mL乙酸乙酯,并置于温度为85℃的恒温水浴锅进行回流提取。当玻璃蛇形脂肪提取器内的乙酸乙酯溶液变成无色,则终止提取。
(2)正丁醇部位:将乙酸乙酯部位提取完全的滤纸包置于通风橱中使乙酸乙酯残留物挥发完全。再采用上述方法,加蒸馏水300 mL,在电热套中回流提取制备成正丁醇部位。
(3)水部位:将正丁醇部位提取完全的滤纸包置于通风橱中,使正丁醇残留物挥发完全。再采用上述方法,加蒸馏水300 mL,在电热套中回流提取制备成水部位。
得率=(不同提取部位平均质量÷酒当归水煎液干粉质量)×100%
1.2.3 各部位成分分析
1.2.3.1 多糖含量测定
(1)葡萄糖标准曲线的制作(苯酚-硫酸法):精确称取干燥至恒重的葡萄糖标准品100 mg于100 mL容量瓶,加蒸馏水摇匀、定容,作为母液。分别吸取1、2、3、4、5、6 mL母液于 mL的容量瓶,加蒸馏水定容,得到浓度分别为20、40、60、80、100、120 μg/mL的葡糖糖标品溶液。精确吸取1 mL不同浓度的标品溶液于干燥的具塞试管中,各试管分别滴加1.8 mL g/L的苯酚溶液,再缓慢加入7.5 mL浓硫酸,充分混匀,密封后沸水浴加热20 min,待冷却后测定吸光度。以相同处理的蒸馏水为空白,于483 nm波长测得各浓度的OD值,平行测定3次,求其平均值,绘制葡萄糖浓度的标准曲线。
(2)各部位中粗多糖的制备与总糖含量测定:分别精确称取1 g酒当归水煎液的3个部位的干粉于3个三角瓶中,加入2 mL蒸馏水溶解,然后加入无水乙醇使其最终含乙醇浓度为65.80%,密封静置12 h。然后抽滤获得上层漂浮物。将获得的漂浮物依次用无水乙醇、丙酮、乙醚充分润洗后真空干燥成粉末,即得各部位中的当归粗多糖。精确称取10 mg的上述粗多糖于 mL的容量瓶中,加入蒸馏水,超声处理(40 kHz,50℃,30 min)使其完全溶解后定容。按照上述的苯酚-硫酸法测定样品的OD值,得到3次平行的平均值。
(3)果糖标准曲线的制备:分别精密吸取100、150、200、250、300、350、400 μL的果糖标准品溶液(1 mg/mL)于试管中,分别加入400 μL的DNS显色剂,定容至5 mL并加试管塞,于沸水浴中加热5 min,用流水迅速冷却至室温振荡摇匀,室温放置0.5 h后于510 nm处测定OD值。
(4)样品的处理及还原糖的测定:精确称取醇沉后的干粉10 mg,定容于10 mL的容量瓶中,吸取400 μL的待测液按上述DNS法测定样品的吸光度值A,得到3次平行的平均值。
多糖含量=总糖含量-还原糖含量。
1.2.3.2 HPLC分析
(1)各极性部位样品的前处理:分别取各部位样品0.05 mg,采用70%色谱甲醇定容到10 mL容量瓶中,经 0.22 μm 微孔滤膜过滤,滤液于4℃贮藏备用。
(2)色谱条件:Agilent ZORBAX SB-C18色谱柱(4.6 mm×150 mm,5 μm);紫外检测器。乙酸乙酯部位:流动相:1 mL/L冰乙酸A-甲醇B;梯度洗脱,流速:1.0 mL/min;柱温:28℃;检测波长:280 nm[9];进样量10 μL;正丁醇部位:流动相:8.5 mL/L磷酸A-乙腈B;梯度洗脱,流速1.0 mL/min;柱温:35℃;检测波长:316 nm[10];进样量10 μL;水部位:流动相:0.85%磷酸A-乙腈B;梯度洗脱,流速0.8 L/min;柱温:35℃;检测波长:316 nm[10];进样量10 μL。
1.2.4 动物分组与造模 试验动物为清洁级昆明小鼠80只,雌雄各半,体重23 g±2 g,购于兰州兽医研究所实验动物中心。待适应环境3 d后,将它们随机分为8个组,这些组分别命名为正常对照组(NC)、模型组(M)、乙酸乙酯部位低、高剂量干预组(EAL与EAH),正丁醇部位低、高剂量干预组(NBL与NBH),水部位低、高剂量干预组(WL与WH)。各部位干预组分别灌胃等量不同部位溶液(10 g/kg),正常对照组给予等量蒸馏水,模型组给予同样体积蒸馏水。于每天早上9点灌胃,每隔24 h灌胃1次,持续9 d。模型组、各部位干预组分别于给药第2日及第5日,给予乙酰苯肼生理盐水溶液(剂量分别为20 mg/kg与40 mg/kg,皮下注射),从第5日起,每日给予环磷酰胺生理盐水溶液(40 mg/kg,腹腔注射),持续4 d。正常对照组同时注射等量生理盐水。
1.2.5 动物一般行为学观察 观察各组小鼠被毛色泽、精神等情况。
1.2.6 取材及检测 各组于试验结束后,麻醉后取血做血常规检测,检测各组小鼠全血中的红细胞(RBC)、白细胞(WBC)、血红蛋白(Hb)指标。
1.2.7 统计学分析 数据经整理后,计量资料用mean±SD表示,使用SPSS16.0软件进行统计学分析,两组间差异比较采用采用t检验,多组间差异比较采用单因素方差分析,P<0.05表示差异具有统计学意义。
2 结果
2.1 超声辅助萃取和索氏提取两种方法制备酒当归水煎液各极性部位得率
超声辅助萃取、索氏提取两种方法制备酒当归水煎液各极性部位得率见表1和表2。超声辅助萃取制得乙酸乙酯部位得率为0.686%,正丁醇部位得率为6.218%,水部位得率为83.99%。索氏提取制得乙酸乙酯部位得率为0.252%,正丁醇部位得率为3.209%,水部位得率为84.028%。
2.2 酒当归水煎液不同极性部位多糖含量分析
葡萄糖的标准曲线见图1,可得葡萄糖标准曲线的回归方程,表明吸光度值与葡萄糖浓度在20 μg/mL~140 μg/mL范围内成线性相关。
y=0.008x+0.127 (R2=0.998 7)
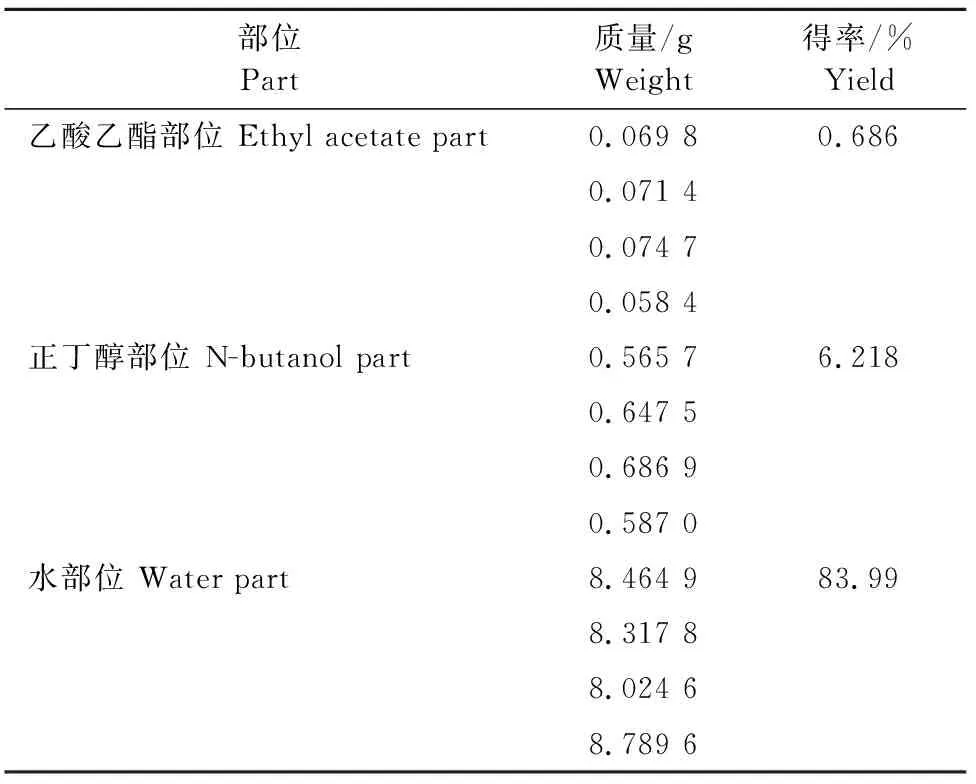
表1 超声辅助萃取酒当归水煎液各极性部位得率
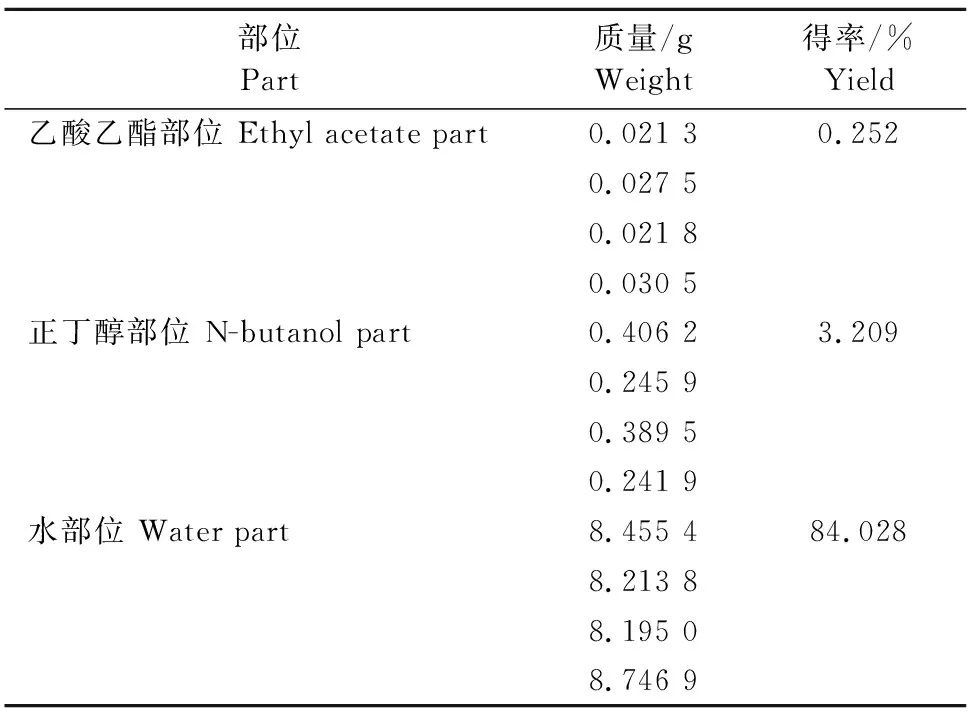
表2 索氏提取酒当归水煎液各极性部位得率

图1 葡萄糖标准曲线
果糖标准曲线见图2,可得果糖标准曲线的回归方程,表明吸光度值与果糖浓度在20 μg/mL~100 μg/mL范围内线性相关。
y=0.009x-0.173 (R2=0.999)
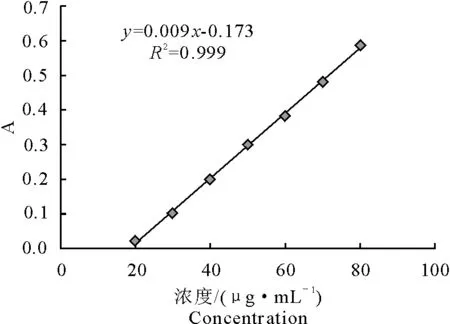
图2 果糖标准曲线
酒当归水煎液中乙酸乙酯部位与正丁醇部位未检出多糖,水部位中1 mg粗多糖中总糖为628.94 μg,还原糖为376.375 μg,所以水部位中1 mg粗多糖中的多糖含量为252.565 μg。
2.3 酒当归水煎液不同极性部位HPLC初步分析
采用高效液相色谱法(HPLC)对各部位进行成分初步分析,乙酸乙酯、正丁醇与水部位的HPLC分析图谱分别见图3、图4和图5,酒当归乙酸乙酯部位、正丁醇部位与水部位中峰的个数与强度具有明显差异。
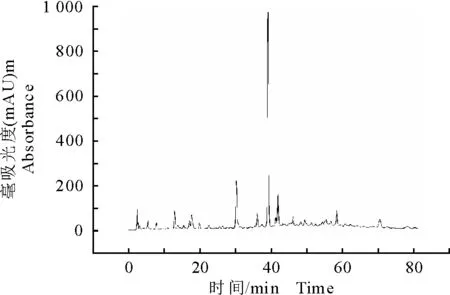
图3 酒当归乙酸乙酯部位的高效液相色谱图
2.4 酒当归水煎液不同极性部位补血活性分析
2.4.1 临床观察 和NC组比较,M组小鼠毛杂乱无章,没有光泽,眼睛反应不灵敏,动作迟钝缓慢,无精神,耳朵、尾部没有血色,喜欢呆在一起。和M组小鼠比较,各部位干预组的小鼠,有精神,尾巴、耳朵颜色正常,小鼠被毛有一定的光泽、动作反应敏捷。其中WH组小鼠表现最接近NC组,其次为NBH组。
2.4.2 酒当归水煎液对血虚小鼠血常规的影响 小鼠血常规检测结果见图6。与正常对照组相比较,模型组小鼠血液中的RBC、WBC数目与Hb含量均显著减少(P<0.05)。与模型组相比,各部位干预组小鼠血液中的RBC、WBC数目与Hb含量均显著升高(P<0.05)。与乙酸乙酯部位高剂量干预组相比,除WBC指标外,水部位高剂量干预组与正丁醇部位高剂量干预组小鼠血液中的RBC数目与Hb含量均显著升高(P<0.05)。与水部位低剂量干预组相比较,水部位高剂量干预组小鼠血液中的RBC、WBC数目与Hb含量显著升高(P<0.05)。与正丁醇部位低剂量干预组相比较,除WBC指标外,正丁醇部位高剂量干预组各指标均显著升高(P<0.05)。说明水部位与正丁醇部位对血虚小鼠的干预效果较好,且具有一定的量效关系。
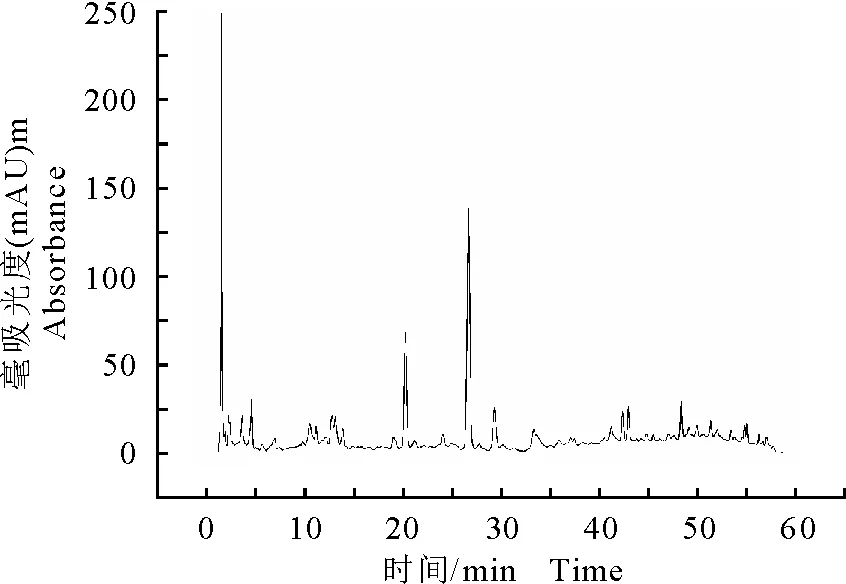
图4 酒当归水煎液正丁醇部位的高效液相色谱图
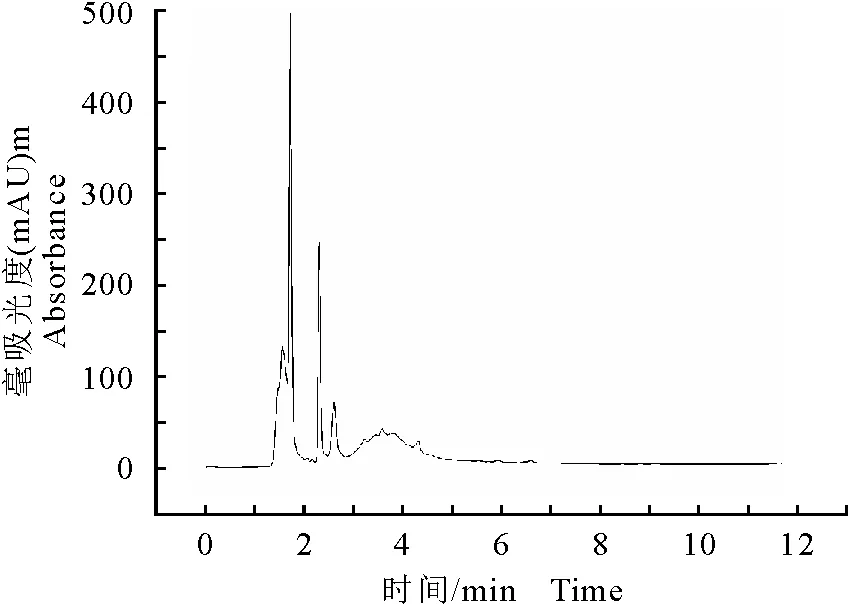
图5 酒当归水煎液水部位的高效液相色谱图
3 讨论
中兽医学对保障我国畜牧业健康发展发挥了重要作用,长期以来用于预防和治疗畜禽疾病,具有效果确实、毒副作用小和不易形成耐药性、确保动物性食品安全等优点,符合现代畜牧业绿色发展的需求。从动物价值与福利来考虑,畜禽发生血虚对其生产性能影响很大[11]。血虚主要是由气血生化不足和失血过多两方面引起,中兽医学理论认为“虚则补之”,因此治疗动物血虚重在养血补血。当归为甘肃道地药材,对畜禽有显著补血效果[12]。前期研究发现,当归中主要补血成分为当归多糖[13]。当归炮制方法常包括油炒、酒炒、土炒与炒炭[14]。当归经炮制后,所含的主要活性成分会发生显著变化[15-16],其药效也随之发生显著变化[17],且有资料显示当归酒炙后补血效果显著增强[18]。中药水煎液形式为目前临床常见剂型,吸收快且疗效佳,但是其也存在一定的弊端,如给药比较困难、药物容易浪费等。因此,基于化学与动物试验相结合的方法,尝试分离筛选出酒当归水煎液中有效补血成分具有一定的临床价值。

字母不同表示差异显著(P<0.05) The different letters denote significant difference (P<0.05)
本研究通过比较对酒当归水煎液进行分离提取各极性部位的两种方法,结果显示超声辅助萃取所得乙酸乙酯、正丁醇部位约为索氏提取量的3倍,证实应用超声辅助技术来强化提取过程,可有效提高提取效率,节约成本,经分析原因可能是酒当归水煎液浸膏所得干粉含糖量较高、易结块,导致索氏提取法未能充分提取,而超声辅助萃取技术更加适于分离提取酒当归水煎液各部位,这与以往报道相符[19]。
为筛选酒当归最佳补血部位,以乙酰苯肼与环磷酸酰胺联合复制小鼠血虚动物模型,血液红细胞、白细胞数和血红蛋白含量显著下降,表明小鼠血虚模型建立成功,而不同极性部位的酒当归水煎液对乙酰苯肼与环磷酰胺引起的血虚模型,具有明显升高红细胞、白细胞数和血红蛋白含量的作用以发挥对血虚模型小鼠的治疗作用,其中以水部位(剂量1.24 g/mL)与正丁醇部位(剂量0.1 g/mL)对血虚的治疗效果较好。
多糖成分检测与HPLC-UV分析比较各部位成分,发现酒当归水煎液中乙酸乙酯部位与正丁醇部位未检出多糖,水部位中1 mg粗多糖中总糖为628.94 μg,还原糖为376.375 μg,表明水部位中1 mg粗多糖中的多糖含量为252.565 μg。HPLC-UV分析,显示酒当归乙酸乙酯部位、正丁醇部位与水部位中峰个数与强度具有明显差异。其中乙酸乙酯部位的检测波长为280 nm,正丁醇和水部位的均为316 nm,查阅文献[9-10],并结合摸索液相分析条件发现乙酸乙酯部位在280 nm处,可以检测出较多种类物质,而正丁醇和水部位均在316 nm可以检测出较多种类物质。不同部位峰个数与强度差异较大,经分析原因可能是3个部位因极性的不同,造成各部位成分出现多样性差异。正丁醇部位与水部位补血效果较好,可以推测这2个部位所含的补血成分含量较高,可为后续补血部位成分的深入研究奠定基础,并为开发兽医临床当归补血药物提供依据。

