体质指数对肝癌切除术后患者远期预后的影响
张 欣, 杨欣荣, 周 俭
复旦大学附属中山医院肝肿瘤外科,上海 200032
原发性肝癌(以下简称“肝癌”)全球发病率位居恶性肿瘤第6位,死亡率位居第4位,年均新发病例达841 000例,死亡病例达782 000例[1]。虽然手术是目前治疗肝癌最有效的手段,但大多数患者确诊时已处于疾病晚期,导致手术效果差且预后不良。肥胖是目前较为突出的健康问题,是多种慢性疾病的高危因素,同时还与多种恶性肿瘤的发病密切相关。肥胖对于肿瘤预后的影响因肿瘤类型而异。在乳腺癌、子宫内膜癌、前列腺癌、胰腺癌、结直肠癌、卵巢癌以及某些血液系统恶性肿瘤患者中,肥胖者的预后较差[2-4];而在肺癌、食管癌、肾癌等恶性肿瘤患者中,肥胖者的预后更好[5]。
目前,肥胖对肝癌预后的影响尚存争议。毕华强等[6]发现,肥胖肝癌患者的3年无瘤生存率明显高于体质量正常者,且肥胖不是术后并发症发生的危险因素。刘家宏等[7]研究表明,肥胖的肝癌患者术后肝功能恢复缓慢。另有国外研究[8-9]证实,肥胖的肝癌患者围手术期死亡风险较高。因此,本研究通过回顾性分析近年来在复旦大学附属中山医院行肝癌切除术的患者的相关资料,进一步评估体质指数(body mass index, BMI)对肝癌切除术后远期预后的影响。
1 资料与方法
1.1 一般资料 回顾性分析2000年1月至2006年9月在复旦大学附属中山医院行肝癌根治性切除术的肝细胞肝癌(hepatocellular carcinoma, HCC)患者388例,以及肝内胆管细胞癌(intrahepatic cholangiocellular carcinoma, ICC)患者208例。肝癌根治性切除标准参考《原发性肝癌诊疗规范(2017年版)》[10]。患者的临床病理特征见表1。纳入标准:(1)肿瘤完整切除,组织学证实切缘无肿瘤组织残留;(2)术后病理学证实为HCC或ICC;(3)术前未进行其他抗肿瘤治疗;(4)具备完整的随访资料。排除标准:(1)病理学证实为转移性肝癌;(2)术前接受过其他抗肿瘤治疗者。根据术前BMI,将患者分为3组:BMI<18.5 kg/m2组(消瘦组);18.5 kg/m2≤BMI<25 kg/m2组(体质量正常组);BMI≥25 kg/m2组(超重肥胖组)。本研究经医院伦理委员会审核批准,患者知情同意并签署知情同意书。
1.2 随访及复发处理 所有患者在术后第1年每2个月随访1次,1年后每6个月随访1次;随访截至2017年3月。随访方式包括电话随访及门诊定期随访。具有高危复发因素(手术切除标本提示血管侵犯或者发现肿瘤卫星灶)的患者均在术后接受1~3个疗程的预防性经肝动脉化疗栓塞(TACE)治疗(多柔比星+5-氟尿嘧啶+碘油)[11]。随访项目包括血清甲胎蛋白(AFP)、腹部超声、胸片及腹部增强CT扫描。如果怀疑复发,则立即行CT或MRI扫描。对确诊肿瘤复发者,根据复发灶的大小、部位及数目,有无淋巴结或骨转移等指标,进行相应的规范化治疗,包括二次肝切除术、TACE、射频消融术、经皮无水乙醇注射、放化疗以及靶向治疗等。

表1 596例入组肝癌患者的一般情况 n(%)
HCC:肝细胞肝癌;ICC:肝内胆管细胞癌;HBsAg:乙肝表面抗原;HCV:丙型肝炎病毒;ALT:丙氨酸氨基转移酶;γ-GGT:γ-谷氨酰转肽酶;BMI:体质指数
1.3 观察指标 总体生存率(overall survival, OS)定义为自手术之日起至死亡或最后1次随访时的时间间隔。复发时间(time to recurrence, TTR)定义为术后至首次出现影像学复发的时间间隔(包括肝内复发以及肝外转移)。影像学复发依据RECIST标准(1.1版)[12]评价。
1.4 统计学处理 采用SPSS 22.0以及Graph Pad 5 进行统计分析。采用Kaplan-Meier法计算OS及TTR,组间比较采用log-rank检验;生存资料单因素分析采用Cox比例风险回归模型,有统计学意义的因素纳入Cox多因素模型进行分析。检验水准(α)为0.05。
2 结 果
2.1 BMI对肝癌术后OS的影响 Kaplan-Meier分析显示,在388例HCC患者中,消瘦组、体质量正常组与超重肥胖组的中位生存时间分别为21、66、81个月;在208例ICC患者中,消瘦组、体质量正常组与超重肥胖组的中位生存时间分别为8.3、18、26个月。
结果(图1A)表明:388例HCC患者中,消瘦组、体质量正常组与超重肥胖组的5年OS分别为27.2%、51.4%、60.2%;10年OS分别为11.6%、39.3%、47.5%。消瘦组HCC患者5年与10年OS均低于其他两组(P<0.001);体质量正常组与超重肥胖组差异无统计学意义。
结果(图1B)表明:208例ICC患者中,消瘦组、体质量正常组与超重肥胖组的5年OS分别为13.3%、19.7%、19.6%;由于消瘦组及超重肥胖组患者未能随访至术后10年或中途失访,仅得出体质量正常组的10年OS,为2.3%。消瘦组ICC患者5年OS低于其他两组(P<0.05);体质量正常组与超重肥胖组差异无统计学意义。

图1 HCC(A)和ICC(B)患者总体生存率
2.2 BMI对肝癌术后累计复发率(cumulative recurrence rate, CRR)的影响 388例HCC患者中,消瘦组、体质量正常组与超重肥胖组的中位TTR分别为14、42.5、48个月;208例ICC患者中,消瘦组、体质量正常组与超重肥胖组的中位TTR分别为7、11、12个月。
结果(图2A)表明:388例HCC患者中,消瘦组、体质量正常组与超重肥胖组的5年CRR分别为83.4%、58.9%、55.7%;10年CRR分别为87.6%、70.9%、65.6%。消瘦组HCC患者5年与10年CRR均高于其他两组(P<0.001);体质量正常组与超重肥胖组差异无统计学意义。
结果(图2B)表明:208例ICC患者中,消瘦组、体质量正常组与超重肥胖组的5年CRR分别为90%、84.9%、87.2%;由于消瘦组及超重肥胖组患者未能随访至10年或中途失访,仅得出体质量正常组的10年CRR,为87.3%。3组CRR差异均无统计学意义。
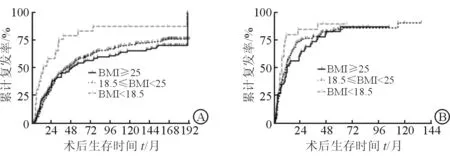
图2 HCC(A)和ICC(B)患者累计复发率
2.3 Cox回归模型预后分析
2.3.1 HCC 结果(表2、表3)显示:388例HCC患者中,肿瘤大小、肿瘤数目、γ-GGT水平、肝硬化、血管侵犯、BMI(消瘦与否)是影响术后总体生存的独立因素(P<0.05);肿瘤数目、γ-GGT水平、肝硬化、血管侵犯、BMI(消瘦与否)是影响术后复发的独立因素(P<0.05)。
2.3.2 ICC 结果(表4、表5)显示:208例ICC患者中,年龄、肿瘤大小、γ-GGT水平、肿瘤包膜是影响总体生存的独立因素(P<0.05);肿瘤大小、γ-GGT水平和肿瘤包膜是影响术后复发的独立因素(P<0.05)。

表2 影响HCC患者OS与CRR的Cox单因素分析
OS:总体生存率;CRR:累计生存率;HR:风险比;AFP:甲胎蛋白;HBsAg:乙肝表面抗原;HCV:丙型肝炎病毒;γ-GGT:γ-谷氨酰转肽酶;ALT:丙氨酸氨基转移酶;BMI:体质指数
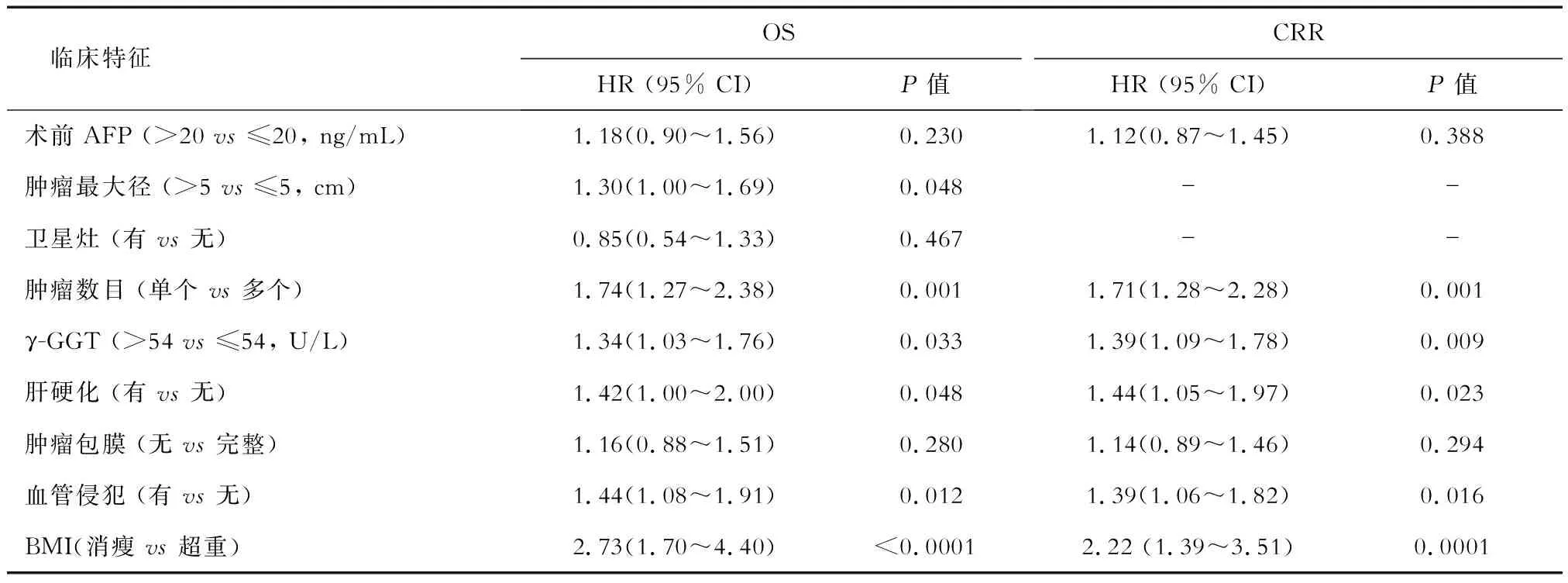
表3 影响HCC患者OS与CRR的Cox多因素分析
OS:总体生存率;CRR:累计生存率;HR:风险比;AFP:甲胎蛋白;γ-GGT:γ-谷氨酰转肽酶;BMI:体质指数
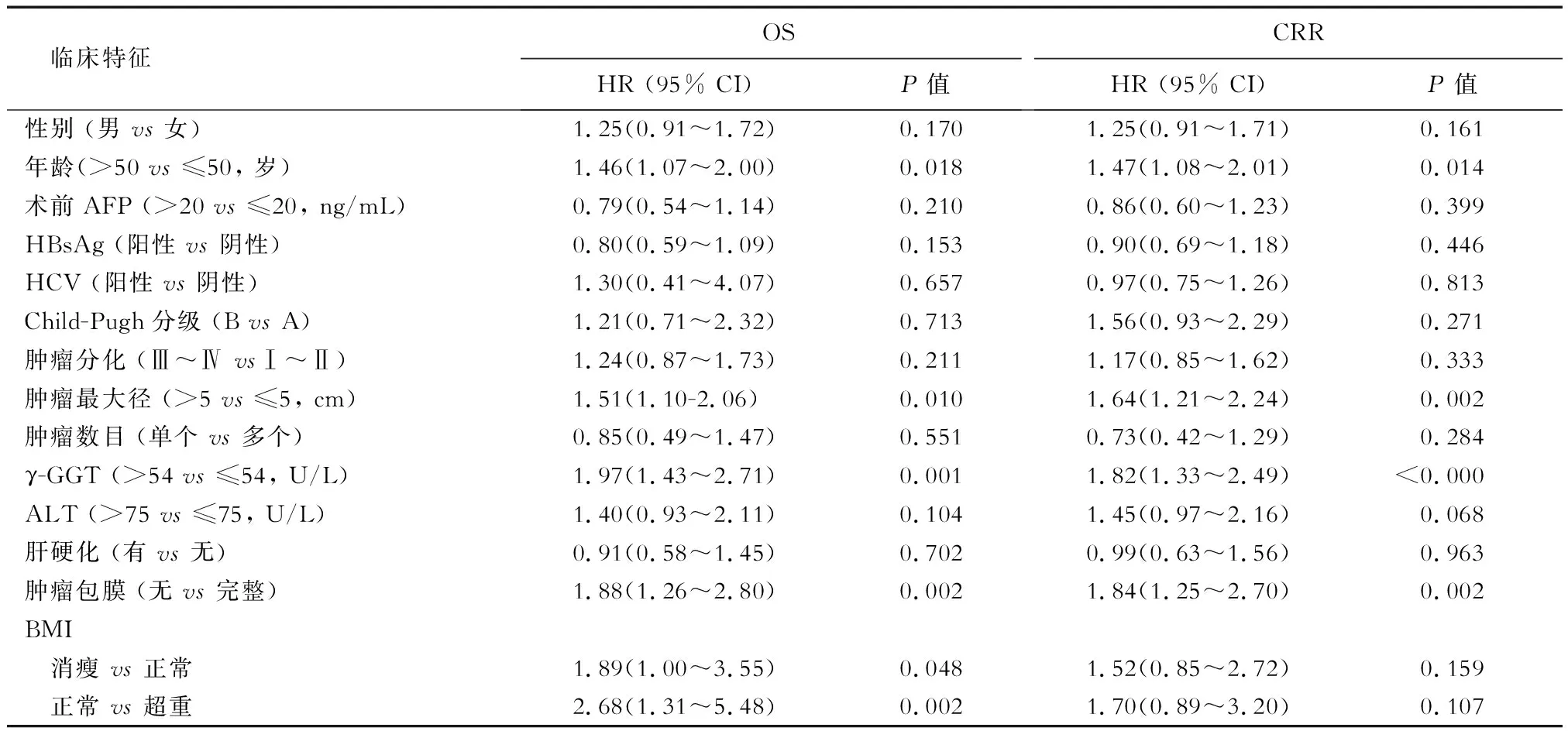
表4 影响ICC患者OS与CRR的Cox单因素分析
OS:总体生存率;CRR:累计生存率;HR:风险比;AFP:甲胎蛋白;HBsAg:乙肝表面抗原;HCV:丙型肝炎病毒;γ-GGT:γ-谷氨酰转肽酶;ALT:丙氨酸氨基转移酶;BMI:体质指数

表5 影响ICC患者OS与CRR的Cox多因素分析
OS:总体生存率;CRR:累计生存率;HR:风险比;γ-GGT:γ-谷氨酰转肽酶;BMI:体质指数
3 讨 论
肥胖与乳腺癌、胰腺癌、肝癌、甲状腺癌、膀胱癌、卵巢癌、非霍奇金淋巴瘤等恶性肿瘤相关[4, 13-15]。肥胖的恶性肿瘤患者常预后不良,但肥胖促进肿瘤进展,导致患者预后不良的机制尚不清楚。研究[16-17]认为,肥胖患者循环中性激素水平较高是某些荷相关肿瘤患者预后不佳的原因之一。研究[18]提示,能量摄取失衡可能影响基因组的稳定性,造成生长信号传导失调,细胞能量代谢紊乱、凋亡抑制。而这些因素是肿瘤发生发展的关键因素。
近年来,有学者提出了不同的看法。虽然肥胖可增加肾透明细胞癌(clear-cell renal cell carcinoma, ccRCC)的发病风险[19],但一项针对2 119例ccRCC病例的研究发现,超重或肥胖患者较体质量正常者疾病进展风险降低了近40%,而且BMI越高,ccRCC相关死亡率越低[20]。基因分析表明,肥胖者脂肪酸代谢相关基因表达更低,其中部分基因已被发现在肿瘤中过表达,并与肿瘤生长相关,提示肥胖患者肿瘤细胞生长较缓慢[20]。
国内外研究中,肥胖对肝癌切除远期预后影响结论不尽相同。Utsunomiya等[21]报道,超重或肥胖患者肝癌切除术后5年生存率更低。而Itoh等[22]发现,肥胖患者肝癌切除术后20年的生存率高于非肥胖患者。本研究纳入肝癌患者596例,其中HCC 388例、ICC 208例,随访10余年,结果表明,不论是HCC还是ICC中,虽然超重肥胖组的OS与体质量正常组差异无统计学意义,但消瘦组OS低于其他两组;HCC患者中,消瘦组CRR高于其他两组;ICC患者中,3组间CRR差异无统计学意义,但变化趋势与HCC相似。多因素预后分析显示,消瘦(BMI<18.5 kg/m2)可作为独立预后指标预测HCC患者术后的OS及CRR。这可能与消瘦患者全身情况及营养状况均较差,导致机体免疫机能下降有关;而且,消瘦患者对后续各类治疗(如放化疗)的耐受差,不良反应更严重,生活质量不佳,因此生存率更低[23]。
虽然BMI测定简便、迅速、临床应用普遍,但其不能全面反应机体的代谢状态、营养情况及脂肪肌肉含量等。而这些指标对肿瘤患者的预后存在至关重要的影响[24]。而且,超重或者肥胖的患者可能存在肌肉消耗,而肌肉消耗可能被机体过多的脂肪所掩盖;或存在严重的腹腔积液及无法站立时,其BMI常无法被准确测得[25]。因此,单独应用BMI作为营养指标来评价肿瘤患者的预后情况存在一定局限性。
综上所述,本研究中,消瘦组肝癌切除术后患者OS较超重肥胖组与体质量正常组降低,而CRR升高,提示积极改善患者术前及术后的营养状态有利于改善其远期预后;但超重肥胖组与体质量正常组患者的OS与CRR差异无统计学意义,可能与单独应用BMI评价预后的局限性有关。肥胖或脂肪代谢如何影响肿瘤的发生、发展值得深入研究。

