添加微细鲽鱼鱼骨泥对金线鱼鱼糜凝胶品质的影响
李学鹏,刘慈坤,范大明,王金厢,仪淑敏,励建荣,*,李婷婷,李钰金,牟伟丽,沈 琳,黄建联
(1.渤海大学食品科学与工程学院,辽宁 锦州 121013;2.江南大学食品学院,江苏 无锡 214122;3.大连民族大学生命科学学院,辽宁 大连 116600;4.荣成泰祥食品股份有限公司,山东 荣成 264300;5.蓬莱京鲁渔业有限公司,山东 烟台 265600;6.大连东霖食品股份有限公司,辽宁 大连 116007;7.辽宁安井食品有限公司,辽宁 鞍山 361003)
近年来,我国水产品加工行业趋向于多元化发展,已形成了冷冻调理制品、鱼糜制品、干制品、腌熏制品、罐头制品、调味品、休闲食品等加工食品体系。伴随水产品加工业的快速发展而产生的下脚料问题成为困扰行业的一大难题,下脚料的高值化利用及生物转化已成为企业未来竞争力的关键[1]。鲽鱼是我国主要的海水养殖和加工品种,2016年鲽鱼养殖产量达到了13 380 t,是所有海水鱼中养殖增量最大的鱼种,比2015年增加了55.26%[2]。鲽鱼骨是冻鲽鱼片加工过程中产生的主要下脚料,产量很大。由于缺乏相应的精深加工技术,鱼骨等下脚料常被丢弃或者低价卖给鱼粉厂,简单做成鱼粉、肥料和饲料等低附加值产品,不仅造成了严重的资源浪费和环境污染,同时也大大影响了企业效益。开发经济、实用的鱼骨加工技术及产品成为众多水产加工企业的迫切需求。
鱼骨中含有大量钙质,目前对鱼骨的加工利用研究主要集中在通过酶解、螯合工艺制备胶原多肽螯合钙[3];通过碱醇法制备成钙片[4];采用高压蒸煮、酶解、复配等工艺开发鱼骨膏体调味料、鱼骨酥、鱼骨粉等产品[5]。而利用超微粉碎技术将鱼骨制成超微细鱼骨泥,并将其添加到鱼糜制品中开发高钙鱼糜制品的研究仍鲜见报道,尤其是添加鱼骨泥对鱼糜凝胶品质影响的研究尚不多见[6]。鱼糜制品是一类低脂肪、高蛋白、低胆固醇的营养健康食品,深受消费者喜爱,近年来发展迅速、需求量快速增长,在世界各国都有着广阔的市场。将鱼骨泥与鱼糜制品结合开发高钙系列鱼糜制品,不仅能提高鱼骨的利用率和附加值,同时可丰富鱼糜制品品种。本实验通过研究添加微细鱼骨泥对鱼糜制品凝胶强度、质构、色泽、微观结构等品质的影响,为高钙鱼糜制品的开发和鱼骨高值化利用提供依据和支撑。
1 材料与方法
1.1 材料与试剂
鲽鱼骨 大连天宝绿色食品股份有限公司;金线鱼鱼糜 青岛锦灿食品有限公司。
磷酸氢二钠、磷酸二氢钾、五水硫酸铜、氢氧化钠、三羟甲基氨基甲烷(tris(hydroxymethyl)aminomethane,Tris)(分析纯) 国药集团化学试剂有限公司;蛋白分子质量Marker 大连宝生生物工程公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)所用试剂 上海生物工程有限公司。
1.2 仪器与设备
RRH-A250型高速万能粉碎机 上海缘沃工贸有限公司;JMS-50型胶体磨 河北廊坊祥通机械有限公司;QDGX型高精密湿法超微粉碎机 无锡轻大食品装备有限公司;SQ2119B型多功能食品加工机 上海帅佳电子科技有限公司;DELTA 320型pH计、PL602-L型电子天平梅特勒-托利多仪器(上海)有限公司;HH.6型数显恒温水浴锅 国华电器有限公司;UV-2100型紫外-可见分光光度计 日本岛津公司;Milli.Q型超纯水机密理博中国有限公司;Forma 702型-80 ℃超低温冰箱、Biofuge Stratos台式高速离心机 美国Thermo Fisher公司;T25 basic型高速分散均质机 德国IKA公司;3CELL型Mini Tetra电泳槽 美国Bio-Rad公司;CR-400型色彩色差计、S4800场发射扫描电子显微镜(scanning electron microscope,SEM) 日本KONICA MINOLTA公司;TA.XT plus质构仪 英国Stable Micro Systems公司。
1.3 方法
1.3.1 制备微细骨泥的工艺流程
鲽鱼骨→清洗、切块→冷冻→粗粉碎(万能粉碎机)→强力骨泥机→细粉碎(胶体磨)→湿法超微粉碎(高精密湿法超微粉碎机)→离心脱水→微细骨泥。
骨泥粒径采用流水过筛法进行测定。由于骨泥中含有鱼肉,易吸水膨胀,因此在过筛前取一定量的骨泥用质量分数5% SDS溶液搅拌1 h后5 000 r/min离心10 min,取下层沉淀,将其置于相应的泰勒筛上用流水冲洗,当物料通过率大于95%时即判定为骨泥粒径。本实验用骨泥粒径为100 目。
1.3.2 鱼糜凝胶的制备
取500 g冷冻鱼糜室温下半解冻后切块,置于斩拌机斩拌2 min,再加入质量分数2%食盐擂溃3 min,最后分别加入质量分数为2.5%、5.0%、7.5%、10.0%、12.5%骨泥(本实验中添加骨泥质量分数均以冷冻鱼糜的质量为基准)并调节水分质量分数为80%,继续斩拌2 min;整个过程温度严格控制在10 ℃以下。斩拌结束后将物料填至25 mm的肠衣中成型,灌肠后采用二段式加热法(40 ℃、30 min,90 ℃、5 min)进行凝胶化和熟化定型,加热结束后取出置于冰水中冷却10 min,放入4 ℃冰箱静置过夜,待测。
1.3.3 鱼糜溶胶pH值测定
取1.3.2节经斩拌的鱼糜溶胶,参考GB 5009.237—2016《食品安全国家标准 食品pH值的测定》[7]方法进行pH值测定。
1.3.4 溶胶中肌原纤维蛋白Ca2+-ATP酶活力测定
参考陆海霞[8]、Riebory[9]等方法略作修改,测定鱼糜溶胶中肌原纤维蛋白Ca2+-ATP酶活力。具体方法如下:鱼糜溶胶与Tris-HCl缓冲液(0.6 mol/L KCl、0.02 mol/L Tris-HCl,pH 7)以1:10(m/m)充分匀浆,于4 ℃下浸提1 h,然后在4 ℃、10 000 r/min下离心10 min,所得上清液为肌原纤维蛋白溶液。采用双缩脲法在波长540 nm处测定吸光度,并换算为蛋白质量浓度。
取0.5 mL肌原纤维蛋白溶液(质量浓度为3.0 mg/mL),与0.25 mL 20 mmol/L ATP溶液、0.25 mL 0.5 mol/L Tris-HCl溶液(pH 7)、0.5 mL 1 mol/L KCl溶液、3.5 mL去离子水混合,在25 ℃反应10 min,加入1.0 mL质量分数10%三氯乙酸(trichloroacetic acid,TCA)终止反应,空白溶液在加入ATP溶液前加入TCA。采用3 500×g离心5 min去除沉淀,取2.0 mL上清液加入8 mL显色液,于25 mL容量瓶定容。采用钼蓝比色法测定反应中释放的无机磷含量。
1.3.5 凝胶强度的测定
将凝胶切成25 mm×20 mm(直径×高度)的圆柱体,用TA.XT plus质构仪的球形探头P/0.5S进行穿刺实验,下压速率设定为1 mm/s,下压高度为10 mm,下压力为5 g。破断力定义为穿刺曲线上出现的第一个峰;凹陷深度定义为与破断强度相对应的破断距离;凝胶强度定义为破断强度与凹陷深度的乘积。
1.3.6 凝胶质构的测定
样品前处理同1.3.5节方法,使用的探头更换为P/50柱形探头。测定参数:测试速率恒定为1 mm/s,压缩形变为30%,下压力为5 g,得到样品的硬度、弹性、黏聚性、咀嚼性等指标。
1.3.7 凝胶色泽的测定
采用CR-400色彩色差计对样品的色泽进行测定,将样品切成25 mm×20 mm的圆柱形块,仪器用标准白板、黑板分别校正后,在室温下分别测定样品的上、下、左、右、中5 个区域,得到凝胶样品的L*、a*、b*值,其中L*值表示亮度,a*值表示红绿色,b*值表示黄蓝色,通过公式(1)计算白度值。

1.3.8 凝胶持水性的测定
采用高速离心法测定凝胶的持水性。将样品切成10 mm×10 mm小块称质量,计为m;用两层滤纸包裹样品块,置于50 mL离心管中,10 000 r/min离心10 min后取出,质量记为m1。持水性按公式(2)计算。
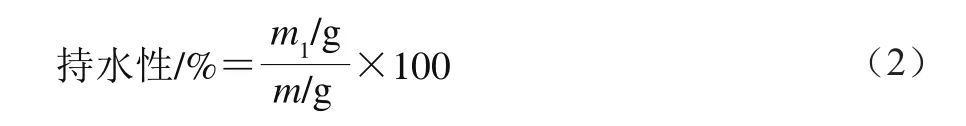
1.3.9 凝胶溶解度的测定
参照Benjakul等[10]的方法略作修改。称取鱼糜凝胶1 g,切碎后加入20 mL 0.02 mol/L的Tris-HCl缓冲液(含8 mol/L尿素、10 g/L SDS、体积分数2% β-巯基乙醇,pH 8.0),用高速分散器匀浆4 min,沸水浴2 min,冷却至室温后搅拌30 min,在10 000 r/min条件下离心10 min。吸取上清液10 mL并添加2.5 mL 0.5 g/mL TCA,在4 ℃条件下静置18 h,在10 000 r/min离心30 min,沉淀物用3 倍体积0.1 g/mL TCA冷溶液洗涤,待沉淀干燥后溶解于30 mL 0.5 mol/L NaOH溶液中。鱼糜凝胶直接溶解于30 mL 0.5 mol/L NaOH溶液中,采用双缩脲法测定蛋白质量浓度,测得的蛋白质量浓度为总蛋白质量浓度,溶解于混合剂中的蛋白质量浓度与总蛋白质量浓度的比值即为凝胶溶解度。
1.3.10 SDS-PAGE分析
参考Laemmli[11]和Xiong Youling L.[12]等的方法。称取鱼糜凝胶1 g,切碎后加入9 mL 5% SDS溶液,用高速分散均质机均质2 min,均匀混合后85 ℃水浴加热1 h使蛋白质充分溶出,冷却后将匀浆液在10 000 r/min条件下离心10 min,取上清液与样品缓冲液以体积比1∶1混合,沸水浴5 min。制胶后上样10 μL,其中浓缩胶质量分数为4%,分离胶质量分数为12%,在100 V恒压下进行实验。电泳完成后用质量分数0.1%考马斯亮蓝染色5~10 min,脱色至背景基本无色,使用Quantity One软件进行分析和处理。
1.3.11 凝胶SEM观察
将待测鱼糜凝胶切成小块,浸泡在体积分数2.5%戊二醛溶液中,在4 ℃下固定24 h,再用0.1 mol/L pH 7.2的磷酸盐缓冲液漂洗数次,然后用体积分数50%、70%、90%、100%乙醇溶液逐级脱水各10 min。使用冷冻干燥机干燥,经真空离子溅射仪喷金后,用SEM观察结构。
1.4 数据统计分析
采用SPSS 19.0和Origin 8.5软件对数据进行方差分析、显著性检验、相关性分析和因子分析,多重比较采用Duncan检验,P<0.05表示差异或相关性显著。
2 结果与分析
2.1 骨泥质量分数对鱼糜溶胶pH值的影响
研究表明,pH值是肌原纤维蛋白凝胶的重要影响因素,其影响途径主要有两方面:1)pH值对肌原纤维蛋白二级结构具有显著的影响。当pH值逐渐由肌原纤维蛋白等电点(约5.0~5.2)向中性范围接近时,蛋白质天然二级结构中α-螺旋的含量也越多,凝胶的微观结构、保水性及凝胶强度与其变化保持一致[13-14],但是β-折叠的含量呈现降低的趋势。2)pH值会直接影响到肌球蛋白ATP酶的活力。当pH值过低时,肌球蛋白ATP酶的某些活性基团发生不可逆转变化,影响肌球蛋白与肌动蛋白之间的结合能力,从而影响肉制品的凝胶强度[15-16]。另外,研究表明鱼糜凝胶制品的最适pH值为6.5~7.5之间的中性区域[17]。从图1可以看出,随着骨泥质量分数的增加,鱼糜溶胶pH值略有上升,可能与Ca2+含量增加和骨泥本身pH值有关,但均保持在pH6.8~7.0范围之间,能够满足鱼糜凝胶制品的适宜加工条件,说明鱼骨泥的添加不影响鱼糜凝胶形成的基本条件。

图1 骨泥质量分数对鱼糜溶胶pH值的影响Fig.1 Effect of fish bone paste addition on pH of surimi sol
2.2 骨泥质量分数对鱼糜溶胶中肌原纤维蛋白Ca2+-ATP酶活力的影响
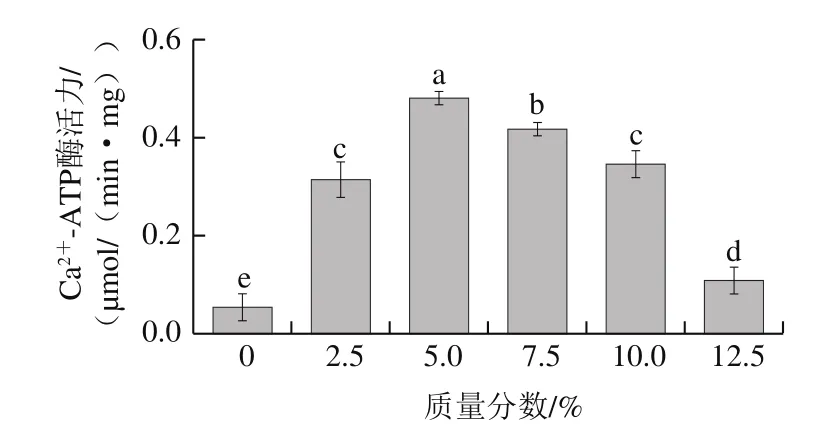
图2 骨泥质量分数对鱼糜溶胶中肌原纤维蛋白Ca2+-ATP酶活力的影响Fig.2 Effect of fish bone paste addition on Ca2+-ATPase activity of myofibril protein in surimi sol
ATP酶活力是肌球蛋白的最重要特性之一。肌球蛋白中的ATP酶可以分解ATP释放能量,并牵引与之相连的肌动蛋白产生一定的位移。鱼糜在加热处理后,肌球蛋白与肌动蛋白结合形成凝胶[18]。添加适量的Ca2+可以保持肌球蛋白ATP酶的稳定性并提高其活力,从而使其与肌动蛋白结合,形成致密、有序的三维网状结构。由图2可知,Ca2+-ATP酶活力随着骨泥质量分数的增加呈现先增加后降低的趋势(P<0.05)。当骨泥质量分数为5.0%时,相应的Ca2+-ATP酶活力达到最高值0.481 μmol/(min·mg),与对照组相比提高了7.9 倍。而随着骨泥的进一步添加,Ca2+-ATP酶活力急剧下降,最终达到0.108 μmol/(min·mg),与对照组相比仅提高了1 倍。当骨泥质量分数低于5.0%时,Ca2+可以与ATP酶有效结合,激活ATP酶,促进肌球蛋白与肌动蛋白结合;但当骨泥质量分数大于5.0%时,Ca2+含量急剧增加,导致蛋白质-钙-蛋白质结构的形成,Ca2+不能有效激活ATP酶,最后造成了Ca2+-ATP酶活力随着骨泥质量分数的增加呈现先增加后降低的趋势[19]。
2.3 骨泥质量分数对鱼糜凝胶强度的影响

图3 骨泥质量分数对鱼糜凝胶强度的影响Fig.3 Effect of fish bone paste addition on the strength of surimi gel
由图3可知,随着骨泥质量分数的增加,鱼糜凝胶强度呈现先升高后降低的趋势。在骨泥质量分数为5.0%时,凝胶强度达到最大值,约为对照组的1.7 倍。当添加的骨泥质量分数大于5.0%时,鱼糜凝胶强度呈现急剧下降趋势(P<0.05),骨泥质量分数为12.5%时凝胶强度小于对照组。分析其主要原因可能为:一方面是随着骨泥质量分数的增加,Ca2+-ATP酶活力下降,肌球蛋白与肌动蛋白不能有效结合,导致凝胶形成能力下降;另一方面是低浓度Ca2+激活鱼糜中内源性谷氨酰胺转氨酶(transglutaminase,TGase),促进肌原纤维蛋白交联,而高浓度Ca2+会抑制TGase活力、影响交联,进而使凝胶强度降低[20]。这与Hemung[21]和叶川[19]等的研究结果基本一致。
2.4 骨泥质量分数对鱼糜凝胶质构的影响

表1 骨泥质量分数对鱼糜凝胶质构的影响Table1 Effect of fish bone paste addition on texture properties of surimi gel
由表1可知,除硬度、胶着度、咀嚼度3 种指标外,其他指标均无显著差异(P>0.05)。对于硬度、胶着度、咀嚼度这3 个指标而言,其变化趋势与凝胶强度基本一致,都呈现先增强后降低的现象。当骨泥质量分数为5.0%时,鱼糜凝胶硬度与对照组相比提高了约31%,而胶着度、咀嚼度两项指标与对照组相比分别提高了约26%和24%。当骨泥质量分数超过5.0%时,硬度、胶着度、咀嚼度数值急剧下降,口感变差。
2.5 骨泥质量分数对鱼糜凝胶色泽的影响
关于鱼糜凝胶色泽变化的原因鲜有报道,除了鱼糜及辅料添加带来的凝胶色泽变化外,有学者认为水的添加能提高L*值、降低b*值,而a*值与水分含量没有显著的关系[22]。另外,不同温度下所测的亮度也有所不同,凝胶在25 ℃下比5 ℃下的亮度要高[23]。此外有学者发现,经过超高压处理比加热处理的凝胶结构更为致密,相应的鱼糜凝胶的亮度与白度较高[24-25]。由表2可知,对于L*值来说,骨泥的添加可以显著提高鱼糜凝胶的亮度(P<0.05)。但是骨泥质量分数为2.5%时,鱼糜凝胶的亮度与对照组相比会出现下降的情况。这可能是由于添加的骨泥与鱼糜中蛋白质之间争夺水分,使凝胶表面水分减少,亮度下降[6]。而加入质量分数5.0%的骨泥形成的凝胶结构较2.5%时更加致密,亮度会有所提高。继续添加骨泥会导致鱼糜凝胶结构松散,形成较大的孔洞,其内部的水分更容易溢出至表面,从而使得鱼糜凝胶在短时间内亮度提高。而色彩指数a*值仅在骨泥质量分数大于10.0%时发生明显的变化。当骨泥质量分数为5.0%时,其鱼糜凝胶色彩指数b*值最小,但随着骨泥质量分数的增加,b*值缓慢提高。与对照组相比,适量地添加骨泥对鱼糜凝胶制品在色泽上并没有负面影响,可以满足消费者的感官需求。

表2 骨泥质量分数对鱼糜凝胶色泽的影响Table2 Effect of fish bone paste addition on color of surimi gel
2.6 骨泥质量分数对鱼糜凝胶持水性的影响
水分作为鱼糜制品中含量最高的化学组分,其含量、分布状态及稳定性关系到产品的食用品质(色泽、嫩度、多汁性、风味等)和货架期,所以良好的凝胶持水性不仅能够降低企业生产的成本,提高产品出品率,还可以保留更多的风味物质,因此凝胶持水性是鱼糜凝胶制品的一项重要指标[26]。如图4所示,随着骨泥质量分数的增加,凝胶持水性呈先上升后下降的趋势,与鱼糜的凝胶强度变化趋势基本一致。当骨泥质量分数达到5.0%时,鱼糜凝胶的持水性达到最大值,与对照组相比提高了约5%(P<0.05)。但继续添加骨泥后,凝胶持水性显著下降(P<0.05);添加质量分数10.0%的骨泥时,鱼糜凝胶的持水性较对照组降低了约4%。研究表明,凝胶持水性主要与凝胶结构密切相关。结合本研究中鱼糜凝胶SEM微观结构观察结果可知,当骨泥质量分数达到5.0%时,鱼糜凝胶形成的三维网状结构较为致密,可以包埋更多的水分子,凝胶持水性较好。当进一步添加骨泥后,凝胶结构较为松散。出现这样的原因可能是骨泥添加过多时,相应的鱼糜中Ca2+含量增加,影响蛋白质之间紧密、有序的交联;当骨泥质量分数逐渐提高时,大量的骨泥颗粒也随之加入到鱼糜中,阻碍了蛋白质之间的交联,从而使形成的凝胶结构较为松散,导致凝胶持水性显著降低[27]。
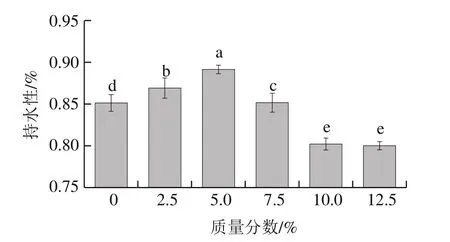
图4 骨泥质量分数对鱼糜凝胶持水性的影响Fig.4 Effect of fish bone paste addition on water-holding capacity of surimi gel
2.7 骨泥质量分数对鱼糜凝胶溶解度的影响
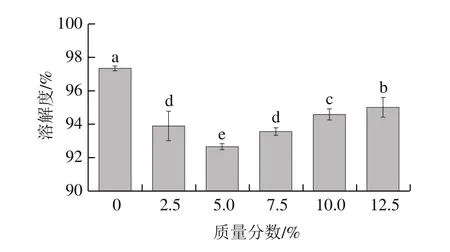
图5 骨泥质量分数对鱼糜凝胶溶解度的影响Fig.5 Effect of fish bone paste addition on solubility of surimi gel
Tris-HCl混合溶液(含有尿素、β-巯基乙醇和SDS)可以破坏鱼糜凝胶网络中除了非二硫共价键(主要为ε-(γ-葡萄糖)-赖氨酸(ε-(γ-Glu)-Lys)共价键)以外的所有共价键,由此测得的凝胶溶解度可以反映出ε-(γ-Glu)-Lys共价键含量的高低[28]。ε-(γ-Glu)-Lys共价键的存在赋予了鱼糜凝胶较高的硬度和弹性。由图5可以看出,随骨泥质量分数的增加,鱼糜凝胶的溶解度呈现先减少后增加的显著变化趋势(P<0.05)。当骨泥质量分数为5.0%时,鱼糜凝胶的溶解度出现最小值,约92%,较对照组的溶解度降低了约5%。但进一步添加骨泥后,鱼糜凝胶溶解度呈现显著上升趋势(P<0.05),骨泥质量分数增至12.5%时,其凝胶溶解度较对照组只降低了约2%。研究表明,Ca2+浓度对TGase活力具有显著的影响[29],即低浓度Ca2+激活内源性TGase,催化肌球蛋白重链(myosin heavy chain,MHC)交联,有利于鱼糜中ε-(γ-Glu)-Lys共价键的形成,而高浓度Ca2+却抑制了TGase的活力,使得鱼糜凝胶溶解度增加[30-33]。
2.8 骨泥质量分数对鱼糜凝胶蛋白组成的影响
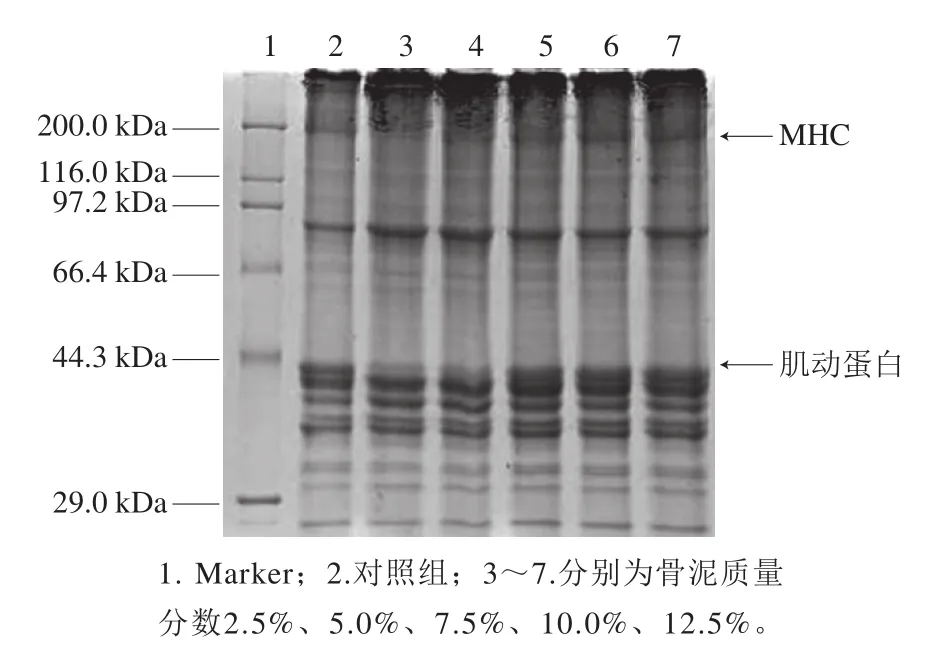
图6 不同骨泥质量分数的鱼糜凝胶蛋白SDS-PAGE图谱Fig.6 SDS-PAGE patterns of proteins in surimi gel with different amounts of fish bone paste
从图6可知,凝胶中MHC条带窄疏,这是因为肌球蛋白是形成鱼糜凝胶的主要蛋白质,在凝胶中大部分肌球蛋白发生交联形成较大的聚集体,密集分布在分离胶的顶端。同时,与对照组相比,添加质量分数2.5%~5.0%鱼骨泥的鱼糜凝胶中几乎看不到MHC条带,说明MHC发生了充分地交联,添加质量分数2.5%~5.0%鱼骨泥促进了MHC的交联。添加高质量分数鱼骨泥后,MHC条带又逐渐变得清晰,说明添加过量鱼骨泥会影响MHC的交联。造成这种现象的原因可能与鱼骨泥中的Ca2+对鱼糜中内源性TGase激活和抑制有关[27,29]。
2.9 骨泥质量分数对鱼糜凝胶微观结构的影响

图7 不同骨泥质量分数的鱼糜凝胶SEM图Fig.7 SEM of surimi gels with different amounts of fish bone paste
从图7中可以比较清楚地看到,随着骨泥质量分数的增加,凝胶网状结构呈现先致密后稀松的变化趋势。当骨泥质量分数不大于5.0%时,实验组的凝胶网状结构明显比对照组致密且分布均匀,这与陈海华等[34]用钙盐溶液漂洗提高竹荚鱼鱼糜凝胶强度的结果相似。但当骨泥质量分数超过5.0%后,鱼糜凝胶表面不平整,内部出现较多的空洞,呈杂乱状,三维网状结构松散不均匀。骨泥质量分数为5.0%的鱼糜凝胶表面平整,蛋白质之间相互交联,形成致密均匀的网状结构,优于对照组及其他实验组。该结果与上述鱼糜溶胶中Ca2+-ATP酶活力、凝胶强度、凝胶持水性等结果具有较高一致性,同时印证了上述分析。
3 结 论
向鱼糜中添加2.5%~12.5%微细鱼骨泥不影响鱼糜正常凝胶的pH值。骨泥质量分数较低(不超过5.0%)时,鱼骨泥中的Ca2+可以激活鱼糜溶胶中肌原纤维蛋白的ATP酶,能显著提升Ca2+-ATP酶活力;质量分数较高时使Ca2+-ATP酶活力降低。鱼糜凝胶的凝胶强度、质构、持水性、色泽等指标均在添加质量分数5.0%鱼骨泥时达到最高值,而凝胶溶解度在添加5.0%鱼骨泥时达到最低值,说明添加质量分数5.0%鱼骨泥能促进鱼糜凝胶形成较多的ε-(γ-Glu)-Lys共价键和较为牢固的凝胶结构。SDS-PAGE结果显示,添加质量分数2.5%~5.0%鱼骨泥在一定程度上促进了MHC的交联。SEM观察结果显示,添加质量分数2.5%~5.0%鱼骨泥可以促进鱼糜凝胶形成致密均匀的网状结构,过量添加则会破坏凝胶网络。综上,添加一定量的鱼骨泥(质量分数不超过5.0%)能够促进鱼糜形成较好的凝胶结构而不会影响鱼糜凝胶品质。进一步研究可以考虑如何在不影响鱼糜制品品质的条件下提高骨泥质量分数,以进一步提高鱼骨的利用率和产品附加值。

