东京野茉莉种子休眠特性的研究
赵 婕 ,张子晗 ,侯秋彦 ,喻方圆
(1.南京林业大学 a.林学院;b.南方现代林业协同创新中心,江苏 南京 210037;2.南京创新教育信息咨询有限公司,江苏 南京 210028)
东京野茉莉Styrax tonkinensis (Pierre) Craib ex Hartwich,又名越南安息香、白花树等,为野茉莉科野茉莉属的落叶乔木。其模式植物采自越南[1],在境外主要分布于老挝和越南北部次生雨林[2];其国内种源大都见于长江流域以南各省海拔100~2 000 m的疏林中或林缘,在重庆、浙江[3]和江苏等省也有引种记录。
东京野茉莉具有良好的适应能力,能耐一定程度的干旱和贫瘠,具有很强的萌芽更新能力[4],且其木质细致、均匀、洁白,是理想的工艺、胶合板和纸浆材[5]。国内外学者对其木材脆性[6]、木纤维特征[7]等做了研究,并在其木材综合利用研究方面取得一定进展[8]。种子含油率达50%以上[9-11],是生物柴油潜在的原料;其种子营养成分高,油酸和亚油酸含量占种子油总量的80.76%~85.62%[12],其中人体必需氨基酸组分比例均符合FAO/WHO的推荐模式,可以基本满足各年龄层的营养需求[9];其花序白色成串,幽香,且树形挺拔,具观赏价值。该树种集材用、食用、油料、观赏等于一身,具有很大的发展潜力。
东京野茉莉主要采用播种繁殖,但由于其种子具有休眠习性,处理不当则会导致大田出苗率低。目前国内外对东京野茉莉种子休眠特性的研究很少。有报道显示,低温沙藏能打破东京野茉莉种子休眠[13],但其并未探讨种子休眠机理,且播种60 d后其发芽率不到20%;许晓岗等[14]发现经过500 mg/L GA324 h浸种和沙藏的复合处理,江西吉安东京野茉莉种子发芽率能达59.4%,并认为种被阻力和种内发芽抑制物质是导致其休眠的主要原因。
本研究以东京野茉莉种子为材料,研究其休眠机制,探索休眠解除方法,旨在为播种育苗提供理论依据和实践基础。同时,也期望为其它同类型林木种子的休眠解除研究提供经验和借鉴。
1 材料与方法
1.1 试验材料
东京野茉莉每果1~2粒种子,种被质硬(下文称种壳),锈褐色,具胚乳,于2012年10月采自浙江省遂昌县,存于0~4 ℃冷库。种子千粒重为116.306 g。
1.2 试验方法
1.2.1 种子预处理设计和发芽试验
对采回的东京野茉莉新鲜种子进行下列预处理:1)层积处理(CS,cold stratification):在0~4℃低温库中层积120 d,每15 d取样,每周搅拌1次,下同;2)层积后机械处理(CSSCR,cold stratification+ seed coat remove):在层积处理取样后除去种壳;3)层积后赤霉素浸 种(CS-GA3,cold stratification+gibberellin soaking):在0~4 ℃冷库中层积后取样,以赤霉素浸种5 d。层积时间(0、15、30、45、60 d)和激素质量浓度(1 000、1 200、1 400 mg/L)2因素交互作用。种子预处理后,按林木种子检验规程(GB2772-1999)进行沙床发芽试验。培养箱光照周期16 h/8 h,温度25℃,湿度70%~75%,30 d后统计发芽率。
1.2.2 种子透水性的测定
随机数取层积0、60 d东京野茉莉种子各两份,每份30粒,重复3次;一份去壳,另一份不作处理,称质量后放入烧杯并加20 mL去离子水;于25℃恒温光照培养箱中放置,定期取出(前48 h白天每3 h、夜间每12 h测定1次;之后白天每6 h、夜间每12 h测定1次);拭干种子表面水分后测定种子质量,直至其不再变化为止。测定种子吸水率。
1.2.3 离体胚培养
随机取未层积东京野茉莉种子各4组,每组10 粒,重复3次,去壳,在蒸馏水中浸泡24 h后分别进行4种处理:1)将胚乳完全剥离,取出胚;2)剥除部分胚乳,露出1/3子叶;3)剥除部分胚乳,露出1/3胚根;4)保留完整的胚乳。将上述材料分别置于铺有两层洁净滤纸的培养皿中,用去离子水浸湿后置于25 ℃恒温培养箱内光照培养,并观察各组萌发情况。
1.2.4 内源性物质提取及白菜籽发芽的测定
随机取未层积新鲜种子的种壳和胚乳各5 g,以少量去离子水研磨后倒入烧杯;用80%的甲醇溶液于4℃冰箱中浸提72 h(期间不时振荡烧杯以充分提取),抽滤,重复2次;混合滤液后在50℃恒温箱内浓缩蒸干,用去离子水定容至50 mL。将定容后的浸提液稀释为25%、50%、75%、100% 4个浓度,分别浸泡白菜籽并以同体积去离子水为对照,设3次重复,在25℃恒温光照箱中培养;48 h后测定发芽率(以白菜籽种皮脱落为标准)。所用白菜籽为南京市蔬菜科学研究所售“早熟五号”白菜籽,发芽率≥85%,含水量≤7%,净度≥96%
1.2.5 层积过程中种子生化指标的测定
自第1天始,每隔15 d取层积处理后种子(直到120 d层积结束),去壳,测定其生理生化指标。采用蒽酮比色[15]测定可溶性糖和淀粉含量;采用考马斯亮蓝染色法[15]测定可溶性蛋白含量;采用3,5-二硝基水杨酸法[15]测定淀粉酶活性;采用愈创木酚比色法[15]测定过氧化物酶活性。所有测定重复3次。
1.3 数据处理
应用Excel 2003和SPSS 18.0对数据进行分析和处理,对CS-GA3进行2因素方差分析,对其它数据进行单因素方差分析和Duncan多重比较(α=0.05)。为使数据在分析前达到方差齐性,对发芽率数据采用平方根反正弦变换处理。
2 结果与分析
2.1 层积处理对东京野茉莉种子透水性的影响
图1为东京野茉莉种子的吸水率变化曲线。在前24 h内,种子迅速吸水,之后速度减慢,趋于稳定。未层积的完整种子吸水率最终达到19.16%,而经60 d层积后其吸水率达到28.11%;层积60 d后,去壳种子的吸水能力与层积前相比增加了49.58%。由此可知:种壳明显阻碍种子的吸水速度;同时,层积过程中东京野茉莉去壳种子获得了更强的吸水能力。
2.2 种壳阻碍对东京野茉莉种子萌发的影响
整体来说,层积处理后东京野茉莉发芽率呈上升趋势(见图2)。方差分析表明,层积时间对其萌发率产生显著影响(P<0.01),说明低温沙藏可以打破东京野茉莉种子的休眠。完整种子发芽率虽有所提高,但最高发芽率仍低于10%(见图2A),而种子经机械处理后,最大发芽率可达47%(见图2B),说明种壳的机械阻碍是东京野茉莉种子休眠的主要原因之一。

图1 层积中东京野茉莉完整种子(A)和去壳种子(B)的吸水率Fig.1 Water permeability of intact (A) and coat-removed (B) S.tonkinensis seeds

图2 东京野茉莉完整种子(A)和去壳种子(B)的层积后萌发率Fig.2 Germination rate of intact (A) and coat-removed (B) S.tonkinensis seeds after stratification
2.3 胚乳阻碍对东京野茉莉种胚萌发的影响
具有完整胚乳的未层积种子在培养过程中陆续发霉腐烂;而露出1/3子叶和1/3胚根的部位在前期能够部分变绿或膨大,但后期均停止生长,不断霉烂,种胚无法正常萌发;离体胚培养良好,两周后子叶均可伸长变绿,萌发率为100%。可见,东京野茉莉种子的种胚并不具有休眠特性。除种壳外,胚乳可能也是影响种子休眠的原因之一。
2.4 种子浸提液对白菜籽萌发率的影响
不同处理下,白菜籽萌发率均大于95%。方差分析显示,白菜籽发芽率并未发生显著变化(P>0.05)。由此推断,种子种壳、胚乳浸提液中不含抑制种子萌发的物质。
2.5 层积过程中东京野茉莉种子生理指标的变化
随着层积时间的延长,东京野茉莉去壳种子中可溶性糖含量呈现出先上升后下降的趋势;层积60 d时可溶性糖的含量达到最大值,为40.76 mg/g,随后下降并保持在30~35 mg/g范围内(见图3A)。而淀粉含量则在层积45 d达到最大值,先于可溶性糖,并在随后迅速下降(见图3B)。东京野茉莉种子中可溶性蛋白含量随层积时间的延长,从146 mg/g逐渐减少至65 mg/g(见图3C)。在层积0~45 d内,种子淀粉酶活性大体呈现增加趋势(见图3D);层积45 d时淀粉酶活性达到最高值,为36.69 U·min-1g-1。从图3E可以看出,随着层积时间的延长,过氧化物酶(POD)的活性逐步增大,在层积105 d时达到最高值,为497.34 U·min-1g-1。
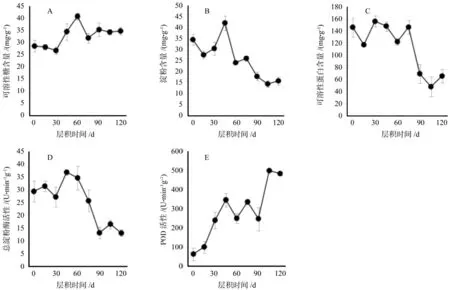
图3 层积过程中东京野茉莉去壳种子中可溶性糖、淀粉、蛋白含量及淀粉酶、POD活性Fig.3 Dynamics of soluble sugar, starch, soluble protein contents, amylase activity and POD activity in S.tonkinensis de-coated seeds in stratification process
2.6 东京野茉莉种子层积过程中的生理生化动态变化与发芽率的相关性
东京野茉莉种子萌发能力与胚(乳)内生理生化水平相关性较大。具体来看,可溶性糖含量和POD活性与种子发芽率呈正相关关系(见图4A、E)。其中,与去壳种子相关性显著,R值分别为0.885和0.658。而随着淀粉与可溶性糖等种内大分子贮藏物质含量以及淀粉酶活性的逐渐降低,完整和去壳种子的发芽率均有上升趋势(见图4B、C、D)。
2.7 赤霉素(GA3)对层积后种子发芽率的影响
方差分析表明,不同赤霉素质量浓度处理间(F=39.82,P<0.01)、不同层积时间处理间(F=18.90,P<0.01)以及GA3质量浓度和层积时间的交互效应(F=10.84,P<0.01)对种子发芽率的影响均达到极显著水平。1 000、1 200 mg/L GA3处理过的种子随着层积时间的延长,发芽率大体上呈现先升高后下降的趋势;而1 400 mg/L GA3处理的种子发芽率呈现逐渐下降的趋势。从GA3质量浓度来看,除层积60 d外,GA3质量浓度对种子休眠的解除效果均呈现先升高后下降的趋势。层积30 d后1 200 mg/L GA3处理的种子发芽率最高,为54%;层积30 d后1 000 mg/L GA3处理的种子发芽率次高,为42%(见图5)。
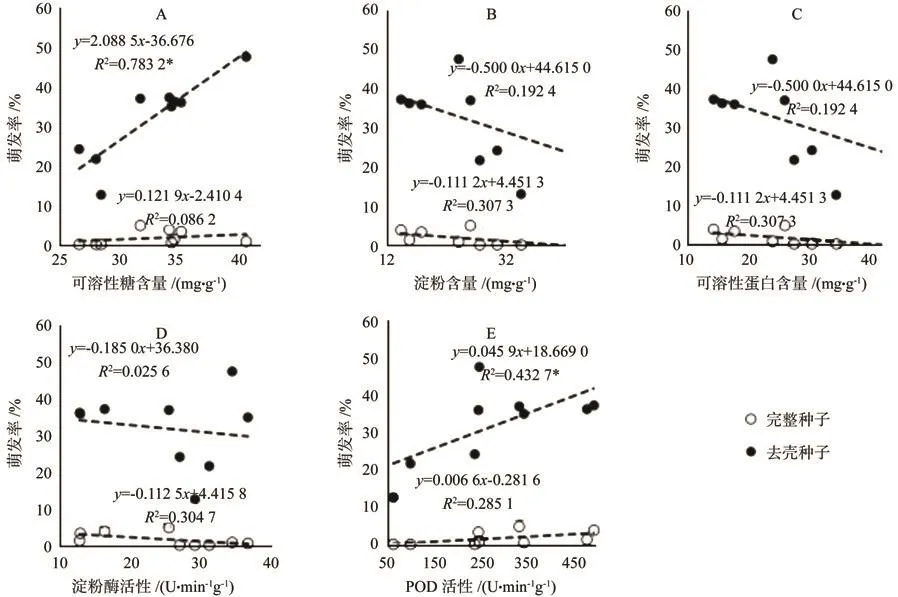
图4 层积过程中东京野茉莉完整和去壳种子萌发率和去壳种子中可溶性糖、淀粉、蛋白含量及淀粉酶、POD活性的相关性分析Fig.4 Correlations among benzoin seed germination and soluble sugar, starch, soluble protein contents,amylase activity and POD activity in stratification process
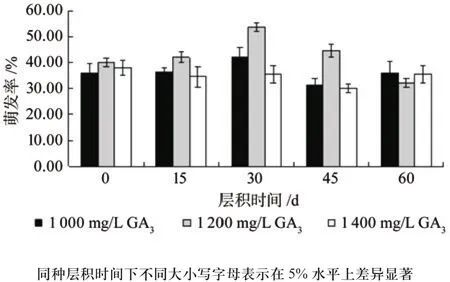
图5 层积后赤霉素处理对东京野茉莉种子萌发率的影响Fig.5 Effects of CS+GA3 treatments on S.tonkinensis seeds germination rates
3 结论与讨论
3.1 东京野茉莉种子特性
种胚引起的休眠可以分为形态的、生理的或两种同时存在。唐安军等人[16]发现当种子成熟时,地涌金莲Musella lasiocarpa的胚仍未发育完全,其种子的形态和生理后熟需通过半年的暖层积才能达到。本研究的离体胚萌发结果表明东京野茉莉种子种胚发育完全,不存在形态休眠;去除种壳和胚乳后能够萌发,说明胚内并不存在生理休眠。综上所述,种胚不存在休眠特性。
物理休眠主要由密封性过强的包覆组织引起。一些种子的种皮含蜡质、粘质或革质化,致使种子不透气不透水,或者对种胚的生长造成机械束缚[17]。对于茼蒿Glebionis coronaria来说,在坚硬的果皮中,仅基部存在“水通道”。“水通道”的大小则在一定程度上控制了茼蒿种子的休眠[18]。而另一类休眠则由种皮或胚乳的约束力导致。这类种子的种皮坚硬木质化或表面具有革质;胚乳体积较大且细胞结构致密,将种胚完全包裹;这些往往会引起限制胚根伸长的机械阻力。耿文娟等人[19]发现新疆野生欧洲李种子种皮透水性不良是引起种子休眠的原因之一。由透水性、CS和CS-SCR处理实验可知,层积60 d种子吸水率、发芽率与层积0 d种子相比均有所增加,但其发芽率均小于5%,远小于层积后机械处理种子47%的萌发率,由此可知种壳的透水性低虽是东京野茉莉种子休眠原因之一,但种壳的机械障碍在其中似乎占据更大的作用。Baskin和Baskin[20]将此类休眠归为非浅性生理休眠(Nondeep physiological dormancy),种被的移除能够促进这类种子的萌发[21-22]。
种子中内源抑制物的存在可能是导致休眠的原因之一,然而本研究内源性抑制物的提取及生物测定表明东京野茉莉种子胚乳和种壳中并不存在发芽抑制物质,不是导致种子休眠的原因。这与许晓岗等[14]的研究结果相反,认为其根本原因是抑制物提取方法的不同。大部分种子中的萌发抑制物质以酚类等居多,溶于有机溶剂。而许晓岗等[14]使用蒸馏水在室温条件下浸泡鲜种子样品长达48 h。首先,抑制物质并不会溶解于水相;其次,阻碍白菜籽发芽的可能是种子上的微生物(在较适宜的环境中)分解活细胞后产生部分有毒害作用的代谢产物,但具体原因还需要继续深入研究。由于离体胚试验发芽率为100%,所以抑制物提取试验无种胚本身的提取液试验。
3.2 综合处理解除休眠
由发芽实验可知,单纯层积处理效果不好,而经层积处理后再机械处理能打破种子休眠,种子发芽率大大提高。本研究中,层积+机械处理不光消除了种壳的机械阻力,胚乳中也产生一系列变化,导致种子在生理水平上达到休眠解除的条件。在非浅性生理休眠种子中,离体胚能够正常萌发,种子休眠源自于胚乳和(或)种壳[23],而激素水平的提高,例如GA3,是解除此类休眠的主要方法之一[24]。前人对休眠解除过程中胚乳做了大量的工作[25],在番茄Lycopersicon esculentum种子中,胚乳的根尖区域的降解需要GA3的参与,对于GA3缺乏的基因型,则需要外源GA3或者移除胚乳的处理才能使种子萌发[26]。Jacobsen等[27]认为参与胚外组织软化作用的GA3源于胚中,其作用于胚乳,使水解作用加强,胚乳细胞因此分散而被软化。然而似乎GA3并不是唯一解除胚外组织障碍的信号,在白云杉Picea glauca中,β-甘露聚糖酶活性的上升导致了其雌配子体的软化和胚根突破种壳,但这一变化并非由GA3诱导所致[28]。另外有研究表明,赤霉素和低温层积相结合能快速打破许多种子的休眠,效率更高[29]。在山桃种子中,低温层积的效果可以被GA3代替,而GA3处理和低温层积相结合,解除休眠的效果更优[30]。而袁雅琪等人[31]通过98% 的 H2SO4、400 mg/L 的 GA3、砂藏综合处理提高了漆树种子的萌发率。本研究中,外源GA3可以缩短东京野茉莉种子的层积时间,赤霉素+层积处理的最佳组合为1 200 mg/L GA3+30 d层积,发芽率为54%。
3.3 休眠解除过程与种子生理生化变化密切相关
种子中内含物质包括淀粉、可溶性糖和蛋白。这些物质在休眠解除的过程中进行代谢,为种子解除休眠提供所需要的能量[32]。研究种子的代谢过程有利于揭示种子的休眠机理。在层积0~60 d内,随着种子可溶性糖含量的上升,种子萌发率也逐渐升高,相关性达到极显著水平,暗示可溶性糖的积累对东京野茉莉种子休眠解除有重要作用。值得注意的是,即使种子内可溶性糖含量达到一定水平,种壳对种胚的束缚作用依然明显。
淀粉在淀粉酶作用下水解为单糖,为种子萌发储备可直接被利用的碳源。本研究中,东京野茉莉种子中淀粉含量在层积过程中呈下降趋势,在层积初始阶段,淀粉酶活性比较低,淀粉含量下降趋势缓慢;之后随着层积时间的延长,淀粉酶的活性加强,淀粉迅速水解,淀粉含量急剧下降。可溶性蛋白为种子萌发提供氮素营养,种胚分化生长与蛋白代谢紧密相关。本研究中,种子在层积过程中可溶性蛋白质含量下降,说明细胞的代谢越来越旺盛,为萌发作准备。整体看来,种胚内贮藏物质的动员,有利于种子萌发率的上升,即休眠的解除。洑香香等人[29]在四照花种子的休眠解除中也观察到类似结果。前人研究表明,过氧化物酶的活性随着种子休眠的解除而迅速增加[33]。东京野茉莉种子在层积过程中,POD活性也逐渐增强。Zhang等[34]认为,POD活性的升高同时关联吲哚乙酸氧化酶(IAAO)活性的降低,有助于细胞中生长素(IAA)的积累;同时,POD活性上升能够促进木质素、木栓层及羟脯氨酸糖蛋白(HRGP)的生物合成[35-37],加强细胞壁的稳定性。所以,种子休眠解除过程中POD活性升高,可能有助于细胞分裂、细胞体积增大以及新细胞壁形成等过程。不过,由于试验材料的局限性,未对种内ABA含量进行测定,需进一步探究。

