脊尾白虾2种血蓝蛋白大亚基变体的克隆及功能分析
窦全伟 李吉涛, 刘 萍, 李 健, 刘九美 孙东方 蔡 影 环朋朋
(1. 中国水产科学研究院黄海水产研究所, 农业部海洋渔业可持续发展重点实验室, 青岛 266071;2. 青岛海洋科学与技术国家实验室, 海洋渔业科学与食物产出过程功能实验室, 青岛 266235)
脊尾白虾(Exopalaemon carinicauda)是分布于中国大陆沿岸、朝鲜半岛西岸的浅海低盐水域的一种热温带海区中小型底栖虾类, 以黄、渤海产量最高, 是我国重要的经济虾类之一[1]。脊尾白虾具有广温性[2]、广盐性[3]、繁殖率高[4,5]等特点, 具有较高的经济价值, 是新兴的养殖虾类, 已成为沿海滩涂地区的主要特色水产养殖品种。
由细菌及病毒等微生物引起的疾病对虾类养殖造成严重的经济损失[6], 因此对虾类非特异性免疫防御机制的研究正在广泛开展。研究表明, 血蓝蛋白不但具有载氧功能, 还有储存能量、维持渗透压、调节蜕皮及固化表皮的功能[7]。此外, 大量研究证明甲壳动物血蓝蛋白也是免疫防御体系中的重要免疫因子, 血蓝蛋白及其降解片段还具有凝集活性、抗菌抗病毒活性、酚氧化物酶活性、抗肿瘤活性等多种免疫学功能, 被认为是一种具有重要免疫活性的多功能蛋白[8—11]。目前, 随着对甲壳动物血蓝蛋白功能的深入研究, 其基因cDNA序列已相继被克隆[12—14]。研究表明, 凡纳滨对虾(Litopenaeus vannamei)有2个血蓝蛋白亚基, 且哈维氏弧菌(Vibrio harveyi)感染后其mRNA表达量显著上调[15]。Tassanakajon等[16]研究发现斑节对虾(Penaeus monodon)血蓝蛋白五种不同亚型在序列及长度上存在差别, 且具有抗菌活性。郭玲玲等[17]以凡纳滨对虾为研究对象, 通过生物信息学方法分析发现凡纳滨对虾血蓝蛋白大亚基中存在HcLV1、HcLV2、HcLV3等多种变体, 并采用RACE (Rapid-amplification of cDNA ends)技术获得HcLV1、HcLV3的cDNA全长, 通过副溶血弧菌(Vibrio Parahemolyticus)、乙型链球菌(Streptococcus)及溶藻弧菌(Vibrio alginolyticus)等不同病原菌刺激对虾后, 血蓝蛋白大亚基变体对不同病原刺激发生明显的响应,且不同病原刺激后可致使不同变体协同作用。Xu等[18]研究发现凡纳滨对虾血蓝蛋白大亚基至少存在四种变体且均具有抗病毒活性, 提示血蓝蛋白具有分子多样性, 且在对虾抗病免疫防御中有重要作用。我们已经获得了脊尾白虾血蓝蛋白大亚基基因[19],并对其免疫功能进行了初步研究, 但其变体及其功能的研究尚未见报道。
本研究根据本实验室构建的脊尾白虾转录组文库, 筛选获得了2个血蓝蛋白变体序列, 采用RACE技术克隆了脊尾白虾血蓝蛋白大亚基变体基因的cDNA全长, 并分析了变体基因在金黄色葡萄球菌、副溶血弧菌及白斑综合征病毒(White spot syndrome virus, WSSV)感染后基因的相对表达变化, 对丰富脊尾白虾血蓝蛋白的分子多态性与功能多样性具有重要的意义。
1 材料与方法
1.1 材料
取体长(4.5±0.25) cm、体重(2.19±0.42) g的健康脊尾白虾暂养3d, 设置金黄色葡萄球菌感染组、副溶血弧菌感染组、WSSV感染组和对照组, 每组100尾, 设置3个平行, 分别进行感染实验。
1.2 菌悬液及WSSV粗提液的制备
配制LB肉汤和2216E(液体成分: 蛋白胨母膏,磷酸高铁; 固体成分加琼脂粉)液体及固体培养基,灭菌备用。将金黄色葡萄球菌(Stphylococcus aureus)和副溶血弧菌(Vibrio parahaemolyticus)菌种分别接种于LB肉汤和2216E固体培养基中, 分别在37℃和28℃培养过夜。选取单菌落接种于液体培养基中, 200 r/min摇床上培养8—10h, 最后将菌悬液离心, 弃上清液, 用生理盐水对菌体进行反复洗涤, 重悬后, 使菌体的浓度达108CFU/mL。
取感染WSSV的脊尾白虾病虾(本实验室保存)头尖组织5 g, 加入800 μL 4℃预冷的磷酸盐缓冲液(1×PBS), 4℃ 20000 r/min离心15min, 将获得的匀浆液于4℃ 3000 r/min离心15min, 取上清液反复离心3次(4000 r/min 15min、6000 r/min 15min、8000 r/min 15min), 将所得的上清液用0.45 μm滤膜过滤除菌,将除菌的粗提液稀释100倍(3.7×107copy/mL)进行分装并保存于-80℃冰箱中备用。
实验时将菌悬液、WSSV粗提液用微量注射器从脊尾白虾的第2腹节处注入(20 μL/尾)。对照组注射等量1×PBS缓冲液。在注射后的6h、12h、24h、48h和72h取样, 每个时间点各取5尾虾, 取血液、肝胰腺、鳃、肌肉等组织, 用于总RNA提取。
1.3 脊尾白虾总RNA提取及cDNA合成
使用TransZol Up Plus RNA Kit (北京全式金生物技术有限公司)提取脊尾白虾组织总RNA, 用核酸定量仪(Thermo, NanoDrop 2000)和1.0%琼脂糖凝胶电泳检测总RNA的质量及完整性。
cDNA合成体系(20 μL): 10 μL总RNA, 2 μL Oligo dT (50 μmol/L), 72℃水浴5min, 冰浴2min; 之后再向管中加入1.0 μL dNTP Mixture (each 10 mmol/L)、5×M-MLV Buffer 4.0 μL、0.5 μL RNase Inhibitor(40 μL/mL, TaKaRa)和1.0 μL M-MLV反转录酶(TaKaRa), 用DEPC水补足体积。42℃孵育lh; 72℃孵育15min; 4℃孵育20min。合成的cDNA用于后期脊尾白虾血蓝蛋白基因的克隆及Real-time PCR检测。脊尾白虾3′和5′RACE模板的合成根据SMARTTMRACE Amplification Kit9 (TaKaRa)说明书进行。
1.4 脊尾白虾血蓝蛋白大亚基变体基因cDNA中间片段克隆
根据本实验室脊尾白虾转录组库中获得的脊尾白虾血蓝蛋白大亚基变体基因EcHcL1和2序列设计引物HcL1-F/HcL1-R、HcL2-F/HcL2-R (上海生工生物工程有限公司合成)(表 1)。PCR反应体系(10 μL): 正反引物各0.4 μL, LA Mix 5 μL, cDNA模板0.2 μL, ddH2O 4 μL。根据引物退火温度设定反应程序。

表 1 本研究所用引物序列Tab. 1 Sequences of the primers used in this study
1.5 脊尾白虾血蓝蛋白大亚基变体基因cDNA 5′和3′末端的扩增
根据测序得到的中间片段序列设计5′ RACE引物(5HcL1和5HcL2)以及3′ RACE引物(3HcL1和3HcL2)(表 1)扩增脊尾白虾大亚基血蓝蛋白大亚基变体基因cDNA全长序列。按照SMARTTMcDNA Amplification Kit (Clontech)说明书推荐的反应体系及反应条件进行5′ RACE和3′ RACE扩增。
1.6 序列分析
将测序结果去载体后, 采用ContigExpress Application进行5′和3′端序列拼接, 用NCBI BLAST(http://blast.ncbi.nlm.gov/Blast.cgi)和SMART (http://smart.embl-heidelberg.de/)进行序列比对及结构域预测, 应用SignalP 4.0软件分析信号肽, 通过DNAMAN软件进行血蓝蛋白的氨基酸序列多序列比对,用MEGA 6.0软件[20]中的Neighbor-joining法[21]构建系统树。
1.7 脊尾白虾血蓝蛋白大亚基变体基因组织分布特征分析
根据脊尾白虾血蓝蛋白大亚基变体基因EcH-cL1和2基因设计正反向引物(QHcL1-F/QHcL1-R、QHcL2-F/QHcL2-R)(表 1), 用于Real-time PCR检测EcHcL1、2基因的组织分布情况。使用SYBR Premix ExTaqⅡ试剂(TaKaRa), Applied Biosystems 7500 Real Time PCR仪上进行, 反应体系为10 μL:5 μL SYBR Premix ExTaqⅡ、1 μL cDNA、0.4 μL正反向引物、0.2 μL ROX Reference dye Ⅱ及3 μL ddH2O。反应程序为95℃ 10min; 95℃ 30s, 95℃ 5s,60℃ 34s, 40个循环; 95℃ 15s; 60℃ 1min; 95℃15s。以β-actin基因作为内参基因, 样本和内参均设置3个平行, 采用2-ΔΔCt方法[22]计算EcHcL1和2基因的相对表达量, 利用SPSS17.0软件对结果进行单因素方差分析(One-way, ANOVA), 并对其显著性进行检验。
1.8 病原感染脊尾白虾后血蓝蛋白大亚基变体基因的表达分析
分别提取副溶血弧菌、金黄色葡萄球菌及WSSV感染后不同时间脊尾白虾的肝胰腺和血细胞组织的RNA, 按照前述方法逆转录合成cDNA进行Real-time PCR, 以β-actin作为内参, 样本和内参均设置3个平行, 检测细菌感染下的脊尾白虾血细胞和肝胰腺中EcHcL1和2基因在不同时间点的表达情况。反应体系、反应程序及数据处理同如1.6所述。
2 结果
2.1 脊尾白虾血蓝蛋白大亚基变体基因EcHcL1和2全长cDNA序列的克隆与分析
采用RACE方法和RT-PCR扩增获得脊尾白虾血蓝蛋白大亚基变体基因EcHcL1和2 cDNA全长(GenBank登录号: MH069500和MH 069501)。EcH-cL1序列全长2248 bp, 包括2058 bp的开放阅读框(ORF)、66 bp的5′ UTP和137 bp的3′ UTR; 编码685个氨基酸, 前21个氨基酸组成信号肽; 预测分子量为79.8 kD 。EcHcL2序列全长2121 bp (ORF:2031 bp), 10 bp的5′ UTP和80 bp的3′ UTR; 编码676个氨基酸, 前27个氨基酸组成信号肽; 预测分子量为78.3 kD, 理论等电点PI为5.56 。SMART软件分析表明, EcHcL1-2-3均含有3个结构域: Hemocyanin_N、Hemocyanin_M、Hemocyanin_C, 只是EcHcL1多了一个酪氨酸酶结构域(图 1)。Hemoeyanin-M结构域中的2个铜离子结合位点含6个保守的组氨酸残基。三维结构预测软件(https://swiss-model.expasy.org/)显示EcHcL1-2三维结构出现了差异(图 2): 在529—650 aa,EcHcL1以β-折叠为主,EcHcL2以无规则卷曲为主。

图 1 脊尾白虾EcHcL1和2血蓝蛋白结构域位置Fig. 1 The locations of three domains in EcHcL1 and 2 hemocyanin A. EcHcL1; B. EcHcL2

图 2 脊尾白虾EcHcL1和2血蓝蛋白三维结构预测Fig. 2 Three-dimensional structure of EcHcL1 and 2 A. EcHcL1; B. EcHcL2
2.2 脊尾白虾血蓝蛋白EcHcL1和2基因同源性分析
使用NCBI BLAST (http://blast.ncbi.nlm.nih.gov/Blast.cgi)对脊尾白虾EcHcL1和2基因编码的氨基酸序列与其他物种的血蓝蛋白氨基酸序列进行同源性比较, EcHcL1和2在氨基酸序列上与日本沼虾同源性最高达到84.08%, 与凡纳滨对虾、日本对虾(Marsupenaeus japonicus)以及斑节对虾(Penaeusmonodon)血蓝蛋白序列同源性分别为77.54%、76.66%和76.39%。
利用MEGA 6.0软件对脊尾白虾EcHcL1和2基因氨基酸序列进行系统进化分析, 并构建系统进化树(图 3)。结果显示在15个物种中, 脊尾白虾EcH-cL1和2与脊尾白虾EcHcL以及日本沼虾(Macrobrachium nipponense)为一支并与中国对虾(Fenneropenaeus chinensis)、日本对虾、凡纳滨对虾、斑节对虾等动物的血蓝蛋白为一个亚群; 与红鳌鳌虾(Cherax quadricarinatus)、珍宝蟹(Metacarcinus magister)、中华绒螯蟹(Eriocheir sinensis)、蓝蟹(Callinectes sapidus)、拟穴青蟹(Scylla paramamosain)为另一个亚群。EcHcL1和2在进化上与日本沼虾的亲缘关系最近, 与克氏原鳌虾(Procambarus clarkii)、鲸虱(Cyamus scammoni)、斑点海虱(Eurydice pulchra)、蛀木水虱(Limnoria quadripunctata)等动物的血蓝蛋白亲缘关系较远。
2.3 脊尾白虾血蓝蛋白EcHcL1和2基因组织表达分析

图 3 利用MEGA 4.0构建的基于EcHcL1和2基因氨基酸序列的NJ系统树Fig. 3 NJ tree about EcHcL1-2 amino acid sequences using MEGA 4.0
为了分析EcHcL1和2的组织表达特异性, 分别设计2种变体的特异性引物。以β-actin作为内参对照, 利用Real-time PCR检测脊尾白虾EcHcL1和2在血细胞、肝胰腺、肠、腹神经节、心脏、卵巢、眼柄、胃、鳃和肌肉组织中的表达量。结果如图 4显示,EcHcL1和2在脊尾白虾的10种组织中均有表达。EcHcL1在血细胞中表达最高, 肝胰腺次之, 而在肌肉中的表达量最低;EcHcL2在肝胰腺中表达最高, 而在肌肉和胃中的表达量最低。

图 4 EcHcL1和2在脊尾白虾不同组织里的相对表达量Fig. 4 The relative expression of EcHcL1 and 2 in different tissues in E. carinicauda
2.4 脊尾白虾血蓝蛋白EcHcL1和2基因在肝胰腺中的表达
如图 5、图 6所示, 脊尾白虾感染金黄色葡萄球菌、副溶血弧菌、WSSV后, 脊尾白虾肝胰腺中EcHcL1和2基因表现出一定的时间依赖性, 总体趋势表现为先升高后降低。EcHcL1表达量在金黄色葡萄球菌和WSSV感染后均在12h达到峰值, 与对照组有极显著差异(P<0.01), 到72h下降到与对照组无显著性差异(P>0.05);EcHcL1表达量在副溶血弧菌感染后在24h达到峰值, 与对照组差异极显著(P<0.01),24h后表达量持续下降,到72h下降到与对照组无显著性差异(P>0.05)。EcHcL2表达量在金黄色葡萄球菌感染后趋势不明显, 在48h达到峰值,与对照组有显著性差异(P<0.05), 到72h下降到与对照组无显著性差异(P>0.05); 在副溶血弧菌和WSSV感染后均在24h达到峰值, 与对照组差异极显著(P<0.01), 24h后表达量持续下降, 到72h下降到与对照组无显著性差异(P>0.05)。
2.5 脊尾白虾血蓝蛋白EcHcL1和2基因在血细胞中的表达分析

图 5 EcHcL1基因在脊尾白虾肝胰腺组织中的表达变化Fig. 5 Expression level of EcHcL1 in hepatopancreas of E. carinicauda
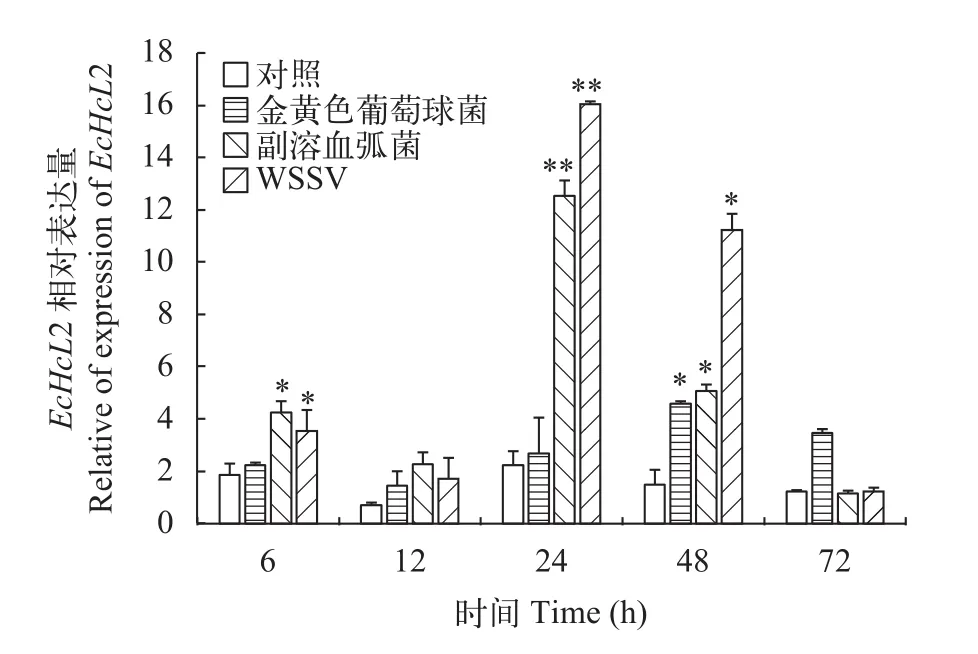
图 6 EcHcL2基因在脊尾白虾肝胰腺组织中的表达变化Fig. 6 Expression level of EcHcL2 in hepatopancreas of E. carinicauda

图 7 EcHcL1基因在脊尾白虾血细胞中的表达变化Fig. 7 Expression level of EcHcL1 in haemocytes of E. carinicauda

图 8 EcHcL2基因在脊尾白虾血细胞中的表达变化Fig. 8 Expression level of EcHcL2 in haemocytes of E. carinicauda
如图 7、图 8所示, 脊尾白虾感染金黄色葡萄球菌、副溶血弧菌、WSSV后, 脊尾白虾血细胞中EcHcL1和2基因表现出一定的时间依赖性, 总体趋势表现为先升高后降低。EcHcL1表达量在金黄色葡萄球菌感染后均在12h达到峰值且与对照组差异显著(P<0.05), 到72h下降到与对照组无显著性差异(P>0.05); 在副溶血弧菌和WSSV感染后均在48h达到峰值, 与对照组差异极显著(P<0.01), 到72h下降到与对照组无显著性差异(P>0.05)。EcHcL2表达量在金黄色葡萄球菌感染后趋势不明显; 在副溶血弧菌和WSSV感染后均在24h达到峰值, 且WSSV感染后表达量上升趋势明显大于副溶血弧菌感染后的表达量。
3 讨论
血蓝蛋白是甲壳动物血淋巴中的含铜呼吸蛋白, 它的基本生物学功能是载氧, 另外它还具有多种免疫活性, 例如酚氧化酶活性、抗病毒活性、凝集活性和抗菌活性等多种免疫功能[23—25]。为了深入研究脊尾白虾大亚基的分子特征, 我们采用RACE和生物信息学技术, 对脊尾白虾血蓝蛋白大亚基2种变体(EcHcL1和2)进行全长cDNA扩增和序列分析。我们发现EcHcL1和2与脊尾白虾血蓝蛋白大亚基EcHcL相似, 其分别编码680个左右的氨基酸。两者均具有血蓝蛋白的典型结构域, 包括铜离子结合区, 6个组氨酸位点和Ig-like区等, 其中EcHcL1多了一个酪氨酸酶结构域, 推测可能与色素代谢及酚氧化酶活性有关[23]。系统进化分析结果显示EcHcL与日本沼虾血蓝蛋白亲缘关系最近,疣酋妇蟹、中华绒螯蟹、斑点海虱等甲壳动物的血蓝蛋白亲缘关系次之。这说明脊尾白虾血蓝蛋白大亚基变体与大亚基具有相似的分子特征, 提示其变体可能与血蓝蛋白大亚基一样具有多种免疫学功能。组织表达分布结果显示EcHcL1和2在10种组织中均有表达, 且均在肝胰腺和血细胞中表达较高, 与凡纳滨对虾[26]的研究结果一致, 说明2种变体组织表达分布广泛且在均在与免疫发生的组织或器官中表达量较高, 推测2种变体可能在免疫应答中发挥了重要作用。
研究表明圆尾鲎(Carcinoscorpius rotundicauda)凝集素CL5可产生不同的亚型来识别细菌和真菌: 与细菌(金黄色葡萄球菌、大肠杆菌)相结合的CL5的电泳图谱大致相似, 而与真菌相结合的CL5的电泳图谱与细菌图谱比较出现较大的差异[27]。Destoumieux等[28]研究指出, 斑节对虾可产生5种不同的抗菌肽, 其中抗菌肽3不仅具有抗真菌活性, 还可以抑制大肠杆菌E. coli363和细菌滕黄微球菌(Micrococcus luteus)的生长。Woramongkolchai等[29]研究表明了斑节对虾感染WSSV后抗菌肽5的mRNA水平在24h后明显上调, 提示其可能具有抗病毒活性。
由上可知, 存在于甲壳动物中的多态性免疫分子, 其不同变体可能具有不同的免疫活性。由此推测脊尾白虾血蓝蛋白大亚基的不同变体也可能具有不同的免疫学功能。为此, 我们对脊尾白虾进行了病原胁迫实验, 进一步运用Real-time PCR策略对2种变体的mRNA表达情况进行了探讨。结果由图 5—8可知, 在3种病原菌胁迫下,EcHcL1在肝胰腺中表达量趋势为先上升达到峰值后下降到与对照组无显著性差异。EcHcL2表达量趋势为先上升再下降再上升达到峰值, 最后72h下降到正常水平。与Yang等[30]报道的鳗弧菌感染中国明对虾后不同时间点FcToll的表达变化情况相同。这样的表达变化模式可能是在病原胁迫的初期, 机体对于外界刺激, 做出最初的应激反应, 出现较弱的表达上升(如6h的表达上升), 此种变化在12h恢复至原始水平, 但是, 最初较弱的表达上升, 不足以抵御病原的刺激, 在24h出现第二次表达上调, 来加强对病原菌的免疫防御。当脊尾白虾受到金黄色葡萄球菌胁迫后, 在肝胰腺和血细胞中EcHcL1均在12h出现表达量最高的情况(约为对照组的2—3倍), 说明相对其他两种菌, EcHcL1对球菌做出较早的免疫反应(副溶血弧菌胁迫后,EcHcL1在肝胰腺和血细胞中分别在24h和48h达到峰值; 在WSSV感染后,EcH-cL1在肝胰腺和血细胞中分别在12h和48h达到峰值)。当副溶血弧菌胁迫和WSSV后, 在肝胰腺和血细胞中EcHcL2均在24h出现峰值(约为对照组的2—9倍), 相对于球菌,EcHcL2对弧菌和WSSV做出更明显的免疫反应(球菌胁迫后,EcHcL2在肝胰腺中48h达到峰值, 在血细胞中表达量没有明显上调趋势)。综上表明脊尾白虾血蓝蛋白大亚基变体与血蓝蛋白大亚基一样, 其mRNA表达变化与病原胁迫密切相关, 可能具有抗菌抗病活性, 且不同变体对不同病原的响应程度存在差异性, 提示可能不同的血蓝蛋白变体在对虾免疫防御中具有不同的最佳免疫学功能。
综上, 血蓝蛋白大亚基不同变体序列共同组成脊尾白虾特有血蓝蛋白超家族, 且这些变体具有相应的最佳免疫防御功能, 共同参与脊尾白虾的免疫防御, 对丰富脊尾白虾血蓝蛋白的分子多态性与功能多样性具有重要的意义。

