短期高温胁迫对大花四照花和日本四照花生长和光合的影响
鲁强 徐杰 洑香香

摘要:以1年生盆栽大花四照花(Cornus florida)和日本四照花(C. kousa)实生苗为试验材料,人工气候室内采用昼/夜温度分别为35/30、40/35 ℃持续处理27 d,以昼/夜温度30/25 ℃处理为对照(CK),测定分析这2种四照花的幼苗生长情况及胁迫处理0、2、8、13、19、27 d时叶片光合、叶绿素荧光参数。结果表明,35/30、40/35 ℃高温胁迫处理27 d时,大花四照花和日本四照花的苗高相对增长率、地上部分生物量、总生物量、气孔导度(Gs)、净光合速率(Pn)、最大光量子产量(Fv/Fm)、光化学猝灭系数(qP)低于CK或处理前,非光化学猝灭系数(NPQ)高于CK或处理前;35/30 ℃ 处理27 d时2种四照花幼苗各项测定指标与CK或处理前相比相互间差异不显著(P>0.05),而40/35 ℃处理27 d时2种四照花的幼苗苗高相对增长率、大花四照花总生物量较CK有显著降低(P<0.05),大花四照花叶片Pn、Gs、Fv/Fm、PSⅡ潜在光化学活性(Fv/Fo)、qP及日本四照花叶片Pn较处理前有显著降低。
关键词:大花四照花;日本四照花;高温胁迫;生长;光合指标;叶绿素荧光参数
中图分类号: S718.43;S684.01 文献标志码: A 文章编号:1002-1302(2019)22-0159-05
随着全球气候变暖,高温胁迫已逐渐成为威胁植物生长发育的主要因素之一。高温胁迫虽然可从生理、生化及分子等方面影响植物的生长,但光合作用才是影响植物生物量的本质[1],同时也是植物应对高温胁迫极为敏感的生理过程[2]。高温胁迫会引生起植物叶绿体类囊体膜结构改变,导致膜脂过氧化,使光合电子传递链和放氧复合体(OEC)受到损伤,光合速率降低[3]。光系统Ⅱ(PSⅡ)是光合作用进程中对高温最敏感、最易受破坏的部位[4],高温会抑制PSⅡ供体侧水的光解和下游碳的同化反应[5],目前,对高温胁迫下植物PSⅡ功能的研究方法主要有叶绿素荧光参数检测、快速叶绿素荧光诱导动力学(OJIP)曲线和蛋白质组学技术等[6-8]。
四照花(Cornus)为山茱萸科常绿或落叶小乔木或灌木,被划分为东亚四照花和北美四照花两大类群[9],树种树姿优美,是集彩花、彩果、彩叶于一身的园艺观赏树种[10],在森林生态系统中发挥着良好的生态效益[11],北美早在100多年前就对北美四照花类群进行大量选育,目前有超过100多个栽培品种广泛种植于北美各地的庭园和道路旁。近年来,日本、韩国等亚洲国家也开始对四照花进行引种、推广栽培,并取得良好的景观效果[12]。中国作為东亚四照花类群的主要分布区,也被认为是北美四照花品种的适宜引种栽培区,尤其是中国亚热带地区[10,13]。
中国长江中下游亚热带地区夏季炎热多雨,高温引起的自然灾害事件频发,而极端高温持续天数也呈上升趋势[14]。为评估长江中下游亚热带地区夏季高温对北美四照花品种的影响,本试验以乡土树种日本四照花(C. kousa)为对照材料,研究短期高温胁迫下大花四照花(C. florida)的光合和生长情况,探讨其对高温胁迫的响应机制,以期为北美四照花在亚热带地区的引种栽培提供理论依据。
1 材料与方法
1.1 试验材料的准备
2个类群的代表种大花四照花(北美类群)、日本四照花(东亚类群)种子,分别于2014年购自美国路易斯安那州和日本。将2个四照花种子进行低温层积处理,于南京林业大学溧水白马基地塑料大棚内培育成1年生容器苗,容器规格为上、下口径分别20、15 cm,高20 cm,栽培基质为草炭 土 ∶ 黄棕壤 ∶ 珍珠岩 ∶ 碳化稻壳=5 ∶ 3 ∶ 1 ∶ 1,并施用缓释肥3 g/盆。
1.2 试验设计
试验于2015年8月在人工气候室内进行,选取长势基本一致的健壮幼苗于人工气候室中缓苗1周,缓苗期间保证良好的水分供应和适宜的生长温度;以昼/夜温度分别为 35/30、40/35 ℃这2个高温胁迫处理27 d,处理编号分别为T1、T2,以昼/夜温度30/25 ℃处理为对照(CK)。每处理20株苗,重复3次,试验过程中保证水分的正常供应;测定2个四照花的生长和光合指标。培养条件:光照度为 550 μmol/(m2·s),光照时间为12 h/d,相对湿度为60%~70%,保持通风。
1.3 生长与光合指标测定方法
1.3.1 生长指标 高温胁迫前,选定长势较为一致的幼苗5株,测量苗高H0、地径B0;胁迫处理结束,再次测量同一植株的苗高H1、地径B1,计算苗高、地径的相对增长率,同时,各处理选取与苗高和地径均值较为接近的幼苗5株,去除叶片和栽培基质,将植株分为地上主干、地下根2个部分,105 ℃烘箱中烘干至恒质量,称质量即为地上、地下部分生物量。苗高、地径的相对增长率计算公式分别为:
苗高相对增长率=(H1-H0)/H0×100%;
地径相对增长率=(B1-B0)/B0×100%。
1.3.2 光合指标 分别于处理0、2、8、13、19、27 d的中午,采用美国产LI-6400便携式光合仪,避开主脉,测定幼苗中上部成熟功能叶片的净光合速率(Pn)、气孔导度(Gs)。每重复随机测定1株,每株测叶片3张,取均值。测定时,光合仪使用人工LED光源,饱和光强、气体流速、CO2浓度分别为 1 000 μmol/(m2·s)、500 μmol/s、400 μmol/mol。同日下午,分别测定叶绿素荧光指标,即将红蓝光源换成荧光叶室,将叶片用暗适应夹夹住暗处理20 min,测定初始荧光(Fo)、最大荧光(Fm)、光化学猝灭系数(qP),计算最大光量子产量(Fv/Fm)、PSⅡ潜在光化学活性(Fv/F0)、可变荧光(Fv);活化 30 min,测定非光化学淬灭系数(NPQ)。可变荧光计算公式为:
Fv=Fm-F0。
1.4 数据统计分析
采用Excel 2013软件对试验数据进行处理,采用SPSS 20.0软件对数据进行单因素方差分析和Duncans新复极差法多重比较。
2 结果与分析
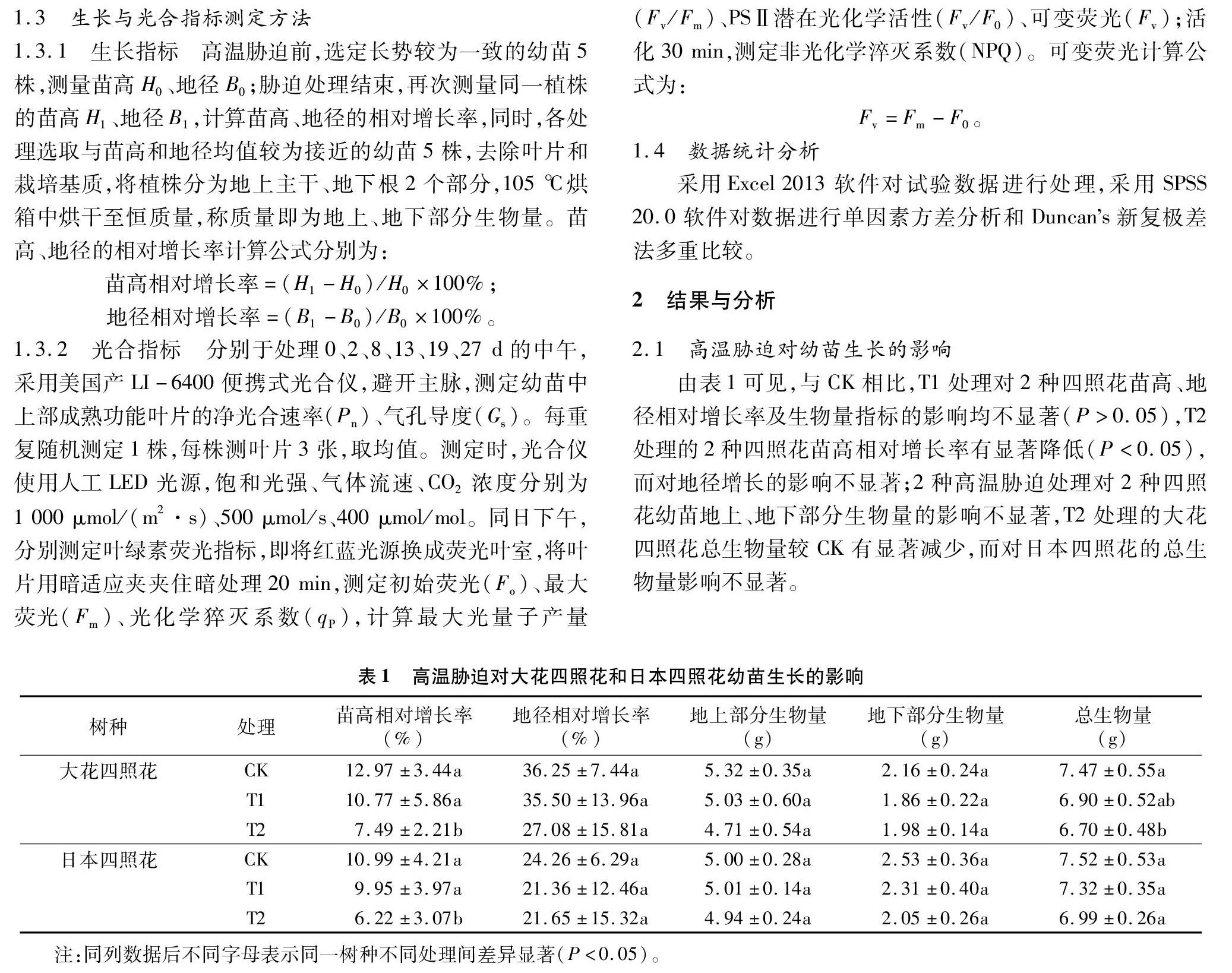
2.1 高温胁迫对幼苗生长的影响
由表1可见,与CK相比,T1处理对2种四照花苗高、地径相对增长率及生物量指标的影响均不显著(P>0.05),T2处理的2种四照花苗高相对增长率有显著降低(P<0.05),而对地径增长的影响不显著;2种高温胁迫处理对2种四照花幼苗地上、地下部分生物量的影响不显著,T2处理的大花四照花总生物量较CK有显著减少,而对日本四照花的总生物量影响不显著。
2.2 高温胁迫对四照花幼苗叶片气体交换参数的影响
由图1可见,T1处理的2种四照花幼苗叶片,其净光合速率(Pn)在胁迫处理前8 d整体呈明显的下降趋势,并在胁迫处理8 d时达到最低值,后又逐渐恢复至胁迫处理前的水平,这说明35/30 ℃胁迫处理未对2种四照花产生实质性的伤害;T2处理的大花四照花幼苗叶片,其Pn随时间延长整体呈明显的下降趋势,处理27 d时的Pn值较CK降低 38.94%,下降幅度明显高于日本四照花;T1、T2高温胁迫处理27 d时,大花四照花、日本四照花叶片Pn低于处理前。
气孔调节是植物应对逆境胁迫的快速调节方式之一。由图1可见,与处理前相比,T1胁迫处理27 d时大花四照花、日本四照花的气孔导度(Gs)低于处理前,但相互间差异不显著(P>0.05),说明35/30 ℃胁迫处理未对2种四照花造成实质性伤害;T2处理的大花四照花Gs整体呈明显下降趋势,胁迫处理27 d时显著低于处理前(P<0.05),而T2胁迫处理未对日本四照花Gs产生显著影响,说明日本四照花具有较好的耐热性。
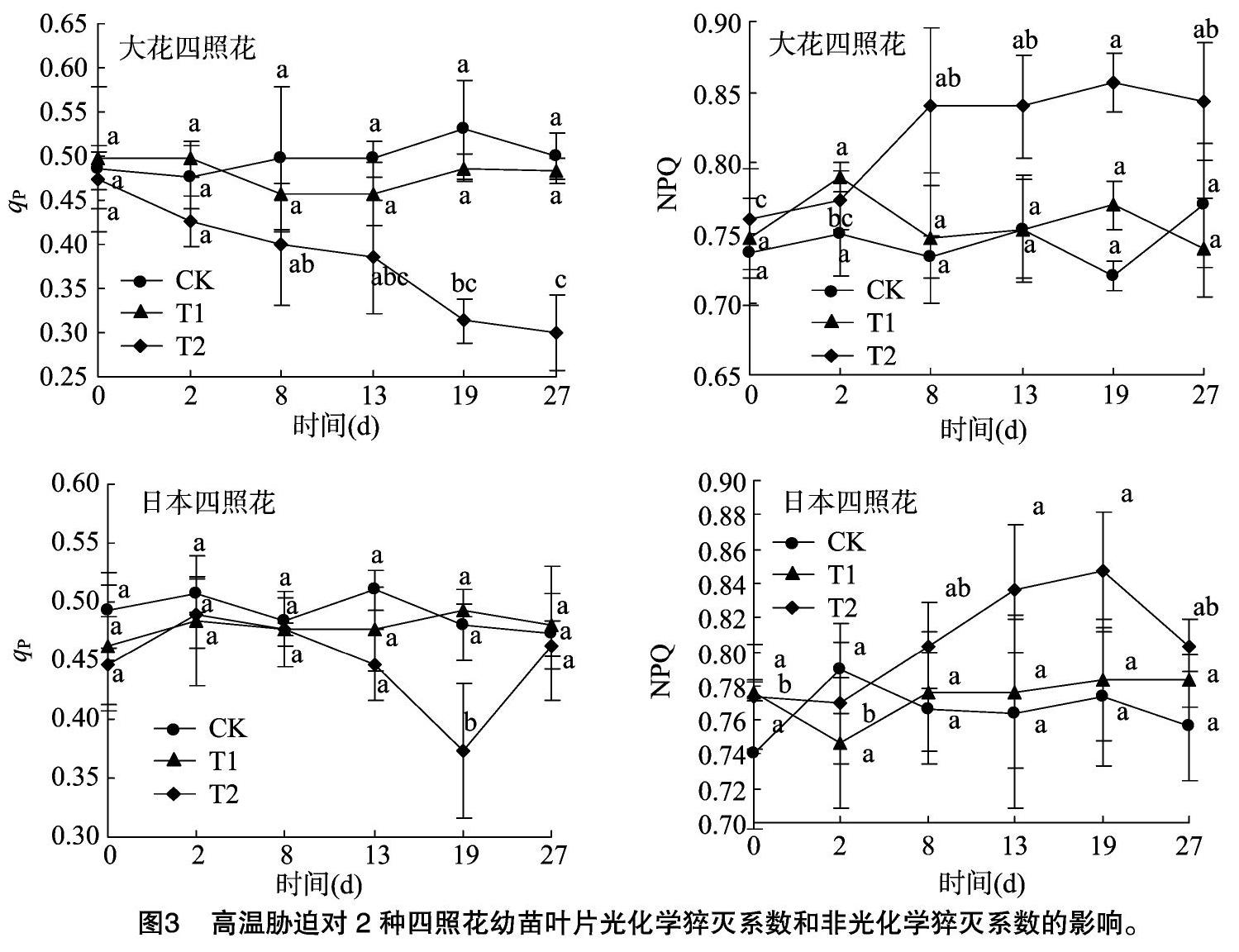
2.3 高温胁迫对四照花幼苗叶片叶绿素荧光参数的影响
由图2可见,T1处理未对2种四照花幼苗叶片的最大光量子产量(Fv/Fm)、PSⅡ潜在光化学活性(Fv/F0)产生显著影响(P>0.05);T2处理的大花四照花幼苗,其叶片Fv/Fm、Fv/F0随高温持续时间的延长呈明显的下降趋势,胁迫处理 8 d 后显著低于胁迫处理前(P<0.05),胁迫处理27 d时,Fv/Fm、Fv/F0分别降至最低,分别为对照的93.15%、79.18%,说明大花四照花的光合系统在昼/夜温度40/35 ℃高温胁迫下受到损伤;随胁迫天数的延长,T2处理时的日本四照花幼苗叶片Fv/Fm呈降—升—降—升波动态势、Fv/F0呈先降后升趋势,但与胁迫处理前相比,胁迫处理27 d时的日本四照花幼苗叶片Fv/Fm、Fv/F0差异不显著,说明高温胁迫对日本四照花光合系统的损伤是可逆的。
由图3可见,与胁迫处理前相比,T1处理对大花四照花、日本四照花幼苗叶片光化学猝灭系数(qP)、非光化学猝灭系数(NPQ)未产生显著影响(P>0.05);随胁迫天数的增加,T2处理的大花四照花幼苗叶片qP呈明显的下降趋势、NPQ呈先升后降趋势,处理27 d时,大花四照花幼苗叶片qP较CK下降40.00%、NPQ较CK上升9.09%,说明大花四照花在高温胁迫下会以热耗散形式消耗过剩的激发能,以减轻高温胁迫对光合系统造成的损伤;T2处理的日本四照花随处理时间的延长,其叶片qP呈明显先降后升趋势、NPQ呈整体先升后降趋势,并在胁迫处理19 d时达到极值,qP较CK下降 22.23%、NPQ较CK上升5.26%,而在胁迫处理27 d时恢复至与处理前相比差异不显著,说明日本四照花可随胁迫天数的增加而逐渐适应高温环境,并通过自身调节可以适当恢复。
3 结论与讨论
生长量是植物应对逆境胁迫综合响应的体现,也是确定植物耐逆性的常用指标[4,15]。高温胁迫导致植物细胞失水,细胞增长受到抑制,从而植物的生长量降低[16]。本试验结果表明,昼/夜温度分别为35/30、40/35 ℃持续处理27 d进行高温胁迫,未显著影响大花四照花、日本四照花2种四照花的地径相对增长率及地上、地下部分生物量(P>0.05),而 40/35 ℃ 高温胁迫使2种四照花的苗高相对增长率及大花四照花总生物量有显著降低(P<0.05),未对日本四照花总生物量产生显著影响,可能是由于35~40 ℃为大花四照花适宜生长温度的上限值,而日本四照花则更适应于这种短期高温环境,与其原生境较为一致。
高温会导致植物气孔关闭、胞间CO2浓度降低、碳同化量减少,最终会导致植物净光合速率(Pn)下降[17]。Allakhverdiev等的研究结果表明,轻度高温便可抑制植物的光合作用[18-19]。本研究結果表明,昼/夜温度35/30 ℃高温胁迫0~8 d时,2种四照花幼苗叶片Pn较处理前有明显降低,最终均能恢复至处理前水平,说明这2种四照花均能够耐受35 ℃高温;昼/夜温度40/35 ℃高温胁迫下,2种四照花的Pn随胁迫天数的延长有明显下降,且不能恢复到处理前水平,这与孙宪芝等的研究结果[3]较为吻合。
高温胁迫抑制植物光合作用的机制至今仍存在争议[20],有一种理论认为,高温胁迫降低了植物的气孔导度,使叶绿体内CO2供应受阻,从而降低了叶片的最大羧化速率,抑制了光合作用[21];另一种理论认为,光合电子传递和核酮糖-1,5- 二磷酸羧化酶(Rubisco酶)活性在高温胁迫下受到抑制,从而降低了植物的光合作用[22]。本试验中,大花四照花在40/35 ℃高温胁迫下叶片气孔导度(Gs)受到抑制,进而导致Pn降低,与前者理论较为吻合;但是,高温胁迫未明显降低日本四照花的Gs,但其Pn却受到抑制,这可能是因为日本四照花在高温下受到光抑制,其光合电子传递和Rubisco酶活性降低,与后者理论较为相符。
高温胁迫会致使植物无法利用过量的光能,从而产生大量的活性氧损伤叶绿体,导致光抑制和过氧化胁迫[23]。同时,光合电子传递能力的损坏也会导致对热敏感的光系统Ⅱ(PSⅡ)产生过量的单线态氧,影响PSⅡ放氧复合体活性,损伤PSⅡ反应中心D1蛋白[24]。一般情况下,PSⅡ的受损程度可用最大光量子产量(Fv/Fm)、PSⅡ潜在光化学活性 (Fv/F0) 的变化来指示。周媛等研究表明,随着高温胁迫程度和持续天数的增加,Fv/Fm、Fv/F0下降[6,24],这反映高温胁迫下植物叶绿体类囊体膜构象发生改变、PSⅡ反应中心失活。一般认为,高温胁迫下叶绿素荧光指标变化幅度较大的植物耐热性较差[25]。本研究结果表明,2种四照花的Fv/Fm、Fv/F0在35/30 ℃高温胁迫未受到显著影响,这与刘春风等的研究结果[26]一致,但40/35 ℃高温胁迫27 d时大花四照花叶片Fv/Fm、Fv/F0较处理前有显著降低,而日本四照花较处理前差异不显著,说明日本四照花在40/35 ℃高温下发生的光抑制是可逆的,日本四照花对原生境的适应性明显优于大花四照花。
植物对光能的利用主要包括光化学反应转化、非光化学热耗散、叶绿素荧光形式耗散等3个方面,其中,叶绿素荧光猝灭包括光化学猝灭(qP)和非光化学猝灭(NPQ)[21]。有研究证明,非光化学猝灭是植物体通过热耗散形式消耗光合机构内过剩激发能、有效防止光抑制发生的自我保护机制[27]。本试验中,2种四照花叶片qP、NPQ在35/30 ℃高温胁迫下未有显著变化,而在40/35 ℃高温胁迫下,大花四照花叶片qP、NPQ随胁迫时间延长发生明显变化,其光合机构可能受到不可逆损伤,日本四照花叶片qP、NPQ虽发生明显变化,但胁迫27 d时均能有所恢复,说明日本四照花能够逐渐适应40/35 ℃ 的高温环境,这与He等的研究结果[28]较为吻合。
综上所述,高温胁迫降低了2种四照花幼苗叶片的气孔导度、净光合速率,减少了最大光量子产量、光化学猝灭系数,而转为热耗散形式消耗过剩光能,提高了非光化学猝灭系数,从而导致苗高相对增长率和生物量降低;四照花能较好地适应昼/夜温度35/30 ℃的高温环境,日本四照花对昼/夜温度40/35 ℃的高温有更好的耐受性和适应能力。因此,可采用嫁接方法,以耐热性较好的日本四照花为砧木嫁接优良的北美四照花栽培品种,以提高其在亚热带地区高温环境下的存活率,并保证其优良的观赏价值。
参考文献:
[1]Mathur S,Agrawal D,Jajoo A. Photosynthesis:response to high temperature stress[J]. Journal of Photochemistry and Photobiology Biology,2014,137:116-126.
[2]Berry J A,Bjrkman O. Photosynthetic response and adaptation to temperature in higher plants[J]. Annual Review of Plant Physiology,1980,31:491-543.
[3]孙宪芝,郭先锋,郑成淑,等. 高温胁迫下外源钙对菊花叶片光合机构与活性氧清除酶系统的影响[J]. 应用生态学报,2008,19(9):1983-1988.
[4]苏晓琼,王美月,束 胜,等. 外源亚精胺对高温胁迫下番茄幼苗快速叶绿素荧光诱导动力学特性的影响[J]. 园艺学报,2013,40(12):2409-2418.
[5]Crafts-Brandner S J,Law R D. Effect of heat stress on the inhibition and recovery of the ribulose-1,5-bisphosphate carboxylase/oxygenase activation state[J]. Planta,2000,212(1):67-74.
[6]周 媛,童 俊,徐冬云,等. 高温胁迫下不同杜鹃品种PSⅡ活性变化及其耐热性比较[J]. 中国农学通报,2015,31(31):150-159.
[7]Strauss A J,Kruger G H,Strasser R J,et al. Ranking of dark chilling tolerance in soybean genotypes probed by the chlorophyll a fluorescence transient O-J-I-P[J]. Environmental and Experimental Botany,2006,56(2):147-157.
[8]刘军銘,赵 琪,尹赜鹏,等. 利用蛋白质组学技术揭示的植物高温胁迫响应机制[J]. 应用生态学报,2015,26(8):2561-2570.
[9]Xiang Q Y,Brunsfeld S J,Soltis D E,et al. Phylogenetic relationships in cornus based on chloroplast DNA restriction sites:implications for biogeography and character evolution[J]. Systematic Botany,1996,21(4):515-534.
[10]Fu X X,Liu H N,Zhou X D,et al. Seed dormancy mechanism and dormancy breaking techniques for Cornus kousa var. chinensis[J]. Seed Science and Technology,2013,41(3):458-463.
[11]Jenkins M A,White P S. Cornus florida L. mortality and understory composition changes in western Great Smoky Mountains National Park[J]. Journal of the Torrey Botanical Society,2002,129(3):194-206.
[12]洑香香,徐 杰,刘国华. 观赏型四照花种质资源及其开发利用[J]. 林业科技开发,2015,29(3):1-6.
[13]Fu X X,Liu H N,Xu J,et al. Primary metabolite mobilization and hormonal regulation during seed dormancy release in Cornus japonica var. chinensis[J]. Scandinavian Journal of Forest Research,2014,29(6):542-551.
[14]闫少锋,张金池,张 波,等. 南京极值温度长期变化及其与平均温度的关系[J]. 气象与环境学报,2011,27(3):33-39.
[15]田 婧,郭世荣,孙 锦,等. 外源Spd对高温胁迫下黄瓜幼苗叶片膜脂过氧化及质子泵活性的影响[J]. 应用生态学报,2011,22(12):3252-3258.
[16]Sharma L,Priya M,Bindumadhava H,et al. Influence of high temperature stress on growth,phenology and yield performance of mungbean[Vigna radiata (L.) Wilczek]under managed growth conditions[J]. Scientia Horticulturae,2016,213:379-391.
[17]Greer D H,Weedon M M. Modelling photosynthetic responses to temperature of grapevine (Vitis vinifera cv. Semillon) leaves on vines grown in a hot climate[J]. Plant Cell and Environment,2012,35(6):1050-1064.
[18]Allakhverdiev S I,Kreslavski V D,Klimov V V,et al. Heat stress:an overview of molecular responses in photosynthesis[J]. Photosynthesis Research,2008,98(1/2/3):541-550.
[19]Yamamoto Y,Aminaka R,Yoshioka M,et al. Quality control of photosystem Ⅱ:Impact of light and heat stresses[J]. Photosynthesis Research,2008,98(1/3):589-608.
[20]Szymanska R,Slesak I,Orzechowska A,et al. Physiological and biochemical responses to high light and temperature stress in plants[J]. Environmental and Experimental Botany,2017,139:165-177.
[21]杜尧东,李键陵,王 华,等. 高温胁迫对水稻剑叶光合和叶绿素荧光特征的影响[J]. 生态学杂志,2012,31(10):2541-2548.
[22]Makino A,Sage R F. Temperature response of photosynthesis in transgenic rice transformed with ‘sense or ‘antisense rbcS[J]. Plant and Cell Physiology,2007,48(10):1472-1483.
[23]Chen Y E,Zhang C M,Su Y Q,et al. Responses of photosystemⅡand antioxidative systems to high light and high temperature co-stress in wheat[J]. Environmental and Experimental Botany,2017,135:45-55.
[24]Tian F X,Gong J F,Zhang J,et al. Overexpression of monoubiquitin improves photosynthesis in transgenic tobacco plants following high temperature stress[J]. Plant Science,2014,226(SI):92-100.
[25]梁 雪,顏 坤,梁 燕,等. 高温对耐热大葱品种PSⅡ和抗氧化酶活性的影响[J]. 园艺学报,2012,39(1):175-181.
[26]刘春风,张往祥,孙 垒,等. 高温对观赏海棠生长和光合作用的影响[J]. 南京林业大学学报(自然科学版),2013,37(4):17-22.
[27]郭培国,李荣华. 夜间高温胁迫对水稻叶片光合机构的影响[J]. 植物学报,2000,42(7):673-677.
[28]He B,Guo T,Huang H,et al. Physiological responses of Scaevola aemula seedlings under high temperature stress[J]. South African Journal of Botany,2017,112:203-209.

