K型小麦雄性不育系绒毡层结构变化及相关基因的表达分析
翟晓光,辛 芳,韩玉翠,夏雪姣,朱 婷,菅明阳,丁 勤,马翎健
(1.西北农林科技大学农学院,陕西杨凌 712100; 2.西北农林科技大学园艺学院,陕西杨凌 712100)
小麦是世界上最重要的粮食作物之一,其总产量居世界首位;小麦消费量同样位居世界首位,并且随着人口的增长和消费水平的不断提高,预计消费量将继续增加[1]。如何提高小麦单产、改善品质和增强适应性对我国乃至世界粮食安全有着重大意义。杂种优势利用是作物产量提高的一条重要途径,可使小麦单产增加3.5%~15%,但全球杂交小麦种植面积不到小麦总面积的0.2%[2-3]。雄性不育是杂种优势利用的基础,因此对雄性不育的研究意义重大[4-5]。
绒毡层位于植物花药壁细胞的最内一层,为雄配子发育提供必需的营养物质,其合成分泌的酶类和花粉壁前体物质对小孢子的正常发育有重要作用[6]。对拟南芥[7]、水稻[8]、油菜[9]、玉米[10]和小麦[11]的研究发现,败育原因大多数都与绒毡层的异常活动有关。绒毡层的提前或延迟程序性死亡会导致小孢子发育异常和花粉败育,但是不同材料的败育时期和花药细胞学特征不尽相同[12-15]。Wang等[16]发现绒毡层分泌合成的孢粉素是小孢子发育阶段的关键蛋白,RAFTIN1基因又与孢粉素转运密切相关,将RAFTIN1基因沉默导致植株出现雄性不育现象。对水稻不育机制的研究发现,参与绒毡层发育的转录因子EAT1突变体不育系中的两个天冬氨酸蛋白酶基因(OsAP25和OsAP37)的表达量与保持系相比显著提高,促使绒毡层细胞提前降解导致败育[17]。
前人对小麦不同类型雄性不育系花药发育细胞学研究较多[18-22],但对小麦雄性不育系花药发育过程中绒毡层亚显微结构的研究报道较少,分析绒毡层结构变化与相关基因表达之间关系的研究更少。本研究对K型非1B/1R小麦雄性不育系花药绒毡层结构进行显微和亚显微结构观察,并对与孢粉素转运和绒毡层细胞降解相关的两个基因RAFTIN1和APs进行表达模式分析,旨在明确其败育机制。
1 材料与方法
1.1 试验材料
K型非1B/1R小麦雄性不育系K519A及其保持系519B,由西北农林科技大学杂交小麦课题组创制,具有败育彻底、稳定、恢复源广、农艺性状良好和不产生单倍体等优点。2016年10月3日将其种植于西北农林科技大学北校区试验田(陕西杨凌),每个材料各种4行,行长2 m,行距25 cm,株距5 cm,3次重复,田间管理同常规。
按宋喜悦等[23]描述的方法,根据小麦外部形态取幼穗小花花药制片(1%醋酸洋红染色),于显微镜下观察,确定花药发育时期。分别取处于小孢子母细胞期、四分体期、单核期、二核期和三核期的花药各10粒,迅速投入4%戊二醛中固定,利用真空泵抽气使花药浸没,然后4 ℃避光保存,用于透射电镜制样。取上述发育时期的小麦花药各0.1 g (15~20穗),每个时期设置3次生物学重复,迅速放入液氮冷冻后置于-80 ℃保存,用于总RNA的提取。
1.2 切片观察和小孢子细胞壁厚度的测定
参照Geng等[24]的方法,将戊二醛固定的花药制成半薄和超薄切片。用Leica RM2265全自动半薄轮转式切片机(Leica,德国)切1 μm的半薄切片,0.03 mol·L-1甲苯胺蓝染色15 s,并用Axio Imager M2生物显微镜(ZEISS,德国)观察拍照;用Leica-S型切片机(Leica,德国)超薄切片,放置在200目的铜网上,用醋酸铀和柠檬酸铅染色,于Hitach H7700透射电镜(HITACHI,日本)观察拍照。
从照片中随机选花粉粒细胞壁的20个点,测量胞壁厚度(d),计算小孢子细胞壁的真实厚度(h)。h=d/x,x为放大倍数。
1.3 qRT-PCR分析
利用MiniBEST Plant RNA Extraction Kit (TaKaRa,日本)提取总RNA,按照PrimeScript RT Master Mix (TaKaRa,日本)操作说明合成cDNA第一链, -20 ℃保存备用。
根据RAFTIN1(GenBank登录号AJ575663.1)、APs(GenBank登录号AK332620.1)和Actin(GenBank登录号AB181991.1)基因序列,应用软件Primer Premier 6.0 设计引物,并在Primer-BLAST (https://www.ncbi.nlm.nih.gov/tools/primer-blast/)检测引物的特异性。引物序列分别为ActinF:5′-TACTCCCTCACAACAA- CCGC-3′,ActinR:5′-CTCCTAGCCGTTTCCA- GCTC-3′;RAFTIN1F:5′-GCGCCACCGATGA- ATACAAG-3′,RAFTIN1R:5′-AAGAACACC- GTCGTCGTCTC-3′;APsF:5′-CTTCAACACG- GACGAGGTGG-3′,APsR:5′-TGTGGATCAG-CGTGTTCTCC-3′,由北京擎科新业生物技术有限公司合成。
参照SYBR Premix ExTaqⅡ(TaKaRa,日本)说明书进行体系配置和程序扩增,用Applied Biosystems QuantStudio 7 Flex荧光定量仪(ABI,美国)进行qRT-PCR。用2-△△CT法[25]计算基因的相对表达量,用Excel软件和SPSS 20软件进行数据分析和绘图。
2 结果与分析
2.1 K型不育系花药绒毡层的显微结构
对比K519A不育系与其保持系的整个发育时期,发现不育系绒毡层细胞提前异常降解。在小孢子母细胞时期,保持系花药绒毡层细胞排列整齐紧密,而不育系花药绒毡层细胞之间间隙较大,且与保持系相比体积明显较大(图1A、1F)。至四分体时期,保持系花药的绒毡层细胞体积明显增大,特别是横向细胞间距增大,具有浓厚细胞质。而不育系花药的绒毡层开始萎缩,部分绒毡层细胞出现双核,绒毡层提前异常降解,少数降解异常的绒毡层细胞侵入药室内(图1B、1G)。发育进入单核期,保持系绒毡层细胞萎缩,部分边缘模糊化,细胞整体轮廓仍正常且排列依然紧密,小孢子细胞呈圆形。而此时不育系绒毡层细胞异常肥大,细胞粘连在一起难以分清界限,细胞边缘模糊并逐渐解体,细胞质染色较浅。此时期不育系小孢子细胞形状不规则,且与保持系相比小孢子细胞壁较厚(图1C、1H)。至二核期,绒毡层迅速降解,保持系绒毡层细胞剩余残迹,而不育系绒毡层细胞只剩下细胞轮廓,小孢子细胞壁明显增厚,不育系部分小孢子染色异常(图1D、1I)。三核期保持系绒毡层细胞进一步自溶而降解,为小孢子的发育提供各种营养物质,不育系花药壁只剩表皮和花药内壁。小孢子形态各异,保持系中可观察到小孢子内存在液泡和细胞核,而不育系花粉粒染色异常,液泡较小,甚至一部分花粉粒全部染色,大部分花粉粒细胞壁内出现一圈空囊(图1E、1J)。
2.2 K型不育系花药绒毡层的亚显微结构
与半薄组织切片观察相比,超薄切片更能清晰地观察绒毡层的发育过程。花药小孢子母细胞时期,保持系花药绒毡层细胞之间存在间隙,部分细胞出现空泡化现象,绒毡层细胞正处在有丝分裂中期,细胞核较大且核中染色体短粗,染色很深,数目清晰,细胞质内出现大小不一的囊泡,细胞器丰富,小孢子母细胞紧贴绒毡层细胞(图2A)。而不育系花药绒毡层细胞间隙明显比保持系的大,且绒毡层细胞横向距离达到最大,细胞多为双核细胞,细胞内有大小不一的小泡,此时期不育系绒毡层细胞同保持系花药四分体时期绒毡层细胞的发育程度相似(图2G)。
发育至四分体时期,保持系花药绒毡层细胞之间的间隙增大,绒毡层细胞横向增大,有丝分裂结束,细胞核缩小、核仁出现,细胞质浓厚,内含丰富的细胞器,囊泡变大(图2B)。不育系花药绒毡层细胞开始萎缩,部分绒毡层细胞降解并脱离中层细胞侵入药室内(图2H)。
发育至单核期,保持系花药绒毡层细胞边缘模糊,细胞开始降解。不育系花药绒毡层降解更为明显,且绒毡层药室侧的细胞膜上出现乌氏体(图2C、2I)。此时期小孢子增大,靠近绒毡层细胞,保持系花药小孢子细胞壁厚度仅为0.43 μm,而不育花药小孢子细胞壁厚度为1.01 μm,是保持系花药小孢子细胞壁厚度的2.35倍(图2C、2I)。
发育至二核期,绒毡层迅速降解,只剩下部分残迹和绒毡层膜,保持系花药绒毡层细胞膜表面附着大量乌氏体,而不育系花药绒毡层细胞膜表面附着的乌氏体量较少。中层细胞降解完全,花药内壁细胞增厚,细胞质浓厚,不育系的花药内壁液泡化程度增大,液泡几乎占据了整个细胞。此时期小孢子细胞壁增厚,保持系小孢子细胞壁增厚至3.05 μm,不育系小孢子细胞壁厚度为2.81 μm,小孢子细胞表面附着大量孢粉素,细胞质变浓(图2D、2J)。
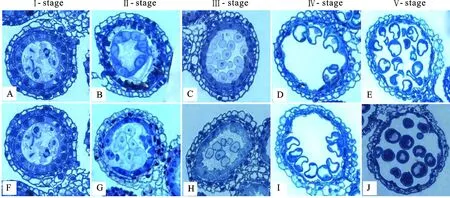
Ⅰ-stage:小孢子母细胞期;Ⅱ-stage:四分体期;Ⅲ-stage:单核期;Ⅳ-stage:二核期;Ⅴ-stage:三核期。放大倍数:400。
Ⅰ-stage:Microspore mother cell stage; Ⅱ-stage:Tetrad stage; Ⅲ-stage:Mononuclear stage; Ⅳ-stage:Binuclear stage; Ⅴ-stage:Trinuclear stage.Magnification:400.
图1保持系519B(图A~E)和不育系K519A(图F~J)的花粉囊及小孢子发育过程
Fig.1Cytologicalstructuresofantherandmicrosporeofmaintainer519B(panelsAtoE)andmalesterilelineK519A(panelsFtoJ)
至三核期,绒毡层细胞进一步自溶和降解,保持系绒毡层膜上附着了大量乌氏体,与保持系花药相比,不育系花药绒毡层细胞膜表面附着的乌氏体量明显较少(图2E、2K)。保持系花药小孢子细胞壁继续增厚,细胞核较大、核仁清晰,细胞质浓厚,有清晰的液泡(图2F);而不育系花药发育形成异常的花粉粒,部分败育花粉发育畸形,形状不规则,细胞核不明显,大部分花粉出现明显质壁分离的败育现象,而且细胞质收缩导致电子密度异常增大(图2L)。三核期保持系花粉粒细胞壁厚度为3.33 μm,不育系花粉粒细胞壁厚度为2.99 μm。与保持系花粉粒细胞壁相比,不育系花粉粒细胞壁较薄,仅是保持系花粉粒细胞壁厚度的89%(图2F、2L)。
2.3 绒毡层相关基因在K型不育系中的表达
RAFTIN1在保持系519B中的表达水平呈高-低-高-低的变化趋势。小孢子母细胞期,RAFTIN1相对表达量为0.95,是四分体期和单核期的3.17倍和3.06倍;二核期的相对表达量为1.00,达到最大值,极显著高于单核期相对表达量,是小孢子母细胞期的1.05倍;发育至三核期,该基因相对表达量降到最低值(图3)。
在不育系K519A中,RAFTIN1的相对表达量虽然也呈高-低-高-低的变化趋势,但是升高和降低的时期不同于保持系,以小孢子母细胞期表达水平最高,三核期最低。小孢子母细胞期至单核期,不育系中RAFTIN1的相对表达量都明显高于保持系,是保持系中相对表达量的2.62倍(小孢子母细胞期)、2.83倍(四分体期)和4.45倍(单核期);不育系RAFTIN1在二核期的相对表达量低于保持系,仅为保持系中相对表达量的一半;到三核期,保持系和不育系中的相对表达量基本相同(图3)。
天冬氨酸蛋白酶基因APs在保持系花药中的相对表达量比较稳定,在单核期相对表达量最高,其次是小孢子母细胞期和二核期,四分体时期较三核期稍高(图3)。而在不育系中,APs相对表达量变化非常明显,小孢子母细胞期最高,且与其他时期差异很大,整个发育过程持续下降,到三核期基本不表达(图3)。小孢子母细胞期、四分体期和单核期不育系APs基因的相对表达量都明显高于保持系,分别是保持系的10.85、3.90和1.85倍;而二核期和三核期保持系的APs相对表达量都高于不育系,分别是不育系相对表达水平的1.17倍和2.71倍。
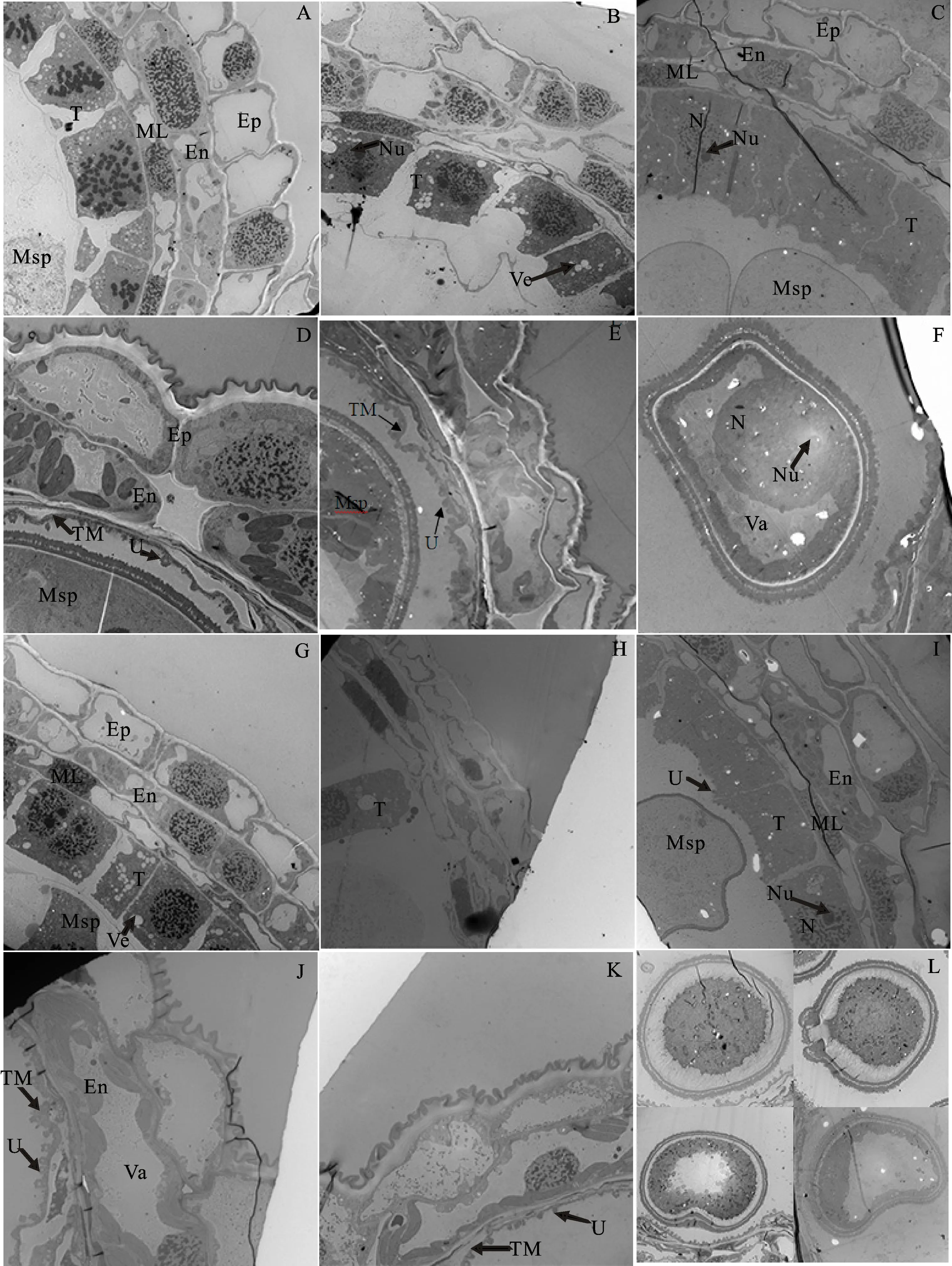
A和G:小孢子母细胞期;B和H:四分体期;C和I:单核期;D和J:二核期;E和K:三核期;F和L:三核期花粉粒。放大倍数:A、B、C、E、G、H和I图,2 000×;K和L图,2 500×;D、F和J图,3 000×。Ep:表皮;En:药室内壁;ML:中层;T:绒毡层;Msp:小孢子;N:细胞核;Nu:核仁;Ve:小泡;TM:绒毡层膜;U:乌氏体;Va:液泡。
A and G:Microspore mother cell stage; B and H:Tetrad stage; C and I:Mononuclear stage; D and J:Binuclear stage; E and K:Trinuclear stage; F and L:Pollen grains at trinuclear stage. Magnification:2 000× for panels A,B,C,E,G,H and I; 2 500× for panels K and L; 3 000× for panels D,F and J. Ep:Epidermis; En:Endothecium; ML:Middle layers cells; T:Tapetum; Msp:Microspore; N:Nucleus; Nu:Nucleolus; Ve:Vesicle; TM:Tapetum membrane; U:Ubisch body; Va:Vacuole.
图2保持系519B(图A~F)和不育系K519A(图G~L)花药发育的亚显微结构
Fig.2Ultrastructureofantherandmicrosporeofthemaintainer519B(panelsAtoF)andthemalesterilelineK519A(panelsGtoL)
值得一提的是,RAFTIN1和APs的相对表达量在小孢子母细胞期至单核期均表现为不育系明显高于保持系,而在二核期则低于保持系,到三核期两基因的相对表达量都降到最低值。三核期RAFTIN1在不育系和保持系中的表达水平相似,而不育系APs的相对表达量显著低于保持系。

Ⅰ:小孢子母细胞期;Ⅱ:四分体期;Ⅲ:单核期;Ⅳ:二核期;Ⅴ:三核期。误差线上小写字母不同表示同一材料中基因相对表达量在不同时期间差异显著(P<0.05)。
Ⅰ:Microspore mother cell stage; Ⅱ:Tetrad stage; Ⅲ:Mononuclear stage; Ⅳ:Binuclear stage; Ⅴ:Trinuclear stage.Different lower-case letters above the error bars indicate significant difference of gene expression level among different stages for the same line (P<0.05).
图3保持系519B和不育系K519A绒毡层细胞发育相关基因的相对表达量
Fig.3Relativeexpressionlevelsofthegenesrelatedtotapetumdevelopmentinthemaintainer519BandthemalesterilelineK519A
3 讨 论
众多研究表明,不育系花药绒毡层活动异常可能是导致花粉败育的重要原因[11,14-15,18-22]。本试验通过对K型非1B/1R小麦雄性不育系不同发育时期花药绒毡层结构进行观察,发现绒毡层细胞在四分体时期提前异常降解侵入药室,三核期出现部分形状不规则的小孢子,推测绒毡层提前异常降解侵入药室,侵害了小孢子正常发育的空间,导致部分小孢子在此时期败育,小孢子后期不能正常发育,表现为花粉粒形状不规则。这印证了Scoles等[26]的研究结果,他们发现黑麦雄性不育系花药绒毡层细胞过度肥大和解体的绒毡层细胞形成周原质团侵入药室而挤压小孢子引起败育。另外,本研究还发现不育系花药绒毡层细胞在四分体时期提前降解,到二核期基本降解完全,只剩下绒毡层细胞膜和其附着的少量乌氏体,二核期不育系绒毡层细胞膜上的乌氏体明显少于保持系,且三核期不育系花粉壁与保持系花粉壁相比明显变薄,推测这可能是由于不育系绒毡层提前降解致使二核及以后时期营养物质供应不足,导致花粉细胞壁附着孢粉素减少变薄,并导致三核时期出现花粉粒质壁分离现象,最终导致花粉败育。因此,推测K型小麦雄性不育系败育可能是由于绒毡层细胞提前异常降解导致。
对于K型小麦雄性不育系的败育时期,前人研究推断K型小麦雄性不育系败育时期为单核期到三核期[27-29],从绒毡层结构变化及异常降解的角度看,本研究结果与前人报道一致,但本研究进一步发现花粉败育还可能出现在四分体时期,并推断K型小麦雄性不育系败育关键时期在四分体时期和二核期。
花粉败育与绒毡层异常发育有关的推论也得到基因表达结果的支持。Luo等[8]在水稻野败型细胞质雄性不育系中发现一个WA352突变基因,在小孢子发育时期WA352蛋白在绒毡层上积累抑制了定位于线粒体上并由核基因控制表达的COX11蛋白的代谢功能,诱导绒毡层提前降解导致花粉败育。还有研究证实,在水稻[17]和小麦[30]中天冬氨酸蛋白酶(APs)参与调控绒毡层降解的过程,导致小孢子败育。Wang等[16]发现,绒毡层分泌合成的孢粉素是小孢子发育阶段的关键蛋白,RAFTIN1基因与孢粉素转运密切相关,将RAFTIN1基因沉默后,植株出现雄性不育现象。盛 英等[31]利用生理型小麦雄性不育材料,研究发现与绒毡层降解和定向转运孢粉素的RAFTIN1的表达量高低直接相关。本研究首次对RAFTIN1和APs基因在K型小麦细胞质雄性不育系花药不同发育时期的表达模式进行了分析,发现在小孢子母细胞至单核时期,不育系花药RAFTIN1和APs基因的相对表达量都高于保持系花药,可能是由于不育系绒毡层提前降解导致。短时期释放的有效营养物质被小孢子直接吸收,孢粉素在短期内快速积累,使得不育系单核时期的小孢子细胞壁变厚。到二核期在不育系花药中的相对表达量都低于保持系,表明此时期保持系绒毡层仍能为花粉发育提供必要的营养物质,小孢子生长正常,但是不育系绒毡层提前降解导致后期小孢子营养不足,RAFTIN1的相对表达量明显低于保持系,孢粉素的转运积累减少,从而导致二核期到三核期不育系小孢子细胞壁较薄,而二核期又是小孢子聚集孢粉素的关键时期,推测二核期可能是败育的关键时期。RAFTIN1和APs基因的表达分析和细胞学结果正好相契合,故推测这两个基因很有可能参与了K型小麦雄性不育系的败育过程。本研究细胞学观察与基因表达分析结果相互印证,提高了结论的可靠性。

麦类作物学报 2018,38(12):1408-1413Journal of Triticeae Cropsdoi:10.7606/j.issn.1009-1041.2018.12.03

