灌胃中链甘油三酯不同时程对小鼠抗疲劳作用的影响
钱 平,李晓莉,韩培涛,邵剑钢,刘 晋
(1.军需工程技术研究所,北京 100010; 2.陆军勤务学院,重庆 401331; 3.93975部队,乌鲁木齐 830000)
高强度长时间的运动会导致机体肌肉力量的下降和最大输出功率的降低,产生运动性疲劳,如果疲劳得不到恢复或消除,积累到一定程度时则导致机体免疫力下降、内分泌紊乱等病变。因此,抗疲劳研究是运动医学、军事医学等领域的热点。中链甘油三酯(MCT)是由含有8~12个碳原子的饱和脂肪酸与甘油通过酯化作用形成的甘油三酯,主要指辛酸甘油三酯和癸酸甘油三酯[1]。 MCT由于特殊的结构,使得其具有消化吸收快、供能高等代谢特点和独特的生理活性。研究表明,MCT在预防肥胖、改善糖和胆固醇代谢、抑菌、抗疲劳等方面具有一定的效果,是一种新型功能油脂[2-6]。
在MCT的抗疲劳作用研究方面,齐阳[7]通过动物实验研究证明,中、低剂量的MCT可调节糖脂代谢,节约糖原,增强脂肪的动员,提高肝脏的抗氧化能力,具有抵抗运动性疲劳的作用。马双双[8]实验发现,中、低剂量的MCT能够提高睡眠剥夺大鼠的抗氧化能力,防止氧化损伤,抵抗脑力疲劳。国外有研究认为,MCT作为一种能源物质,与碳水化合物之间的协同供给可以延长能量释放,有效维持运动员在长时间运动过程中的能量需求[9]。现有研究主要集中在MCT的抗疲劳作用和剂量确定方面,但关于服用MCT不同时程对抗疲劳作用的影响尚无详细报道。本研究设计灌胃MCT不同时程小鼠的游泳疲劳模型,测定实验小鼠抗疲劳及抗氧化指标,分析灌胃MCT不同时程对小鼠抗疲劳作用的影响,并探讨MCT抗疲劳作用的最短有效时间。
1 材料与方法
1.1 实验材料
1.1.1 实验样品与动物
MCT粉剂:白色干燥松散粉末,奶油香味,无锡超科食品有限公司提供,生产日期为2016年4月1日,有效期至2018年3月31日,成品批号为43160401,检验合格证号为D04001。
小鼠:健康雄性KM小鼠,等级SPF级,体重18~22 g,共120只,由湖北省实验研究中心提供,生产许可证号为SCXK(鄂)2015-0018,质量合格证号为NO.42000600014395。饲养于湖北省食品药品安全评价中心实验动物楼(生物园区)B-313(饲养室号),SPF(无特定病原体)级屏障环境,室温20~26℃,相对湿度40%~70%,照度采用自动定时开关控制,早上8点开启,连续开启10 h下午6点关闭。常规分笼喂养,自由饮水进食。
1.1.2 实验试剂、仪器及耗材
肝/肌糖原试剂盒、GSH测试盒、SOD试剂盒、乳酸测试盒、游离脂肪酸试剂盒均购于南京建成生物工程研究所;浓硫酸和冰醋酸均为市售分析纯。
贝克曼AU680全自动生化分析仪,Multiskang O1510酶标仪,高速离心机,DK-600S三用恒温水箱,FM-20全自动雪花制冰机,Direct-Q3超纯水器,二氧化碳培养箱。
口罩,手套,滤纸,EP管,离心管,加样枪头,生理盐水,纯水等。
1.2 实验方法
1.2.1 动物分组及处理情况
适应性喂养3 d,将120只小鼠随机分成6组,分别为CC、SC、SD、FD、TD组和TH组,每组20只,然后再将每组随机分成2个小组,每个小组10只,用苦味酸打1~10号,并用电子天平称初重。分组情况见表1。
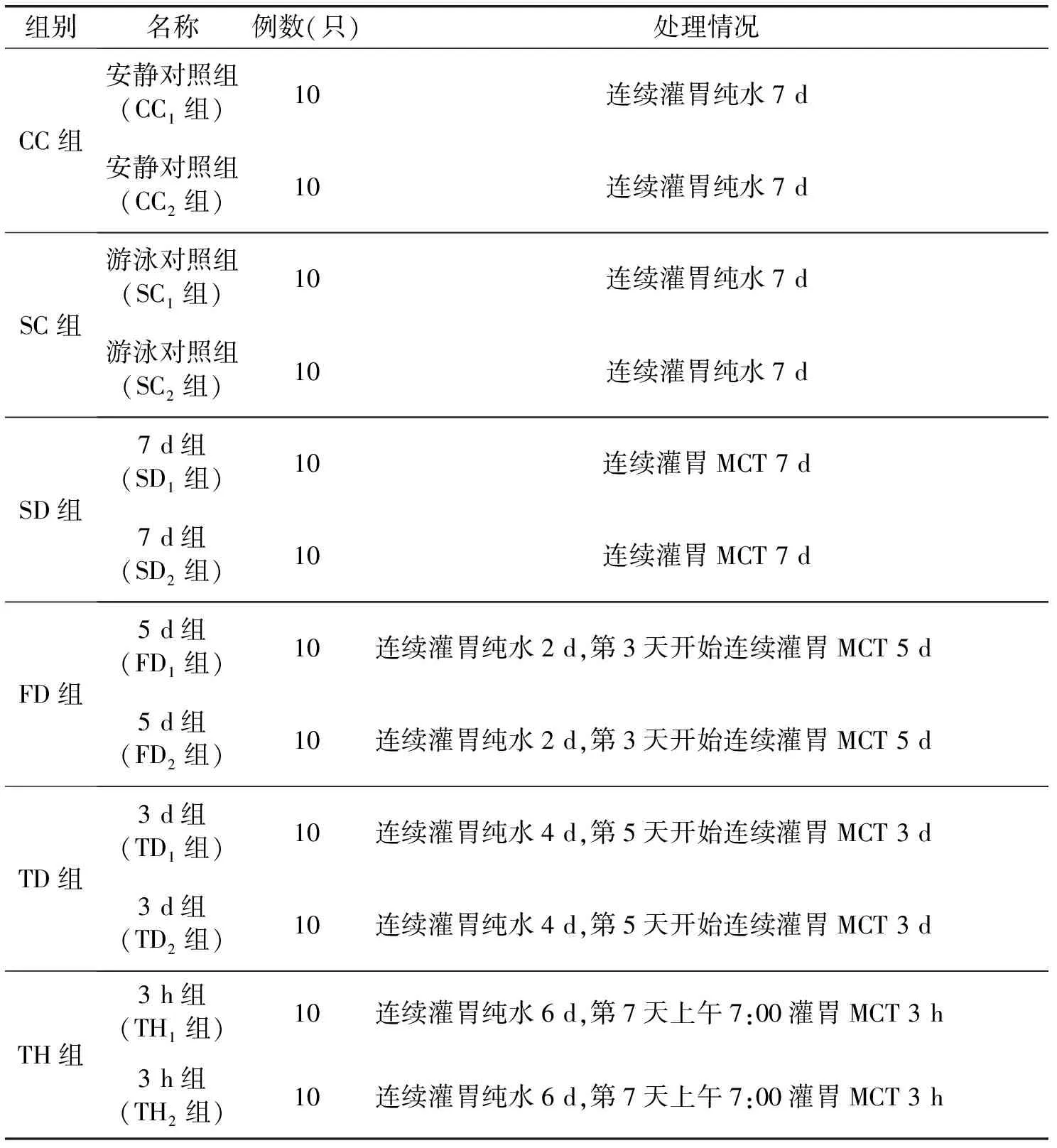
表1 实验动物分组
注:①各组小鼠均按照20 mL/(kg·d)的灌胃容量进行灌胃,MCT粉剂用纯水配制,剂量为1 250 mg/(kg·d);②前6 d每天的灌胃时间为上午9:00~10:00,第7天3 h组灌胃时间为上午7:00,其余各组灌胃时间为上午9:30,10:00进行无负重游泳60 min实验和负重游泳力竭实验。
1.2.2 游泳运动疲劳模型
1.2.2.1 无负重游泳实验
在末次灌胃30 min后,取CC1、SC1、TH1、TD1、FD1组和SD1组小鼠进行无负重游泳60 min实验,CC1组水深4 cm,其他各组水深35 cm,且各组均保持水温为25℃±1℃。在游泳的过程中不断搅拌水面使得小鼠持续运动,避免小鼠浮在水面上不游泳影响实验结果的准确性。
1.2.2.2 负重游泳实验
在末次灌胃30 min后,取CC2、SC2、TH2、TD2、FD2组和SD2组小鼠尾部负重其自身体重5%的铅皮进行负重游泳实验。CC2组小鼠水深4 cm,其余各游泳组小鼠水深35 cm,水温均为25℃±1℃,且在小鼠游泳的过程中不断搅拌水面使得小鼠持续运动。小鼠自游泳开始至游泳死亡,即视为小鼠负重游泳力竭。
1.2.3 指标测定
1.2.3.1 体重测定
实验开始及末次灌胃前称量所有组小鼠初重及末重,灌胃30 d期间每周灌胃前称量小鼠体重,根据小鼠体重调整灌胃量。
1.2.3.2 负重游泳力竭时间测定
负重游泳组小鼠自游泳开始至死亡视为力竭,用秒表记录小鼠自负重游泳开始到力竭所用时间即为小鼠负重游泳力竭时间。
1.2.3.3 生化指标测定
无负重游泳60 min后,肝糖原含量、血清乳酸(LD)含量、肝脏超氧化物歧化酶(SOD)活性和谷胱甘肽(GSH)含量以及肝脏游离脂肪酸(FFA)含量通过试剂盒进行测定;血糖(GLU)、血清尿素氮(BUN)送到检测部利用全自动生化分析仪进行检测。
1.2.4 统计分析

2 结果与讨论
2.1 灌胃MCT不同时程对小鼠体重的影响(见表2)
各组小鼠在实验期间皮毛光滑、活泼、精神状况良好,体重稳定增长,未出现有肉眼可见的异常。由表2可知,实验开始前,各组小鼠的初重均无统计学差异(p>0.05)。实验结束时,各组小鼠体重都较实验前有了稳定的增长,且各组小鼠的末重没有统计学差异(p>0.05),各组小鼠实验期间体重的增加量也无统计学意义(p>0.05)。可知,剂量为1 250 mg/(kg·d)的MCT对小鼠的体重增加没有显著性影响。

表2 灌胃MCT不同时程对小鼠体重的影响 g
2.2 灌胃MCT不同时程对小鼠负重游泳力竭时间的影响(见表3)

表3 灌胃MCT不同时程对小鼠负重游泳力竭时间的影响
注:**表示与SC2组比较,p<0.01。
由表3可知,TH2、TD2、FD2组和SD2组小鼠负重游泳力竭时间均极显著延长(p<0.01),且TH2组和SD2组较TD2组和FD2组更加明显。
实验中对于MCT抗疲劳效果的评价采用的是运动耐力实验与生化指标检测相结合的方法。运动耐力的下降是疲劳最直接和客观的表现,而力竭游泳时间是反映运动耐力的重要指标[10],因此可以通过力竭游泳时间反应小鼠的运动耐力,进而反应其抗疲劳效果。实验结果表明,急性灌胃MCT 3 h和短期灌胃MCT 3、5 d和7 d均能显著延长小鼠负重游泳力竭时间,且急性灌胃MCT 3 h和短期灌胃MCT 7 d延长小鼠力竭时间效果优于短期灌胃MCT 3 d和5 d。这可能说明长时间的灌胃刺激降低了MCT提高运动耐力的功效,使得急性灌胃MCT 3 h延长负重游泳力竭时间的效果优于短期灌胃MCT 3 d和5 d;而连续灌胃MCT 7 d可能使得MCT在机体内部提高运动耐力的生物学效能得到一定的积累,从而使得小鼠负重游泳力竭时间长于灌胃MCT 5 d和灌胃MCT 3 d。
2.3 灌胃MCT不同时程对小鼠血清BUN、LD、GLU的影响(见表4)

表4 灌胃MCT不同时程对小鼠血清生化指标的影响 mmol/L
注:*表示与CC1组比较,p<0.05;**表示与CC1组比较,p<0.01;△表示与SC1组比较,p<0.05;△△表示与SC1组比较,p<0.01。下同。
在长时间剧烈运动过程中,BUN的含量与运动负荷以及机体对运动负荷的适应能力有关,运动负荷越大,机体的适应能力越弱,BUN的含量就越大。
由表4可知,SC1组小鼠体内血清BUN的含量显著高于CC1组(p<0.05)。可能机理是:在无负重游泳60 min后,糖与脂肪供能不足时,肌肉中的蛋白质或氨基酸在酶的催化作用下经过转氨基或者脱氨基后生成游离的氨基,游离的氨基与α-酮戊二酸经过转氨基作用形成丙酮酸和谷氨酸,谷氨酸可以透过线粒体膜进入线粒体基质中,然后在谷氨酸脱氢酶的催化作用下将氨基脱去形成游离的氨,再经过尿素循环生成尿素,从而使得血中BUN含量增加;激烈运动后期核苷酸分解代谢增强产生的游离氨,经尿素循环也会使得BUN含量增加。不同时程组与SC1组相比,血清BUN的含量均降低,TH1、TD1、FD1、SD1组分别比SC1组低17%、16%、7%和12%,但是没有统计学意义(p>0.05)。结果表明,急性灌胃MCT和短期灌胃MCT在一定程度上表现出了降低耐力运动后小鼠体内血清BUN含量的趋势。
机体在正常的情况下,血糖的分解与合成处在一个动态的平衡中,在机体进行剧烈运动时,血糖的分解量大于血糖的合成量时,机体则会出现血糖含量降低,产生疲劳。本实验中,SC1组小鼠的血糖含量极显著低于CC1组(p<0.01),表明小鼠无负重游泳60 min,极大地消耗了体内的血糖,产生了疲劳。TH1、TD1、FD1组及SD1组小鼠无负重游泳60 min后,其GLU含量均高于SC1组,其中TH1组小鼠血糖的均数比SC1组高71%,且TH1、FD1、SD1组的GLU含量显著高于SC1组(p<0.01,p<0.05,p<0.01)。说明灌胃MCT不同时程在一定程度上均可以维持剧烈运动过程中血糖浓度的稳定,且随着灌胃MCT时程的延长,其稳定血糖的生物学效能越好,起到抗疲劳的作用。
血乳酸是机体在长时间运动过程中糖酵解(糖的无氧氧化)的产物。乳酸在体内的堆积可以干扰神经冲动和肌肉收缩进而导致疲劳的产生,因此血乳酸的含量可作为抗疲劳效果评价的一个敏感指标。本实验中TH1组与SC1组相比,其血乳酸含量几乎没有变化;TD1、FD1组及SD1组血清乳酸含量低于SC1组,且FD1、SD1组显著低于SC1组(p<0.05)。表明短期灌胃MCT可以减少运动中血清乳酸的生成,且随着灌胃MCT时程的延长,MCT降低血清乳酸含量的效果越明显,而急性灌胃MCT一次无法降低血清乳酸含量。
2.4 灌胃MCT不同时程对小鼠肝脏组织SOD、GSH的影响(见表5)

表5 灌胃MCT不同时程对小鼠肝脏抗氧化能力的影响
SOD是体内抗氧化系统的重要组成部分,在保护由氧自由基导致的细胞成分的直接氧化损伤中具有很重要的作用。
由表5可知,游泳对照组(SC1组)中肝脏SOD活性低于安静对照组(CC1组),表明剧烈运动会导致机体内部抗氧化酶的活性降低。有实验证明剧烈运动会增加脂质过氧化的程度,降低抗氧化酶的活性[11],与本实验结果相符。急性灌胃3 h组(TH1组)及短期灌胃3、5、7 d组(TD1、FD1、SD1组)与SC1组相比,其SOD活性几乎没有变化,表明急性灌胃MCT及短期灌胃MCT对小鼠肝脏的SOD活性几乎没有影响。
GSH是体内重要的保护因子,对保护细胞膜、线粒体膜等生物膜及蛋白质、核酸等生物大分子免受自由基的损伤起着重要的作用,GSH的含量可以作为评价机体抗氧化能力的一个重要指标。本实验中灌胃MCT不同时程组相比于SC1组,其肝脏GSH含量均有一定程度的增加,表明急性灌胃MCT和短期灌胃MCT均可以在一定程度上提升肝脏的抗氧化能力。
2.5 灌胃MCT不同时程对小鼠肝糖原和肝脏游离脂肪酸的影响(见表6)

表6 灌胃MCT不同时程对小鼠肝糖原和肝脏游离脂肪酸的影响
糖原是能量储存的一种形式,主要储存在肌肉和肝脏的细胞中,分别是肌糖原和肝糖原。在进行剧烈运动时,维持肌肉收缩的能力高度依赖于对糖原的利用,当肌糖原耗尽后,肝糖原开始分解以维持血糖浓度的稳定,肝糖原含量是与疲劳相关的一个重要指标。
由表6可知,SC1组小鼠肝糖原的含量极显著低于CC1组(p<0.01),提示无负重游泳60 min极大地消耗了小鼠体内的肝糖原,导致疲劳的产生。急性灌胃组和短期灌胃组的小鼠的肝糖原含量较游泳对照组(SC1组)均上升,且短期灌胃MCT 3、5 d及7 d有显著的统计学差异(p<0.05),说明不同灌胃时程组的MCT可以降低肝糖原的消耗,延缓疲劳的产生,且以短期灌胃组效果明显。
在长时间有氧运动中,脂肪是主要的能源物质。脂肪动员是指脂肪在脂肪酶的作用下逐步水解为游离脂肪酸(FFA)及甘油,然后进入血液中随血液流经全身为其他组织氧化供能的过程[12]。脂肪水解生成甘油和游离脂肪酸,由于肌细胞中缺乏甘油氧化代谢的酶,脂肪细胞内也缺乏甘油激酶,因此甘油氧化代谢供能并不显著[13]。脂肪供能主要是游离脂肪酸氧化供能,在氧气充足的情况下,游离脂肪酸主要在肌肉和肝脏中可完全分解成水和二氧化碳,并以ATP的形式释放出大量能量供机体利用;游离脂肪酸不完全氧化可生成酮体,酮体可以为心肌、大脑及骨骼肌等肝外组织提供能量,可以防止中枢性疲劳,节省血糖,维持机体运动能力。本实验中,SC1组小鼠肝脏游离脂肪酸的含量显著高于CC1组,表明运动时,机体脂肪分解供能作用增强。这可能是由于运动时儿茶酚胺、生长激素、胰升血糖素、皮质醇等促脂解激素的增加以及胰岛素水平的降低[14],导致脂肪水解增强。随着灌胃MCT时程的延长,小鼠肝脏中游离脂肪酸的含量也逐渐增加,且SD1组小鼠肝脏中游离脂肪酸的含量显著高于SC1组(p<0.05)。
3 结 论
实验结果表明:实验使用剂量的MCT对大鼠体重变化未产生显著性影响;MCT急性灌胃3 h和短期灌胃3、5 d及7 d均可以提高小鼠的运动耐力,起到抗体力疲劳的作用,且综合来看短期灌胃MCT 7 d 效果优于其他灌胃时程组。

