国内外特殊医学用途配方食品标准概况及技术指标比对
田洪芸,解恒杰,王冠群,任雪梅,张海红
(山东省食品药品检验研究院山东省特殊医学用途配方食品质量控制工程技术研究中心,济南250101)
0 引言
特殊医学用途配方食品是专门针对营养不良重症和慢性病患者而设计的,临床使用效果显示,它能够为医院节省费用,较少病患死亡率,同时也能降低住院相关投资,是缓解全球营养不良问题的科学性解决方案,在发达国家已有近百年的使用历史。特殊医学用途配方食品在我国起步较晚,上世纪80年以药品的形式正式进入国内市场,在其后相当长的一段时间内,一直按照药品进行注册管理,直至2010年我国才制定相关食品安全标准[1-2]。特殊医学用途配方食品所体现的“营养医学、营养治疗”理念已成为“健康中国”战略的重要组成部分,已被纳入了国家“十三五”大健康产业中,中国将成为全球最大的消费市场。特殊医学用途配方食品在世界各国均作为特殊膳食用食品进行管理,CAC、欧盟、美国、日本等国家均建立了比较完善的标准体系[3-4]。本文就相关国际组织和国家的特殊医学用途标准现状进行汇总整理,并对标准中的技术指与我国标准进行比对分析。
1 相关国际组织和国家标准现状
1.1 国际食品法典委员会
全球绝大多数国家的特殊医学用途配方食品法规都是以CAC标准为基础建立的,国际食品法典委员会将特殊医学用途配方食品称为“特殊医用食品”,是特殊膳食用食品中的一种。CAC制定了2项标准,一是《特殊医用食品标签和声称法典标准》(Codex Standard for The Labeling of and Claims For Foods For Special Medical Purpose,CODEX STAN 180-1991),二是《婴儿配方及特殊医用婴儿配方食品标准》(Standard for Infant Formula And Formulas For Special Medical Purpos Intended For Infants,CODEX STAN 72-1981,Amended 2011)。
《特殊医用食品标签和声称法典标准》规定了特殊医学用途配方食品的定义,还规定了标签和声称的方式方法。标准规定除在符合《预包装特殊膳食食品的标签和声称法典通用标准》(CODEX STAN 146-1985)的基础上,还得满足本标准的特殊规定,包括对营养标签、渗透压、正确使用和储藏方法等内容的标识方法,并特别强调“应以粗体字显著标明在医生指导下使用”。
对于1岁以下人群的特殊医用食品,CAC在《婴儿配方及特殊医用婴儿配方食品标准》中给出了规定,明确该类产品可以根据适用人群的特殊营养需求在婴儿配方食品的基础上对配方进行合理调整,对其可选择性成分如铬、钼的营养含量进行了规定。该类产品营养强化剂的使用要遵守《婴幼儿特殊膳食用食品中营养物质的参考清单》(CAC/GL10-1979)的规定。对于食品添加剂的使用,CAC明确了可用于特殊医学用途配方食品中的食品添加剂,但对于1岁以上人群的特殊医学用途配方食品,CAC尚未制定相应的产品标准。对于营养强化剂,CAC在《婴幼儿特殊膳食用食品中营养物质的参考清单》中列出了适用于1岁以下人群产品的营养强化剂使用规定[5-6]。
1.2 欧盟
欧盟将特殊医学用途配方食品作为特殊膳食用食品进行管理,有一套比较完善的管理体系,包括《特殊医用食品指令》(Dietary foods for special Medical Purpose,1992/21/EC),《可用于特殊营养目的用食品中的营养物质名单》(Substances that may be added for specific nutritional purposes in foods for particular nutritionaluses,2001/15/EC),新物质的申报程序,上市前申报及审批等。
《特殊医用食品指令》直接引用CAC标准对产品的定义,在标签标示方面,采纳CAC规定。2011年欧盟颁布的《可用于特殊营养目的用食品中的营养物质名单》对可用于特殊医学用途配方食品的营养强化剂来源做出了规定,包括化合物的来源和使用规定。对于食品添加剂的使用欧盟没有规定,只需符合食品添加剂通用标准(Food Additive,EC1333/2008)即可。若申请使用新成分/新原料,可根据欧盟《新资源食品、新原料标准》(EC NO258/97)的规定,获得欧盟食品安全局的批准[7-8]。
1.3 美国
在美国,特殊医学用途配方食品被称为医用食品。美国对于医用食品的管理相对宽松,只有《医用食品进口和生产指导手册》(Compliance Program Guidance Manual 7321.002,Medical Foods Program-Import and Domestic FY06/07/08)1项指导原则。
《医用食品进口和生产指导手册》引用联邦政府法律对医用食品的定义,明确该类食品用于特殊疾病的饮食管理,必需在医生的指导下使用,与CAC定义相似;将医用食品分为全营养配方、非全营养配方、用于1岁以上的代谢紊乱疾病人的配方食品及口服补水产品4类,同时还规定了FSMP的生产、抽样、检验和判定等多项内容[9-10]。对于医用食品中新成分/新原料的使用,美国规定必需经过GRAS的评估。新产品不需要上市前的注册和批注,只需生产厂家进行注册即可。在食品添加剂、营养强化剂、食品标签标识方面,美国对医用食品没有进行特别规定。
1.4 澳大利亚/新西兰
澳大利亚及新西兰对特殊医学用途配方食品的管理较为相似,将适用于婴儿的特殊医学用途配方食品与婴儿配方食品在同一标准中规定,共有2个标准,一是《特殊医学用途配方食品》(Food for special medical purpose,Standard2,9.5),二是《婴儿配方食品》(Infant Formula Products,Standard2,9.1)[10-12]。
《特殊医学用途配方食品》标准规定了产品定义、销售、营养素含量、标签标示4部分内容,对于定义澳新基本等同采用Codex的定义,规定1岁以下人群食用产品不属于该标准范畴,同时标准以附录的形式明确规定了营养素来源及食用量等。与其他国家标准不同的是,澳新明确经糖尿病及超重人群的配方食品不纳入特殊医学用途配方食品管理。
在标签标示方面,与Codex、欧盟相似,澳新要求特殊医学用途配方食品应符合普通食品的标签外,还必须符合本标准的规定,标识产品的营养成分及含量、渗透压,在医生和营养师的指导下使用等信息。对于一些特殊的营养成分,如乳糖、谷蛋白,还规定了对这些成分的特殊标识。对于食品添加剂,澳新没有针对特殊医学用途配方食品的特别规定,新成分/新原料的管理与普通食品相同。对于特殊疾病的婴儿配方食品,澳新纳入《婴儿配方食品管理》中进行管理,并根据不同的医学状况分别进行规定[13-14]。
1.5 日本
特殊医学用途配方食品在日本采取审批制的管理模式。《健康增进法》规定病人用特殊食品上市前需要通过日本厚生省批准。根据此规定,日本制定了病人用特殊食品的审评标准,配方包括了全营养食品、低蛋白质食品、无乳糖食品、除过敏原食品4类,《健康增进法》针对每类食品制定许可标准,许可标准中规定了各类产品中的营养素含量、说明书、标签[15-16]。
1.6 中国
我国特殊医学用途配方食品标准制定过程中参考和借鉴了国际食品法典委员会(CAC)、美国、欧盟等国际组织、国家和地区的法律法规和标准,以及国内外权威论著。2010年起,国家先后制定与国际接轨的标准体系;我国特殊医学用途配方食品标准框架与CAC、美国等国家和组织基本一致,标准对产品定义、原料要求、必需成分、可选择性成分、标签标识等内容做出了相应的要求。
2015年《中华人民共和国食品安全法》修订通过,首次明确将其作为特殊食品实施严格监管,明确了其作为食品的法律属性,同时要求进行配方注册;2016年3月,《特殊医学用途配方食品注册管理办法》颁布;2018年7月,市场监管局成立特殊食品安全监管司,并规定自2019年1月1日起生产特医食品需取得注册证书[17]。除此之外,世界上其他国家(加拿大、新加坡、越南、韩国)以及我国台湾省相继制定了特殊医学用途配方食品标准法规。上述标准大都参考了CAC标准作为指导原则,并在此基础上进一步明确和细化[18-19]。
2 相关国家和组织技术指标比对
《食品安全国家标准特殊医学用途婴儿配方食品》(GB 25593-2010)标准中对原料、感官、微生物限量、食品添加剂和营养强化剂、标签的要求与《食品安全标准婴儿配方食品》(GB 10765-2010)、CAC和欧盟的技术指标要求基本一致。但对于必需成分、可选择成分、污染物限量和真菌毒素限量的技术指标规定,与其他国家略有不同[20-21]。
2.1 必需成分
《食品安全国家标准特殊医学用途婴儿配方食品》规定的能量、蛋白质、脂肪和碳水化合物的基本含量范围参考了CAC的标准值,并我国《食品安全国家标准婴儿配方食品》中规定基本一致,但美国、加拿大、欧盟的部分营养素限量值与我国略有不同。
2.1.1 蛋白质
相关国际和组织标准中蛋白质的限量要求详见表1。

表1相关国家和组织法规标准中蛋白质含量限量要求 g/100kcal
对于蛋白质限量要求,CAC和欧盟标准中蛋白质限量要求相同,我国标准中蛋白质指标限量相对与其他组织和国家相对严格,美国、加拿大、澳新的标准上限均高于CAC、欧盟和我国标准。
2.1.2 脂肪
相关国际和组织标准中脂肪的限量要求详见表2。

表2相关国家和组织法规标准中脂肪含量限量要求 g/100kcal
对于脂肪含量限量要求,我国标准中脂肪限量要求均严于CAC及其他国家,CAC和欧盟标准中脂肪限量要求相同,美国和加拿大标准中脂肪限量相同。
2.1.3 脂肪酸
相关国家和组织脂肪酸限量要求详见表3。
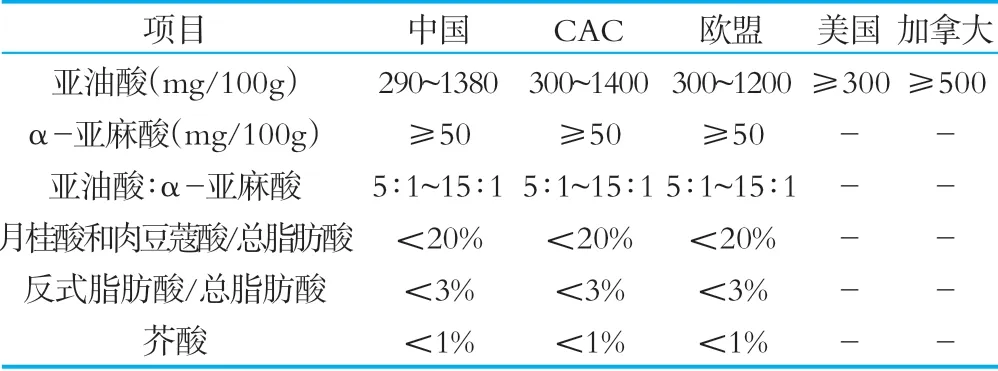
表3相关国家和组织法规标准中脂肪酸限量要求
对于脂肪含量限量要求,我国标准中亚油酸含量下限低于相关国家和组织的规定,对于α-亚麻酸、亚油酸:α-亚麻酸、月桂酸和肉豆蔻酸/总脂肪酸、反式脂肪酸/总脂肪酸和芥酸项目,我国标准与CAC和欧盟限量要求相同,但美国和加拿大对上述指标没有相关要求。
2.1.4 碳水化合物
相关国家和组织碳水化合物含量限量要求详见表4。

表4相关国家和组织法规标准中碳水化合物含量限量要求 g/100kcal
对于碳水化合物限量要求,我国标准中碳水化合物的限量要求严于CAC和欧盟,美国和加拿大标准中对碳水化合物无限量要求。
2.1.5 维生素
相关国家和组织维生素限量要求,详见表5。
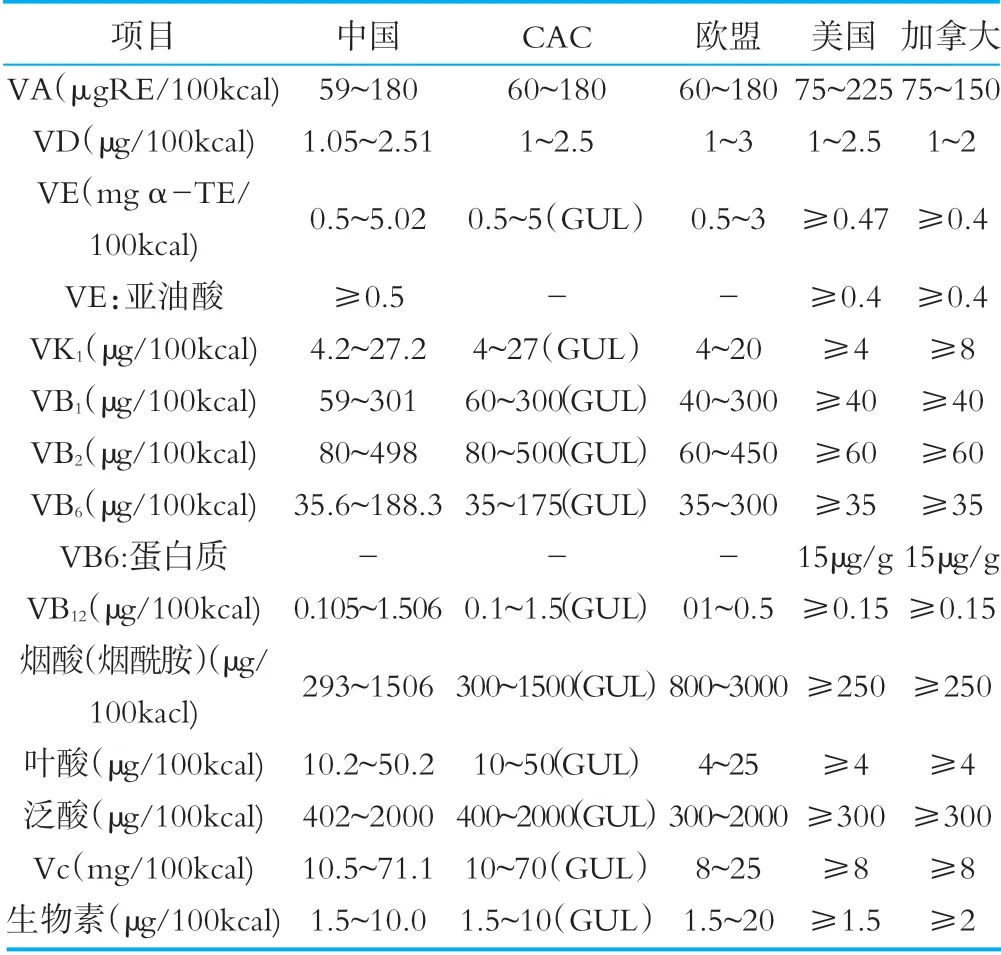
表5相关国家和组织法规标准中维生素限量要求
对于维生素的限量要求,我国与CAC和其他国家的维生素限量略有差异,CAC标准对绝大数维生素均制定了指导上限水平,我国和其他国家标准中均没有相关规定。对于VE:亚油酸项目,CAC和欧盟没有限量规定,VB6:蛋白质项目中国、CAC和欧盟无限量规定。
2.1.6 矿物质
相关国家和组织矿物质限量要求详见表6。
对于矿物质的限量要求,我国的铁、锰、硒技术指标与其他国家略有不同,我国所有矿物质元素均规定了上限和下限值,CAC标准对部分矿物质元素制定了指导上限水平值。美国和加拿大标准中绝大多数矿物质只规定了下限值。
2.2 可选择成分
除必需成分外,标准中还规定了可选择性成分,企业在实际生产中可以选择性的进行添加。我国和CAC标准中可选性成分的种类和限量要求详见表7。
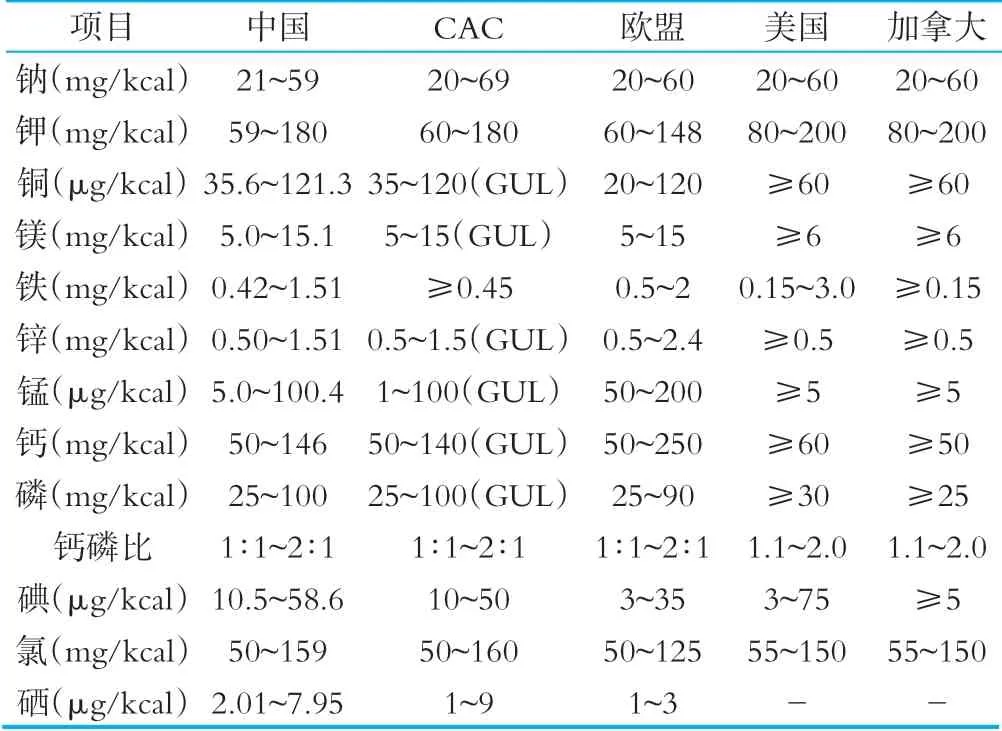
表6相关国家和组织法规标准中矿物质限量要求
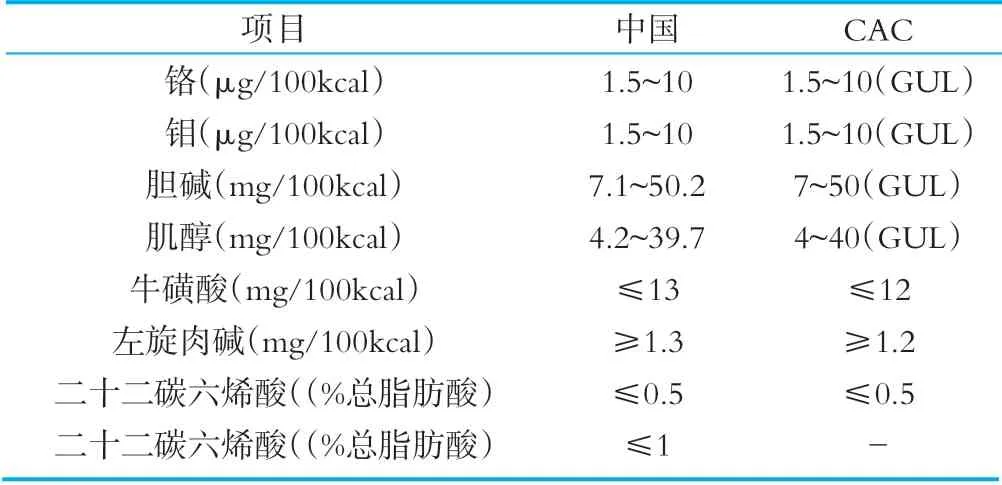
表7相关国家和组织法规标准中可选择性成分
对于可选择性成分的种类和限量要求,我国标准和CAC标准中可选择性成分的种类和限量基本一致,对于二十二碳六烯酸/(%总脂肪酸)项目,CAC标准中没有限量要求[22-23]。
2.3 污染物限量
目前,我国的食品分类体系尚未列入特殊医学用途配方食品。《特殊医学用途婴儿配方食品》对原料的要求参考了《食品安全国家标准婴儿配方食品》对铅、硝酸盐、亚硝酸盐作出限量规定,其中铅的限量为≤0.15 mg/kg。
对比欧盟食品污染物限量标准2015[No.1881/2006(201500)中3.1.4款对特殊医学用途配方食品中铅的限量为:≤0.05 mg/kg(粉状),≤0.01 mg/kg(液状)。国际食品法典委员会(CAC)标准(CODEX STAN 193-1995)中对特殊医学用途婴儿配方食品粉和婴儿配方粉中铅的限量为≤0.01 mg/kg。因此,欧盟和CAC铅的现行技术指标严于我国[24-25]。

表8相关国家和组织法规标准中污染物限量要求mg/kg
对于污染物指标,我国标准中仅规定了铅、锡、硝酸盐3种污染物的限量要求,欧盟标准中还对镉、苯丙[a]芘和多环芳烃做出了限量要求。
2.4 真菌毒素
我国相关标准认为严格控制原料的质量安全,基本能保证最终产品的安全,我国标准中仅对黄曲霉毒素M 1和黄曲霉毒素B1有限量规定。

表9真菌毒素限量 μg/kg
欧盟标准中对赭曲霉毒素A、展青霉素、脱氧学府镰刀菌烯醇、玉米赤霉烯酮和伏马毒素参考婴幼儿配方食品作出了限量规定[26]。
3 结论
目前,我国特殊医学用途配方食品相关法规和标准体系已初步完善。与其他国家的管理要求相比,我国对特殊食品实行注册管理,产品准入门槛相对较高。在标准指标限量要求方面,我国标准中营养指标与CAC、欧盟、美国等标准中绝大多数指标的规定基本一致,在部分指标规定上存在一定差异。对于污染物和真菌毒素的限量,我国标准仅规定了铅、锡、硝酸盐、黄曲霉毒素M 1和黄曲霉毒素B1的限量值,与欧盟相关规定有一定的差异。

