制备方法对CeO2/Al2O3催化CO2氧化乙苯脱氢性能的影响
檀东辰,汪全华,徐哲琦,陈树伟*,崔杏雨,乔 岩,李瑞丰*
(1.太原理工大学化学化工学院,山西 太原 030024;2.中国科学院山西煤炭化学研究所,煤转化国家重点实验室,山西 太原 030001)
苯乙烯 (ST)是最重要的有机化工基础原料之一,广泛用于生产橡胶、树脂和工程塑料等。工业上,苯乙烯主要是在大量水蒸汽存在下由乙苯 (EB)高温(600~700°C)脱氢制得[1,2]。现行工艺存在的主要问题是反应温度高和水蒸汽液化放出的大量热量难以回收,能耗巨大。因此,急需开发新工艺以解决现行工艺的高能耗问题。用CO2作为温和氧化剂取代过热水蒸汽氧化乙苯脱氢制苯乙烯,不仅可以降低反应温度和能耗,而且还可以提高乙苯脱氢效率[3]。因此,节能、高效和环境友好的CO2氧化乙苯脱氢(CO2-ODEB)新工艺受到了国内外研究者的高度关注[4-5]。
CO2氧化乙苯脱氢制苯乙烯催化剂主要有V系[6-8]和Fe系[9-11]两大类,载体主要有Al2O3、ZrO2、TiO2、SiO2等氧化物、MCM-41、SBA-15、MCF等介孔分子筛和TiO2-ZrO2、CeO2-ZrO2-Al2O3等复合氧化物材料,助剂主要有Li、K等碱金属、Ca、Mg等碱土金属和Ce、La等稀土金属。然而,积炭和活性物种还原导致催化剂的失活比较严重。CO2氧化乙苯脱氢遵循Mars-van Krevelen氧化还原机理,CeO2可以通过改变Ce3+和Ce4+价态而很快达到Ce4+/Ce3+平衡,这种特性使得CeO2可以很容易从晶格结构中储存和释放氧,因此在许多反应中表现出独特的催化性能,此外,CeO2对CO2也具有良好的活化作用[12-14]。但是,纯CeO2的热稳定性差,在高温下易烧结,导致比表面积减小甚至失去氧化还原性能[15]。Al2O3具有良好的热稳定性和机械强度,是一类使用最为广泛的催化剂载体。因此,将CeO2和Al2O3进行组合,期望获得性能良好的催化剂体系。
我们的初步研究表明,CeO2的质量分数为40%时,CeO2/Al2O3对CO2氧化乙苯脱氢反应的催化活性最高。本文在前期工作基础上,分别采用溶胶凝胶法、水热合成法和浸渍法制备CeO2质量分数为40%的CeO2/Al2O3催化剂,研究了制备方法对CeO2/Al2O3催化CO2氧化乙苯脱氢性能的影响,并结合N2吸附、XRD、H2-TPR、NH3-TPD和TGA等多种表征手段,讨论了制备方法对催化剂性能影响的原因,以期为新型高性能CO2氧化乙苯脱氢制苯乙烯催化剂的设计与制备提供指导。
1 实验部分
1.1 催化剂制备
分别采用溶胶凝胶法、水热合成法和浸渍法制备CeO2/Al2O3催化剂,催化剂中CeO2的质量分数为40%。溶胶凝胶法:将5.0900g的仲丁醇铝,加入乙醇溶液,混合并搅拌均匀,形成A溶液;将1.1170g的硝酸铈(Ce(NO3)3·6H2O)溶解于38mL无水乙醇中,形成B溶液;将A与B溶液混合搅拌均匀,将溶液放入60℃的水浴中,搅拌蒸发,并逐滴加入蒸馏水进行水解,溶液逐渐呈凝胶状,在室温静置12h,在110℃干燥3h,然后在550℃焙烧4h,所制备的催化剂标记为Ce/Al(SG)。水热合成法:将7.7600g的Al(NO3)3·9H2O溶于100mL蒸馏水中形成A溶液,再称取1.0650g的硝酸铈(Ce(NO3)3·6H2O)溶于50mL的蒸馏水中,形成B溶液,将A与B溶液混合并搅拌均匀。逐滴加入浓度为6mol/L的氨水溶液,直至溶液pH=10,转入水热合成釜中,在110℃反应72h,然后将所得溶液离心后,用蒸馏水洗涤至中性,在110℃干燥3h,然后在550℃焙烧4h,所制备的催化剂标记为Ce/Al(HS)。浸渍法:以γ-Al2O3为载体,用Ce(NO3)3溶液等体积浸渍γ-Al2O3后,静置12h,在110℃干燥3h,然后在550℃焙烧4h,所制备的催化剂标记为Ce/Al(IM)。
1.2 表征技术
催化剂的孔结构参数在美国康塔公司NOVA1200e型自动物理吸附仪上测定。样品在300℃下真空活化3h,然后在-196℃下用N2为吸附质进行测量。用BET方程计算样品的比表面积,用BJH模型计算样品的孔径及其分布。
X射线衍射(XRD)分析在日本岛津公司Shimadzu 6100型XRD仪上进行,使用Cu Kα射线(λ=0.15418nm),Ni滤波石墨单色器,管电压为40kV,管电流为30mA。扫描范围:2θ=10~80°,速度为8°/min。
H2程序升温还原(H2-TPR)在天津先权工贸公司的多功能TP-5076型吸附仪上进行测定。50mg样品在500℃用O2预处理1h,再用He气吹扫1h后降至室温,然后在7%H2/N2混合气中从室温升到800℃,用热导检测器检测耗氢量。
NH3程序升温脱附(NH3-TPD)测定在天津先权工贸公司的多功能TP-5076型吸附仪上进行。100mg样品在氦气气氛下升温至550℃,恒温活化1h,冷却至120℃,通入NH330min后,用氦气吹扫至基线走平,然后以10℃/min的速率升温至600℃,用热导检测器检测NH3的脱附量。
催化剂的积炭量测定在德国NETZSCH公司的STA449F3型热分析仪上进行。在空气气氛下,以10℃/min的升温速率从室温升至800℃。
1.3 催化剂性能测试
催化剂性能测试在固定床反应器上进行,催化剂用量0.3000g,压力0.1MPa,反应温度为550℃,乙苯进料速率为0.3mL/h,CO2与乙苯的进料摩尔比为20:1。液体产物经冰水冷凝后收集,用装有FID检测器的北京东西分析仪器有限公司的GC-4000A型气相色谱仪进行检测。
2 结果与讨论
2.1 催化剂的活性

图1 不同方法制备的CeO2/Al2O3的乙苯转化率与苯乙烯选择性
图1为不同方法制备的CeO2/Al2O3催化剂在CO2氧化乙苯脱氢反应中的催化性能。由图1可知,Ce/Al(SG),Ce/Al(HS)和Ce/Al(IM)催化剂均具有良好的苯乙烯选择性(>95.0%)。然而,催化剂活性与其制备方法密切相关。乙苯初始转化率顺序为Ce/Al(SG)>Ce/Al(IM)>Ce/Al(HS),Ce/Al(SG)催化剂上的乙苯初始转化率可达40.7%。值得注意的是,制备方法对催化剂的稳定性有明显影响,Ce/Al(HS)和Ce/Al(IM)催化剂上的乙苯初始转化率分别为33.1%和37.5%,反应12h后分别降到16.6%和11.3%,乙苯转化率损失分别达到49.8%和69.9%。与Ce/Al(HS)和Ce/Al(IM)催化剂相比,Ce/Al(SG)催化剂上的乙苯转化率从40.7%降为35.4%,12h内乙苯转化率损失仅为13.0%。这些结果表明溶胶凝胶法制备的CeO2/Al2O3催化剂具有更高的催化活性和稳定性。
2.2 催化剂的表征

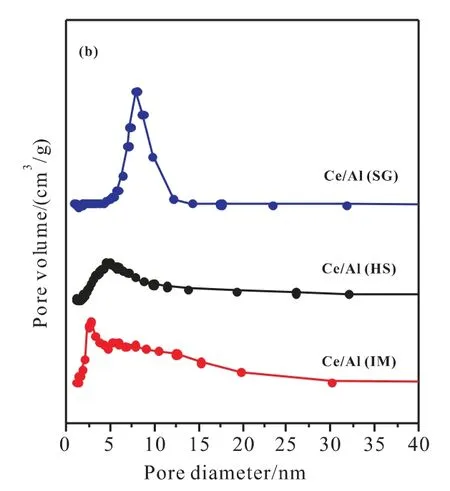
图2 不同方法制备CeO2/Al2O3的N2吸附-脱附等温线(a)和孔径分布曲线(b)
图2(a)为不同方法制备CeO2/Al2O3催化剂的N2吸附-脱附等温线。从图2(a)可以看出,各曲线属于Ⅳ型等温线[16]。其中,Ce/Al(SG)催化剂具有H1型滞后环,相对压力(p/p0)在0.6~0.9范围内发生非常陡峭的毛细凝聚现象,表明存在较大尺寸的均匀圆柱形孔道;Ce/Al(HS)催化剂具有H3型滞后环,说明其孔道为狭缝或裂缝结构;Ce/Al(IM)呈现出H4型滞后环,表明其结构不规则,可能有微孔和中孔共存。图2(b)为不同方法制备CeO2/Al2O3催化剂的孔径分布曲线。由图2(b)可知,三种催化剂的孔径大小属于介孔范围。其中,Ce/Al(SG)催化剂的的孔径分布更为集中,说明其介孔有序度较高[17]。表1总结了不同方法制备CeO2/Al2O3催化剂的织构性质。由表1可知,Ce/Al(HS)与Ce/Al(IM)催化剂,尤其是Ce/Al(IM)的比表面积与平均孔径均较小;Ce/Al(SG)催化剂具有最大的比表面积和平均孔径,分别为271m2/g和7.91nm。高的比表面积有利于活性组分的高度分散,大的孔径有利于苯乙烯的扩散,可抑制脱氢过程中类石墨型积炭的生成,从而提高了催化剂的活性和稳定性。

表1 CeO2/Al2O3催化剂的织构性质和酸位分布

图3不同方法制备CeO2/Al2O3的XRD谱图
图3为不同方法制备CeO2/Al2O3催化剂的XRD谱图。从图3可以看出,Ce/Al(HS)和Ce/Al(IM)催化剂上都出现了晶体CeO2的衍射峰,并且Ce/Al(HS)比Ce/Al(IM)催化剂具有更强的CeO2晶体衍射峰强度,说明CeO2在Ce/Al(IM)催化剂上具有更好的分散性能。Ce/Al(SG)催化剂中未检测到CeO2的衍射峰,说明CeO2在Ce/Al(SG)催化剂上呈高度分散状态。这些结果表明制备方法对CeO2活性组分的分散性有很大影响,溶胶凝胶法显著提高了CeO2的分散度。

图4 不同方法制备CeO2/Al2O3的NH3-TPD图
图4为不同方法制备CeO2/Al2O3催化剂的NH3-TPD谱图。一般认为处于100~250℃的脱附峰对应弱酸位,250~350℃区间的脱附峰对应中强酸,高于350℃的脱附峰属于强酸位[18]。将三种催化剂的NH3-TPD谱图进行弱酸、中强酸和强酸谱峰拟合,各催化剂上的酸位分布结果见表1。由表1可知,三种催化剂的中强酸和强酸酸性中心明显不同。Ce/Al(SG)催化剂表面存在最多的中强酸酸性中心,明显优于Ce/Al(IM)和Ce/Al(HS)催化剂,而其表面的强酸酸性中心最少。

图5不同方法制备CeO2/Al2O3的H2-TPR谱图
图5为不同方法制备CeO2/Al2O3催化剂的H2-TPR谱图。如图5所示,Ce/Al(IM)、Ce/Al(HS)和Ce/Al(SG)分别在525℃、534℃和552℃出现一个还原峰,归属于CeO2→CeOx的还原[19,20]。与Ce/Al(IM)和Ce/Al(HS)相比,Ce/Al(SG)催化剂的还原峰移向更高温度,表明Ce/Al(SG)催化剂中铈氧化物与载体的相互作用更强,导致了CeO2的高度分散,这与XRD的表征结果一致。
2.3 催化剂的脱氢性能
对于CO2氧化乙苯脱氢制苯乙烯反应,铈基催化剂遵循Mars-van-Krevelen氧化还原反应机理,并且高价态的Ce4+物种是催化剂的活性位[12]。结合N2吸附,XRD和H2-TPR表征结果可知,Ce/Al(SG)催化剂具有高的比表面积和强的金属氧化物-载体相互作用,活性铈物种的分散度较高,催化剂表面存在更多的反应物吸附活化位点,从而对CO2氧化乙苯脱氢反应表现出高的催化活性。Ce/Al(HS)和Ce/Al(IM)催化剂上CeO2晶体的形成导致反应活性位点减少,因此催化活性降低。此外,催化剂表面的中强酸酸性中心有利于乙苯的吸附活化,可提高其催化活性。如图4和表1所示,Ce/Al(SG)催化剂表面的中强酸酸性中心最多,而Ce/Al(HS)和Ce/Al(IM)催化剂上的中强酸酸性中心明显减少,中强酸酸性中心数量顺序为Ce/Al(SG)>Ce/Al(IM)>Ce/Al(HS),与催化剂的初始活性顺序完全一致(图1)。因此,Ce/Al(SG)催化剂表面存在丰富的中强酸酸性中心是其具有高催化活性的另一原因。
Ce/Al(SG)催化剂表现出良好的稳定性(图1),高度分散的Ce4+物种是CO2-ODEB的活性中心。根据Mars-van-Krevelen机理,Ce4+和Ce3+之间的氧化还原循环性能对CO2-ODEB至关重要[8,10]。CeO2/Al2O3催化剂上CO2氧化乙苯脱氢的反应机理如图6所示。高价态铈物种的晶格氧脱去乙苯乙基上的两个氢原子,生成苯乙烯(ST)和H2O,Ce4+物种则还原为Ce3+物种;与此同时,CO2再氧化Ce3+为Ce4+,同时生成CO,完成活性晶格氧物种的氧化还原循环。与Ce/Al(HS)和Ce/Al(IM)相比,Ce/Al(SG)催化剂具有更强的金属氧化物-载体相互作用(图5),起到了稳定Ce4+物种的作用,抑制了Ce4+到Ce3+的还原过程,因此表现出良好的催化剂稳定性。

图6 CeO2/Al2O3催化CO2氧化乙苯脱氢的氧化还原反应机理
积炭是CO2氧化乙苯脱氢催化剂失活的另一重要原因。反应12h后Ce/Al(SG)、Ce/Al(IM)和Ce/Al(HS)催化剂的TGA结果见图7。从图7看出,Ce/Al(SG)与Ce/Al(HS)催化剂均有两段积炭失重线,对应两种积炭类型,在200~400℃燃烧掉的是一种轻质炭,在400~700℃燃烧掉的是类石墨的炭[21]。对应的催化剂的织构性质和积炭量见表2。与Ce/Al(IM)和Ce/Al(HS)相比,尽管反应后Ce/Al(SG)催化剂的总积炭量最大,但主要是以轻质炭形式存在,类石墨积炭量最低。轻质炭在反应过程中易被消除,其对催化剂活性影响较小,而类石墨炭难以消除,会覆盖催化剂表面的活性位点,导致催化剂严重失活。Ce/Al(SG)催化剂具有更大的比表面积与孔径以及较少的强酸酸性位(表1),产物苯乙烯容易扩散到孔外,抑制了类石墨积炭的生成,从而提高了催化剂的稳定性。

图7 反应12h后的不同方法制备CeO2/Al2O3的TGA谱图

表2 反应12h后的不同方法制备CeO2/Al2O3的织构性质和积炭量
3 结论
与水热合成法和浸渍法相比,溶胶凝胶法制备的CeO2/Al2O3催化剂在CO2氧化乙苯脱氢反应中表现出更高的活性和稳定性。溶胶凝胶法制备的CeO2/Al2O3催化剂不仅具有更大的比表面积、强的金属氧化物-载体相互作用和中强酸酸性中心,提高了活性铈物种的分散度和乙苯的吸附性能,抑制了铈物种的深度还原,而且具有更大的介孔孔径和较弱的强酸酸性中心,促进了产物苯乙烯的脱附,减缓了类石墨炭的生成,从而提高了CeO2/Al2O3的催化剂性能,尤其是提高了CeO2/Al2O3的稳定性。

