菟丝子总黄酮提取工艺及其抗氧化活性
秦晶晶,钱慧琴,魏 婧,高 利,袁铁峰,闫福林
(新乡医学院三全学院,河南新乡 453200)
菟丝子为旋花科植物南方菟丝子(CuscutaaustralisR. Br.)或菟丝子(CuscutachinesisLam.)的干燥成熟种子[1]。中药菟丝子始载于《神农本草经》,并列为上品,其味甘性温,归肝、肾、脾经,具有补肾益精、止泻安胎、养肝明目之功效,是中医壮阳、补肾、固精之要药[2-3]。研究发现,菟丝子的主要有效成分为黄酮类、多糖、木脂素等,其中黄酮类成分具有抗氧化、清除自由基、抗癌防癌、改善心脑血管循环和调节血压等作用[4-7],具有很高的营养保健价值。
目前对菟丝子总黄酮提取的研究有一些报道,一般采用回流提取法、超声提取法、冷浸法、超声波协同复合酶等方法提取菟丝子中总黄酮[8-11],秦晶晶等[6]比较回流提取法、超声提取法、冷浸法、微波辅助提取法和索氏提取法提取菟丝子中总黄酮得率,发现得率由高到低依次为:回流提取法、微波辅助萃取法、索氏提取法、超声提取法、冷浸法。回流提取方法具有简便易行、溶剂可回收利用、经济节约、提取率高的优点。但响应面曲法优化菟丝子中总黄酮回流提取工艺及其体外抗氧化性研究未见文献报道。
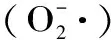
1 材料与方法
1.1 材料与仪器
菟丝子 安徽亳州市药材总公司提供,新乡医学院药学院中药学教研室鉴定为旋花科植物(CuscutaaustralisR. Br.)的干燥成熟种子;芦丁对照品 购自中国食品药品检定研究院(批号:100080-201408);1,1-二苯基-2-苦基肼自由基(DPPH) 购自东京化成工业株式会社(CAS:1898-66-4);95%乙醇、NaNO2、FeSO4、焦性没食子酸等试剂均为分析纯 购于天津市德恩化学试剂有限公司。
电子分析天平 上海象平仪器仪表有限公司;SG-4054型数控精密恒温水浴锅 上海硕光电子科技有限公司;KQ5200DE型数控超声波清洗器 昆山市超声仪器有限公司;R206型旋转蒸发仪 上海申生科技有限公司;SHZ-3型循环水式真空泵 郑州杜甫仪器厂;101-8型电热鼓风恒温干燥箱 江苏金坛市佳美仪器有限公司;T6新世纪紫外可见分光光度计 北京普析通用仪器有限责任公司。
1.2 实验方法
1.2.1 菟丝子总黄酮的提取 菟丝子在60 ℃恒温干燥箱中干燥6 h,烘至恒重,粉碎,过40目筛,得菟丝子粉;称取0.1 g菟丝子粉置于圆底烧瓶中,在一定的提取温度、乙醇液料比、乙醇浓度和提取时间的条件下进行总黄酮的回流提取,然后将得到的提取液抽滤,定容至25 mL容量瓶,备用。
1.2.2 总黄酮的测定
1.2.2.1 芦丁标准曲线的绘制 精密称取芦丁对照品25 mg,置于50 mL容量瓶中,加入少量95%乙醇溶解并定容至刻度,摇匀即得芦丁对照品溶液(5 mg/mL)。精密吸取芦丁对照品溶液0.2、0.4、0.6、0.8、1.0、1.2 mL,分别置于10 mL具塞试管中,各加水至5.0 mL,分别加入5%亚硝酸钠0.6 mL,摇匀,放6 min,加入10%硝酸铝0.6 mL,摇匀后放置6 min,加入4% NaOH 3.0 mL,加水至刻度,摇匀后放置15 min。于506 nm波长处测定吸收度A[9],以芦丁浓度C(μg/mL)为横坐标,吸收度A为纵坐标,绘制标准曲线,y=0.0107x+0.0254,R2=0.9997。
1.2.2.2 菟丝子总黄酮的测定 准确量取样品溶液0.8 mL于10 mL比色管中,按照“1.2.2.1”中所述方法进行操作,按下式计算黄酮得率。
式中:W表示黄酮得率,mg/g;c表示根据吸光度值计算出的溶液质量浓度,mg/mL;D表示溶液稀释倍数;m表示药材取样量,g。
1.2.3 单因素对黄酮提取量的影响 考察单因素乙醇浓度(50%、60%、70%、80%、90%),提取温度(50、60、70、80、90 ℃),料液比(1∶5、1∶10、1∶20、1∶30、1∶40 g/mL),提取时间(30、60、90、120、150 min)对黄酮提取量的影响,乙醇浓度、提取温度、料液比和提取时间四个因素的固定水平分别为70%、70 ℃、1∶30 g/mL、60 min,在对各因素进行单因素实验探究时,其他因素均取固定水平。
1.2.4 响应面实验设计 在单因素实验结果基础上,按照Box-Benhnken中心组合实验设计原理,采用Design-Expert 8.0.6软件设计响应面实验。本实验以总黄酮提取量为响应值,选取乙醇浓度(A)、提取温度(B)、料液比(C)、提取时间(D)四因素三水平进行试验设计,因素水平见表1。

表1 响应面试验因素水平表Table 1 Factors and levels of response surface experiment
1.2.5 菟丝子总黄酮体外抗氧化试验
1.2.5.1 菟丝子总黄酮对DPPH自由基清除活性的测定 将最佳工艺条件下得到菟丝子总黄酮浓缩液为原料液,并加无水乙醇配制成质量浓度分别为0.03、0.06、0.08、0.10、0.14、0.20、0.24、0.26 mg/mL的样品溶液。参考焦坤鹏等[17]的方法进行DPPH清除活性的测定,并以抗坏血酸作为参照比较效果,按以下公式计算清除率及IC50。
1.2.5.2 菟丝子总黄酮对羟自由基清除活性的测定 将最佳工艺条件下得到的菟丝子总黄酮浓缩液加无水乙醇配制成质量浓度分别为0.5、1.0、1.5、2.0、2.5、3.5、4.5、5.0 mg/mL的样品溶液。参考文献[18-20]进行羟自由基清除活性测定,同时与抗坏血酸对比,按以下公式计算清除率及IC50。
1.2.5.3 菟丝子总黄酮对超氧自由基清除活性的测定 将最佳工艺条件下得到的菟丝子总黄酮浓缩液为原料液,并加无水乙醇配制成质量浓度分别为0.01、0.03、0.06、0.08、0.10、0.14、0.20、0.24、0.26 mg/mL的样品溶液。采用邻苯三酚自氧化法,参考文献[21-23]进行超氧自由基清除活性测定并与抗坏血酸作比较,按以下公式计算清除率及IC50。
1.3 数据统计分析
采用Microsoft Excel 2007、Design Expert 8.0.6软件进行实验数据处理、分析及绘图。
2 结果与分析
2.1 单因素实验结果
2.1.1 不同乙醇浓度对菟丝子黄酮提取工艺的影响 由图1可知,当乙醇浓度为50%~80%时,所提取黄酮质量随着乙醇浓度增大而增加,当乙醇浓度达到80%时,黄酮得率最高,为23.36 mg/g。而当乙醇浓度大于80%时,黄酮得率反而减小,这可能因为当乙醇浓度达到一定程度之后可能会影响黄酮类溶解性及其醇溶性杂质、色素增多,这些杂质会与黄酮竞争溶剂,导致黄酮类化合物的溶解度降低。因此,选择乙醇浓度70%~90%进行响应面优化试验。

图1 不同乙醇浓度对菟丝子黄酮提取工艺影响Fig.1 The effects of different ethanol concentrations on extraction process of total flavonoids from Cuscuta chinesis
2.1.2 不同提取温度对菟丝子黄酮提取工艺的影响 由图2可知,当提取温度为50~80 ℃时,菟丝子黄酮得率随着提取温度的升高而升高,当温度达到80 ℃时,总黄酮得率达到最大,为26.82 mg/g。当提取温度高于80 ℃,黄酮得率反而降低,这可能由于温度升高导致分子运动增加,使黄酮与溶剂接触增加,故黄酮得率增加,但温度太高的话,会导致部分黄酮氧化,使黄酮得率降低。因此,选择提取温度70~90 ℃进行响应面优化试验。

图2 不同温度对菟丝子黄酮提取工艺影响Fig.2 The effects of different extraction temperatures on extraction process of total flavonoids from Cuscuta chinesis
2.1.3 不同料液比对菟丝子黄酮提取工艺的影响 由图3可知,随着提取料液比的增加,菟丝子中总黄酮得率也增加,当料液比为1∶10 (g/mL)时,菟丝子总黄酮得率达到最大,为26.82 mg/g。再继续加大提取料液比,菟丝子中总黄酮得率反而降低。其原因可能是在料液比为一个合适范围时,随料液比的增加会促进黄酮物质的溶出,而料液比过高时,会加大其他杂质的溶出或者部分黄酮类化合物与溶剂长时间接触会导致结构破坏,使得黄酮得率降低。因此选择料液比为1∶5~1∶15 (g/mL)进行响应面优化试验。

图3 不同料液比对菟丝子黄酮提取工艺影响Fig.3 The effects of different material-liquid ratios on extraction process of total flavonoids from Cuscuta chinesis
2.1.4 不同提取时间对菟丝子黄酮提取工艺的影响 由图4可知:提取时间在30~90 min时,总黄酮得率随着提取时间延长而明显增加;提取时间为90 min时,总黄酮得率达到最大,为26.89 mg/g;提取时间超过90 min时,黄酮得率随着时间的增加反而降低,这可能是由于乙醇具有挥发性,时间越久乙醇浓度越小,提取溶剂极性变大,导致一些极性小的黄酮类化合物析出来,从而使测得黄酮类化合物的含量偏低。因此选择提取时间80~100 min进行响应面优化试验。

图4 不同提取时间对菟丝子黄酮提取工艺影响Fig.4 The effects of different extraction time on extraction process of total flavonoids from Cuscuta chinesis
2.2 Box-Behnken响应面试验结果与分析
2.2.1 响应面回归模型建立与分析 采用Box-Behnken 的中心组合原理为依据,以乙醇浓度(A)、料液比(B)、提取时间(C)、提取(D)为自变量,总黄酮得率为因变量,采用4因素3水平响应面优化提取工艺,利用统计学分析软件Design Expert 8.0.6软件建立数字回归模型,确定菟丝子总黄酮最佳提取工艺条件,结果见表2。利用软件对试验结果进行二次多项式回归模型方程拟合,获得的回归模型方程如下:

表2 响应面实验结果及分析Table 2 Results and analysis of response surface experiment
Y=17.24-0.72+3.66B+2.52C-0.54D+3.57AB-2.78AC-1.89AD-1.33BC+0.81BD-1.39CD+2.92A2+1.06B2+3.08C2+2.68D2

由4个影响因素的F值大小可以得出,各因素对菟丝子总黄酮得率的影响顺序为提取温度>料液比>乙醇浓度>提取时间,提取温度对菟丝子总黄酮得率有较大影响。模型一次项D与交互项BD差异不显著(P>0. 05);一次项B、C,交互项AB、AC、AD以及二次项A2、C2、D2对菟丝子总黄酮得率均有极显著的影响(P<0.01);一次项A,交互项BC、CD,二次项B2具有显著的影响(P<0.05)。
2.2.2 响应面交互作用分析与优化 响应曲面坡度越陡峭,说明响应值对于该因素的改变越敏感,而曲面坡度越平滑,该因素的改变对响应值的影响也就越小,各因素交互作用对菟丝子中总黄酮得率影响的响应曲面以及等高线如图5所示。在有交互作用的影响下,乙醇浓度和料液比,乙醇浓度和提取时间,乙醇浓度和提取温度,料液比和提取温度,提取时间和提取温度其曲线比较陡,表明该因素对菟丝子总黄酮的提取的交互影响作用显著,而料液比和提取时间、交互影响作用不显著,这与表3中交互项值的分析一致。

表3 回归模型的方差分析Table 3 Variance analysis of regression model

图5 各因素交互作用总黄酮得率的响应面与等高线图Fig.5 Response surface plot showing the interactive effects of total flavonoids
2.3 最佳提取条件的确定及验证
通过软件对二次多项式回归方程进行分析预测,乙醇回流提取菟丝子总黄酮的最佳提取工艺条件:乙醇浓度为90.0%,提取温度为70.41 ℃,提取时间为99.83 min,料液比为 1∶14.99 (g/mL)。综合考虑将其最佳工艺条件调整为乙醇浓度90%,提取温度为70 ℃,提取时间为100 min,料液比为 1∶15 g/mL,以此条件下对建立的数学模型进行验证试验,结果见表4。获得的菟丝子总黄酮得率的实际测得值为(34.65±0.02) mg/g,预测值为34.37 mg/g,预测误差为0.81%,小于3%,因此,证实了预测值的准确可靠。

表4 最优条件的预测值和实测值(n=3)Table 4 The predicted value and measured value of the optimal conditions(n=3)
2.4 菟丝子总黄酮体外抗氧化活性
2.4.1 菟丝子总黄酮对 DPPH·清除作用 由图6可知,在选定浓度0.03~0.20 mg/mL范围内其清除能力随总黄酮浓度的提高而增强,当浓度增加为0.24 mg/mL,清除率达到98.68%,此后其清除率基本趋于平衡。根据SPSS 20.0软件数据分析,得到菟丝子总黄酮IC50=0.067 mg/mL和抗坏血酸的IC50=0.082 mg/mL,这说明在相同浓度下,菟丝子总黄酮对DPPH·清除率略高于抗坏血酸。

图6 不同浓度的菟丝子总黄酮和抗坏血酸对DPPH的清除率Fig.6 DPPH· scavenging activities of different concentrations of ascorbic acid and total flavonoids
2.4.2 菟丝子总黄酮对·OH的清除作用 由图7可知,在选定浓度0.5~5.0 mg/mL范围内其清除能力随总黄酮浓度的提高而增强,当浓度增加为4.5 mg/mL,清除率达到40.42%,此后其清除率增加不明显,基本趋于平衡。根据SPSS 20.0软件数据分析,得到菟丝子总黄酮IC50=7.209 mg/mL和抗坏血酸的IC50=1.731 mg/mL,这说明在相同浓度下,菟丝子总黄酮对·OH清除率比抗坏血酸弱。

图7 不同浓度的菟丝子总黄酮和抗坏血酸对·OH的清除率Fig.7 ·OH scavenging activities of different concentrations of ascorbic acid and total flavonoids

图8 不同浓度的菟丝子总黄酮和抗坏血酸对的清除率 scavenging activities of different concentrations of ascorbic acid and total flavonoids
3 结论
本文通过回流提取法提取菟丝子中总黄酮,在单因素实验的基础上,利用响应曲面法对菟丝子总黄酮提取工艺进行优化,实验获得的最佳提取工艺条件为:乙醇浓度为90%,提取温度为70 ℃,提取时间为100 min,料液比为 1∶15 (g/mL),获得的菟丝子总黄酮得率的实际测得值为(34.65±0.02) mg/g,预测值为34.65 mg/g,预测误差为0.81%,说明采用Box-Behnken方法优化提取总黄酮工艺行之有效,为以后菟丝子总黄酮的产业化提供指导。
体外抗氧化活性研究表明,菟丝子总黄酮对 DPPH·、羟自由基和超氧阴离子自由基的IC50值分别为:0.067、7.209、0.119 mg/mL,具有较强的体外抗氧化活性,为其在食品、药品等领域开发天然抗氧化剂提供一定的理论依据。

