坛紫菜干品色差测定条件的优化研究
(宁波大学食品与药学学院,浙江宁波 315211)
坛紫菜(Pyropiahaitanensis)是一种重要的经济藻类,占我国紫菜总产量75%左右[1-2]。紫菜是一种低脂肪、低热量、高蛋白、高膳食纤维的食品,并含有抗氧化、降血糖、降血脂、抗肿瘤等生物活性成分[3-4]。
色泽作为坛紫菜重要的品质指标之一,影响它的商业价值[5]。相关研究表明不同品种、不同子代、不同生长环境的紫菜在叶绿素、藻红蛋白、藻蓝蛋白、别藻蓝蛋白等色素组成和含量上存在显著差异,因而会产生色泽上的差别,进而影响紫菜的品质[6-9]。目前,判别紫菜品质常用的感官评定法受评定人员主观因素影响较大,且步骤繁琐,易产生偏差。孙彬[10]认为可将叶绿素a含量作为初步判别紫菜品质优劣的依据,但该方法在实际应用中存在如测定周期长、操作复杂等缺陷,无法进行快速判断。色差法具有便捷、快速、价格低等优点,被广泛应用于植物油[11]、肉类[12]、葡萄酒[13]等食品领域的检测与评价。国内学者研究坛紫菜色泽品质主要通过总色差进行对比,国外学者对紫菜色差测定的研究过程中会进行颗粒化处理,前者无法体现色泽的具体变化情况,而后者在一定程度上破坏了紫菜的完整性[5,14]。因此,有待于进一步的研究坛紫菜干品的色差测定方法。同时,肉类色差测定条件已有大量的研究,其中衣文正等[15]研究肉色测定过程时发现测量温度、观测时间等因素影响色差仪测定肉色的精度,魏心如等[16]研究光照强度和背景色对鸡肉肉色的测定影响,发现白色背景最佳。因此,根据坛紫菜干品特性使用色差仪进行色差测定时要考虑到外界光照强度、温度、湿度、背景色和坛紫菜片数等因素的影响。然而,不同测定条件对坛紫菜干品的颜色测定结果的影响还没有相关报道。
本试验通过研究上述因素对坛紫菜干品色差测定结果的影响,并采用正交试验选择色差测定的最优条件,提高色差测定结果的稳定性。利用不同条件对三水坛紫菜[7,10]进行处理,获得不同品质等级的坛紫菜,通过对叶绿素、藻蓝蛋白、别藻蓝蛋白、藻红蛋白等含量测定和色差测定,验证色差测定条件的稳定性以达到规范坛紫菜干品色差测定条件的目的,从而为实际应用中产品色差的测定提供技术支持。
1 材料与方法
1.1 材料与仪器
坛紫菜干品 大小为19 cm×21 cm,厚度0.3 mm,2018年11月购自浙江省象山县红卫塘紫菜专业合作社;PBS磷酸缓冲液(pH=7.0) 美国海克隆公司;丙酮 分析纯,国药集团化学试剂有限公司;实验所用试剂 均为分析纯。
CR-400色差仪 日本柯尼卡美能达公司;GXZ型智能光照培养箱 宁波江南仪器厂;CH918RB全自动环保除湿机 美国森井电器股份有限公司;UV1200紫外可见分光光度计 上海美谱达有限公司;AL204电子天平 梅特勒-托利多仪器有限公司。
1.2 实验方法
1.2.1 样品的制备 挑选外观、色泽、气味均较优的坛紫菜干品,将坛紫菜尽量平整置于大小为20 cm×22 cm,并均匀分布20个直径不小于30 mm的圆形测试孔的样品夹中备用。
1.2.2 测定条件对坛紫菜干品色差测定结果的影响
1.2.2.1 光照对色差测定结果的影响 采用单因素实验,测定温度15 ℃,低湿度条件,测定背景色为白色,坛紫菜片张数4张时,利用智能光照培养箱设定0(黑暗)、2000、4000、6000、8000 lx等5个光照强度模拟色差仪使用的环境。参照Lee等[17]的方法用标准白板进行色差仪调标,随机选择10组坛紫菜干品,每组坛紫菜正反面重复测量5次,计算平均值得L*、a*、b*值和变异系数[14,18]。变异系数按以下公式进行计算[18]:
RCV(%)=RSD/RMN×100
式中:RCV表示各色差值的变异系数,%;RSD表示各色差值的标准偏差;RMN表示各色差值的平均值。
1.2.2.2 温度对色差测定结果的影响 在黑暗、低湿度条件,测定背景色为白色,坛紫菜片张数4张时,设定10、15、20、25、30 ℃等5个温度梯度,进行坛紫菜干品各色差值测定。其余条件、样品数量及数据处理方法同1.2.2.1。
1.2.2.3 湿度对色差测定结果的影响 在黑暗、测定温度15 ℃,测定背景色为白色,坛紫菜片张数4张时,设定高(60%~80%)、中(40%~60%)、低(40%以下)等3个湿度范围,进行坛紫菜干品各色差值测定。其余条件、样品数量及数据处理方法同1.2.2.1。
1.2.2.4 背景色对色差测定结果的影响 在黑暗、测定温度15 ℃,低湿度条件,坛紫菜片张数4张时,设定白色、黄色、红色、蓝色等4个背景色,进行坛紫菜干品各色差值测定。其余条件、样品数量及数据处理方法同1.2.2.1。
1.2.2.5 坛紫菜片张数对色差测定结果的影响 在黑暗、测定温度15 ℃,低湿度条件,测定背景色为白色时,设定1、2、3、4、5张等5个坛紫菜片张数梯度,进行坛紫菜干品各色差值测定。其余条件、样品数量及数据处理方法同1.2.2.1。
1.2.3 正交试验 在单因素实验的基础上,设置光照(A)、温度(B)、湿度(C)三个因子,每个因子设3个水平进行测定,通过正交试验,以L*、a*、b*值的变异系数为考察指标,确定坛紫菜干品色差测定的最适条件,正交因素水平表见表1。

表1 正交试验因素水平表Table 1 Factors and levels of the orthogonal array design
1.2.4 坛紫菜干品色差与品质相关性分析
1.2.4.1 坛紫菜干品组别设置和制备 实验分设为Ⅰ、Ⅱ、Ⅲ三个组,每组12个平行。Ⅰ组:不做任何处理;Ⅱ组:室温,避光储存7 d;Ⅲ组:55 ℃,8000 lx光照下储存7 d。
1.2.4.2 品质测定 各组坛紫菜样品的L*、a*、b*值,参考1.2.3测定条件。
藻红蛋白、藻蓝蛋白、别藻蓝蛋白提取:根据文献[19],取0.1 g坛紫菜放入研钵加液氮充分研磨,加入8 mL磷酸缓冲液超声波破碎10 min,于-20 ℃放置2 h,4 ℃解冻混匀后离心,取上清液进行测定。叶绿素提取:根据文献[19],取0.1 g坛紫菜经液氮充分研磨,加入15 mL 90%丙酮溶液于4 ℃黑暗提取20 min,10000 r/min离心10 min取上清液。按下式进行含量计算:
藻红蛋白含量(PE,μg·mL-1)=155.8A498 nm-40.0A614 nm-10.5A651 nm
藻蓝蛋白含量(PC,μg·mL-1)151.1A614 nm-99.1A651 nm
别藻蓝蛋白含量(APC,μg·mL-1)=181.3A651 nm-22.3A614 nm
叶绿素含量(μg·mL-1)=11.64A663 nm-2.16A645 nm+0.16A630 nm
1.2.4.3 感官评定 感官评定小组由15名进行相关训练的人员构成,评定在感官评定室内进行,室内光线要求均匀统一。在进行感官评定实验前1 h,感官小组成员不得进食除纯净水以外的食物。每个样品按外观、色泽、气味、口感进行评分,评定成员独立打分,每进行一个样品的测定时纯净水漱口,每个样品评定间隔时间为1 min。参考干紫菜国家标准[20]对感官评价的方法略作改进,制定感官评价标准如表2。

表2 坛紫菜干品感官评价标准Table 2 The sensory evaluation standards of dried laver
1.2.4.4 Pearson相关性分析 采用Pearson相关性分析坛紫菜干品的L*、a*、b*值与藻红蛋白、藻蓝蛋白、别藻蓝蛋白、叶绿素、外观、色泽和感官评定各分值之间的相关性。
1.3 数据处理
通过Microsoft Excel 2016对数据进行汇总处理并分析误差,再将处理后的数据导入SPSS 22.0软件中进行单因素ANOVA分析。
2 结果与讨论
2.1 测定条件因素对色差测定的影响
2.1.1 测定条件对色差值的影响
2.1.1.1 光照对色差值的影响 图1为坛紫菜干品在不同光照强度下测得的色差结果。通过显著性分析发现,在不同的光照强度下,各组间L*值和b*值均无显著性差异(P>0.05)。通过图1B可知,a*值在黑暗、2000、6000、8000 lx下的测定结果之间无显著性差异(P>0.05)。
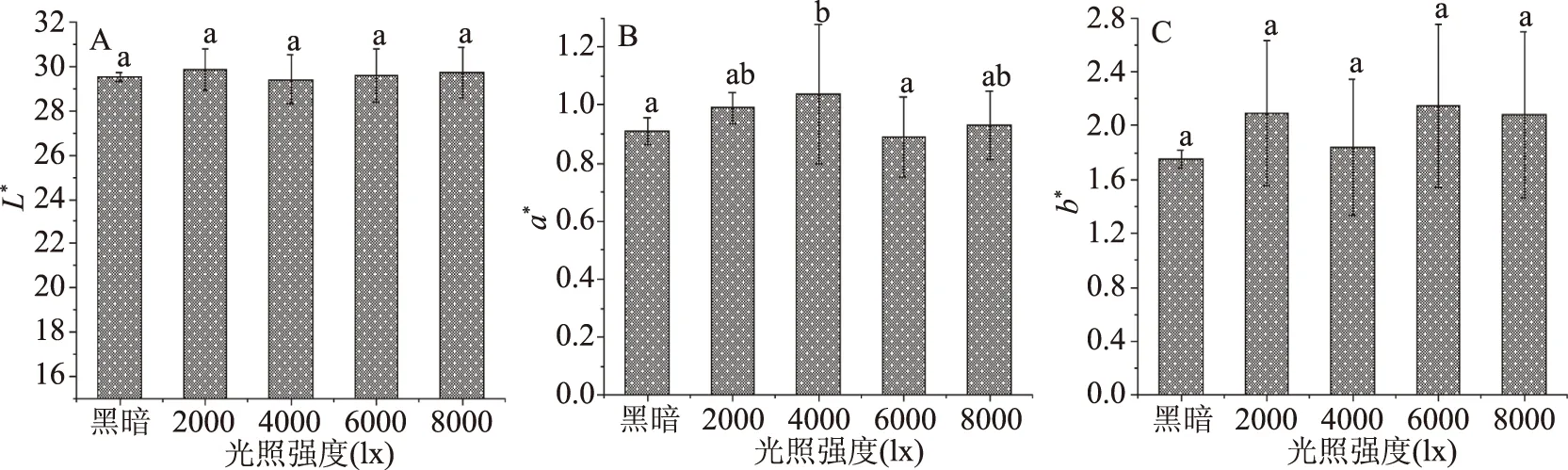
图1 不同光照强度对色差的影响Fig.1 Effect of different illumination intensity on chromatic aberration注:A:不同光照强度对色差L*的影响;B:不同光照强度对色差a*的影响;C:不同光照强度对色差b*的影响;不同字母表示差异显著(P<0.05),图2~图5同。
2.1.1.2 温度对色差值测定的影响 由图2可知,温度在10~30 ℃时,对L*值的测定无显著影响(P>0.05)。对于a*值的测定结果,30 ℃与10、15、20、25 ℃四个温度下的a*值均有显著差异(P<0.05),这说明温度对a*值测定有一定影响。30 ℃与20、25 ℃下测定的b*值有差异显著(P<0.05),但15 ℃与10、20、25、30 ℃四个温度下测定的b*值均无显著差异(P>0.05)。
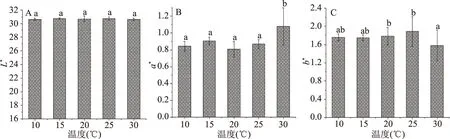
图2 不同温度对色差的影响Fig.2 Effect of different temperatures on chromatic aberration
2.1.1.3 湿度对色差值测定的影响 标准坛紫菜干品的水分含量应在14%以下[21],图3为坛紫菜干品在不同湿度环境下所测得的色差。根据显著性分析结果可知,各湿度下的L*、a*与b*值并无显著差异(P>0.05)。
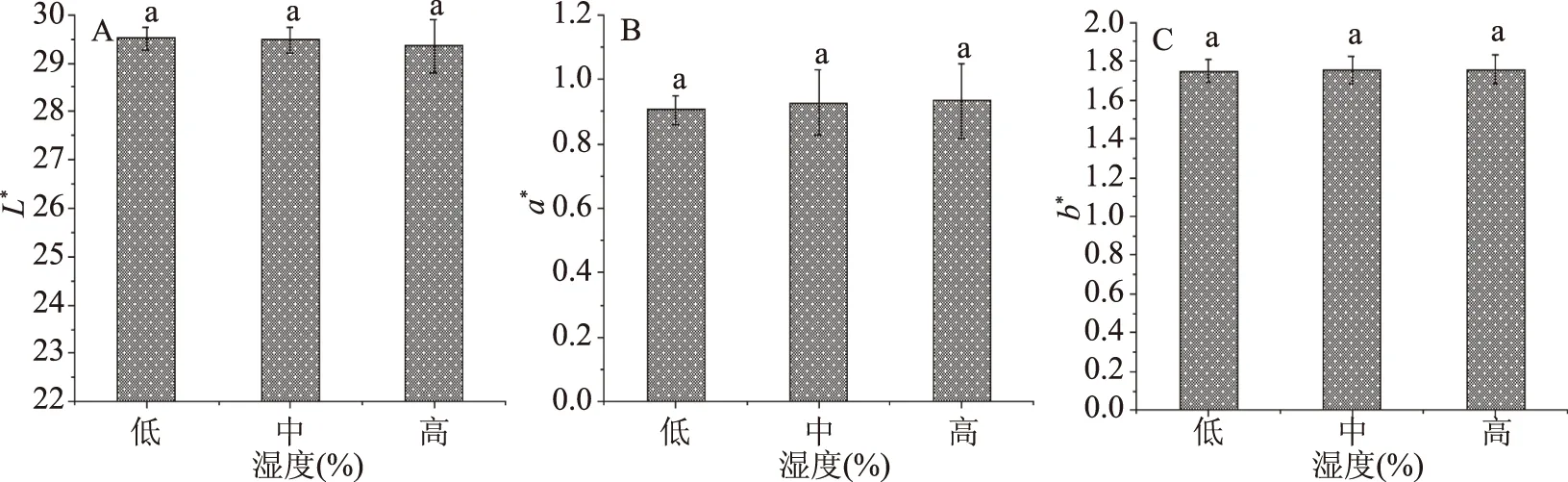
图3 不同环境湿度对色差的影响Fig.3 Effect of different humidity on chromatic aberration
2.1.1.4 背景色对色差值测定的影响 由图4可知,背景色对L*、b*值的测定有一定影响。但不同背景色下a*值无显著差异(P>0.05),说明背景色对a*值的测定无显著影响。L*值在蓝色和红色背景之间有显著差异(P<0.05),而在白色、黄色背景之间以及蓝色背景之间测得的L*值无显著差异(P>0.05)。在白色和红色背景下测定的b*值有显著差异(P<0.05)。
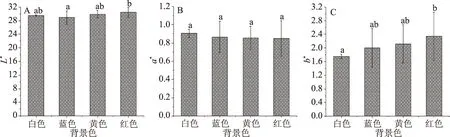
图4 不同背景色对色差的影响Fig.4 Effect of different background colors on chromatic aberration
2.1.1.5 坛紫菜片数对色差值测定的影响 色差仪测定时对样品厚度有一定要求,张玉先等[22]发现了不同地黄厚度对色差结果有一定影响。坛紫菜片数对坛紫菜干品的色差值的影响如图5所示,所测L*、a*与b*值在坛紫菜不同片数的条件下均无显著性差异(P>0.05)。
图5 不同坛紫菜片数对色差的影响Fig.5 Effects of different pieces of laver on chromatic aberration
2.1.2 测定条件对色差值稳定性的影响
2.1.2.1 光照对色差值稳定性的影响 变异系数(coefficient of variation,CV),用于指示检测结果的精密度,体现数据的稳定性[23]。图6中,黑暗条件下L*值和b*值的变异系数均小于其它光照强度,分别为0.77%、3.78%,可知在黑暗条件下L*值和b*值更稳定。图1B中,a*值在黑暗条件与4000 lx下的结果差异显著(P<0.05),但4000 lx下a*值的变异系数大于黑暗条件,黑暗条件下a*值的变异系数(5.055%)均低于其它光照强度下的a*值,变异系数小则数据精密度更高,相对更稳定。综合考察光照强度对色差值测定稳定性的影响,选择0、2000、4000 lx三个条件作为正交试验的三个水平。
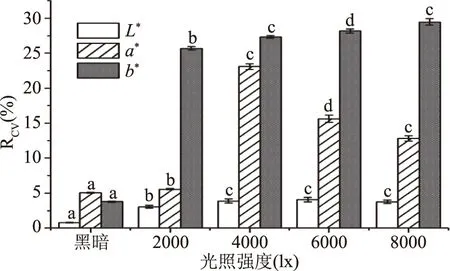
图6 不同光照强度对色差测量稳定性的影响Fig.6 The influence of different illumination intensity on the stability of chromatic aberration measurements注:不同字母表示差异显著(P<0.05),图7~图10同。
2.1.2.2 温度对色差值稳定性的影响 由图7可知,15 ℃下测得L*值的变异系数(0.77%)均小于10 ℃和20 ℃,该温度下测L*值较为稳定。30 ℃与15 ℃下的a*值有显著差异(P<0.05),然而30 ℃下的a*值变异系数(20.37%)相对较大,数据精密度不高,稳定性差,最低的15 ℃下a*值的变异系数为5.11%,说明15 ℃下a*值相对稳定。15 ℃下b*值变异系数最小,15 ℃的b*值稳定。15 ℃不仅可以消除不同温度对结果的影响,而且该温度下测定各色差值的变异系数均较低,结果相对稳定,可信度高。因此,选择10、15、20 ℃三个条件作为正交试验的三个水平。
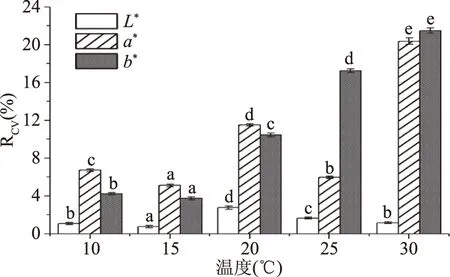
图7 不同温度对色差测量稳定性的影响Fig.7 The influence of different temperatures on the stability of chromatic aberration measurements
2.1.2.3 湿度对色差值稳定性的影响 图8中可见,在低湿度(40%以下)时L*、a*与b*值的变异系数均为最小,分别为0.75%、4.84%、3.46%。结果表明,低湿度时的系统误差小,测定结果稳定。湿度过大时,坛紫菜干品易受湿度影响,可能会引起坛紫菜干品水分含量变化,从而导致颜色上的变化,影响其品质,不建议在湿度较高的环境条件下测定坛紫菜干品,需保证测定环境干燥。综合上述湿度对色差值测定稳定性的影响,选择低湿度、中湿度、高湿度三个条件作为正交试验的三个水平。
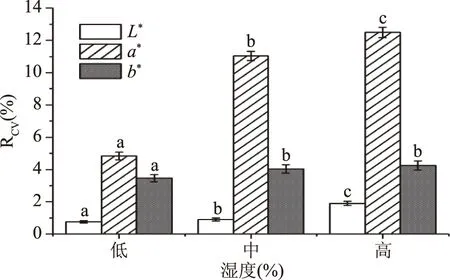
图8 不同环境湿度对色差测量稳定性的影响Fig.8 The influence of different humidity on the stability of chromatic aberration measurements
2.1.2.4 背景色对色差值稳定性的影响 图9所示,白色背景下L*值的变异系数(0.75%)小于黄色,且均小于蓝色和红色的变异系数。虽然在白色背景下b*值与在蓝色和黄色背景无显著差异(P>0.05),但蓝色、黄色背景下的变异系数较大,可信度不高,重复性差,精确度低,白色背景下b*值的变异系数(4.84%)与其他背景色相比小,因此在白色背景色下测定b*值适宜。另外,a*值在白色背景色下的变异系数最小,该条件下a*值的测定条件更稳定。不同样品的自身性质不同,可能使得所采用的背景色不同[24-25]。综上分析,在对坛紫菜干品色差测定时,需对背景色进行统一规定,且采用白色背景较为适宜。
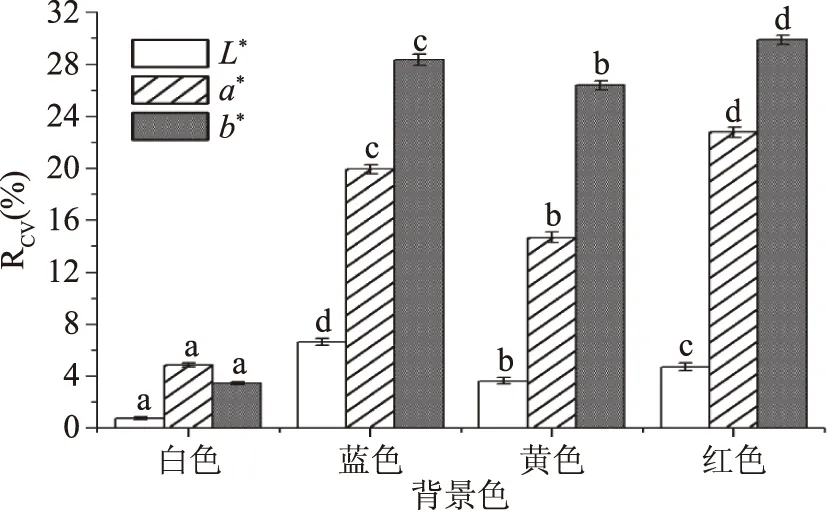
图9 不同背景色对色差测量稳定性的影响Fig.9 The influence of different background colors on the stability of chromatic aberration measurements
2.1.2.5 坛紫菜片数对色差值稳定性的影响 图10中可见,当坛紫菜片数为4张和5张时,测得L*、a*与b*值的变异系数均相对较低,且在4张坛紫菜片数下各色差值的变异系数均最低,分别为0.752%、4.839%、3.463%。因此,4张坛紫菜片下测定的L*、a*与b*值更为稳定可信。研究过程中发现坛紫菜片张在1~5张时虽然色差值的大小无显著差异(P>0.05),但是5张坛紫菜所需样品量大,而在片数为4张时的变异系数为最小,所以为减小测定时由于坛紫菜片数引起的系统误差,提高测定结果的可信度和稳定性,选择4张坛紫菜干品进行测定更适宜。
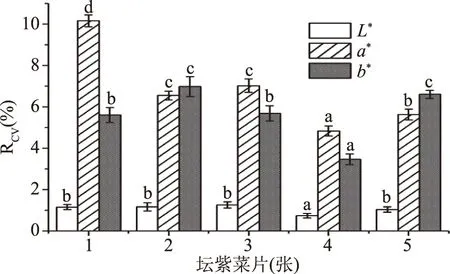
图10 不同坛紫菜片数对色差测量稳定性的影响Fig.10 The influence of different pieces on the stability of chromatic aberration measurements
2.2 最佳测定条件的选择
按表1的正交因素水平设计L9(34)正交试验,结果见表3。
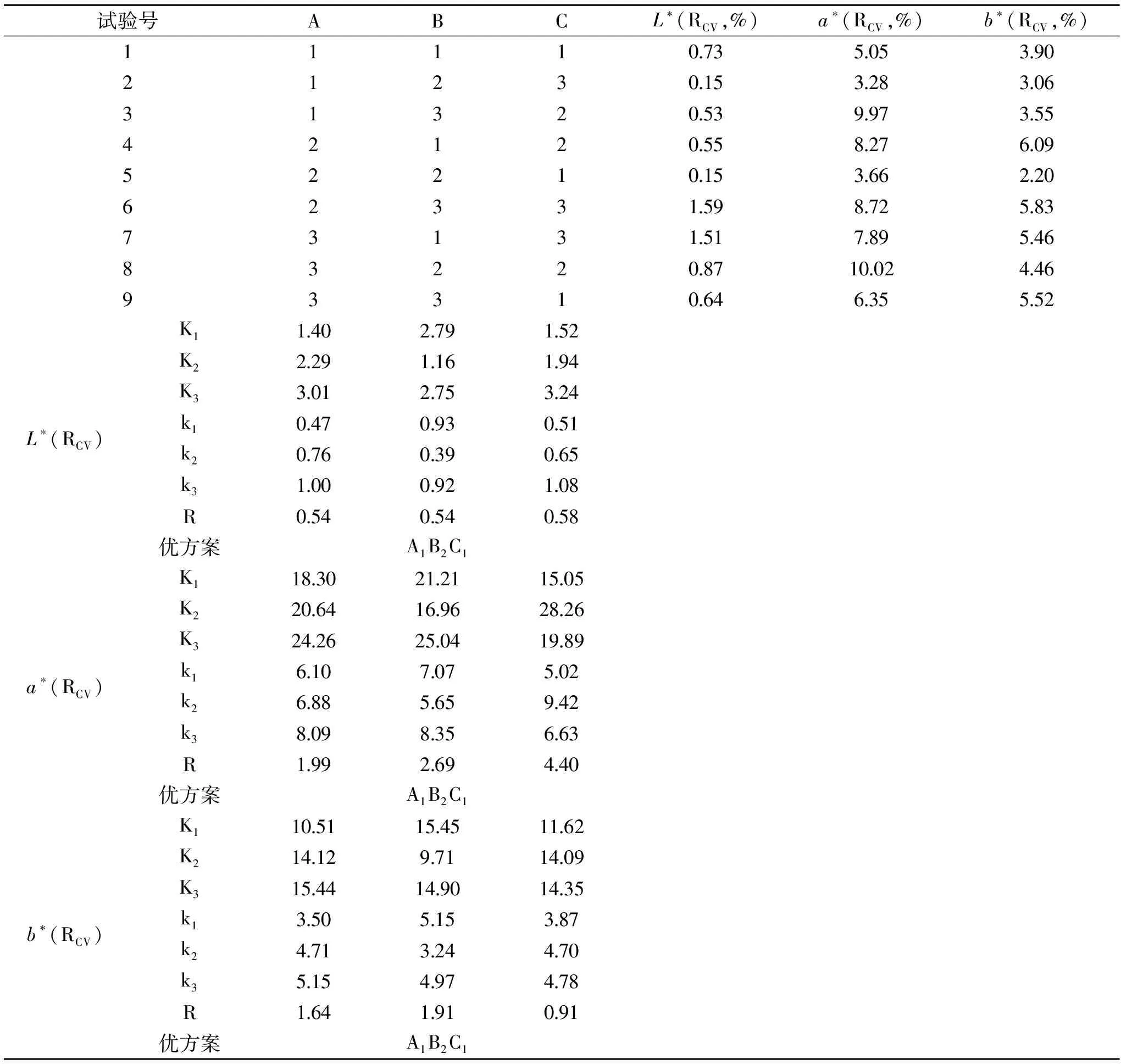
表3 L9(34)正交试验结果Table 3 Results of the L9(34)orthogonal array design
由表3的结果和极差分析可知,上述3个因素对L*变异系数的影响依次为C(湿度)>B(温度)=A(光照强度),a*变异系数的影响依次为C(湿度)>B(温度)>A(光照强度),b*变异系数的影响依次为B(温度)>A(光照强度)>C(湿度)。湿度、温度与光照强度对L*、a*、b*的影响主次顺序不同。坛紫菜干品表面略有褶皱,较难控制光线在测定过程中仪器与样品紧密接触,会对标准操作下坛紫菜干品a*值的测定结果有所影响,为控制色差仪测定结果不受光线的影响,选择在黑暗条件下进行测量,可减小光照引起的系统误差,保证数据结果的稳定性,使其精密度更高[26]。温度会引起空气、折射元件等测量光路的变化[27]。光路的改变引起了待测样品表面反射光线在色差仪内部经滤色片后坐标系的变化,从而导致色差仪测定结果的波动,引起数据的不稳定[28]。L*、a*、b*的变异系数最佳组合条件均为A1B2C1,即光照强度为0 lx、温度为15 ℃、低湿度。
2.3 对正交试验结果的验证
由于最佳因素组合为A1B2C1不在正交表中,所以需要对最佳因素组合进行验证试验,即对10组相同坛紫菜干品进行选点测定色差值,测定条件分别为0 lx、15 ℃、低湿度(40%以下)、白色背景、4张坛紫菜片数,得到L*、a*、b*的变异系数分别为0.41%、2.08%、2.07%,可以看出该测定条件比较稳定,可以达到优化的目的。
2.4 坛紫菜干品色差与品质相关性分析
2.4.1 坛紫菜干品色差与品质结果 不同坛紫菜干品的色差值、色素含量和感官评价的结果见表4,Ⅰ、Ⅱ、Ⅲ组坛紫菜干品在色泽和外观上有所差异,Ⅰ组呈现黑褐色,Ⅱ组呈现褐色,Ⅲ组呈现紫红色。Ⅰ、Ⅱ、Ⅲ组的L*值由29.65变为53.32,a*值由0.96变为5.06,b*值由1.83增加至14.78。L*、a*、b*、叶绿素、藻红蛋白、别藻蓝蛋白、藻蓝蛋白含量在三种不同处理下均有显著差异(P<0.05),藻红蛋白、藻蓝蛋白、别藻蓝蛋白、叶绿素这些色素含量受光照、温度的影响而降低,Ⅲ组上述四种色素物质含量分别为9.52、0.84、0.30、0.19 μg·mL-1,藻红蛋白含量高于其他色素含量,外观表现主要呈现藻红蛋白的颜色,a*值较大,而感官总分最低为12.08,与Zhang等[29]认为坛紫菜红色突变体的红色表型是由高含量藻红蛋白引起的观点相似。因此,坛紫菜干品色泽上的变化可能是由于藻红蛋白、藻蓝蛋白、别藻蓝蛋白和叶绿素的不稳定引起的。
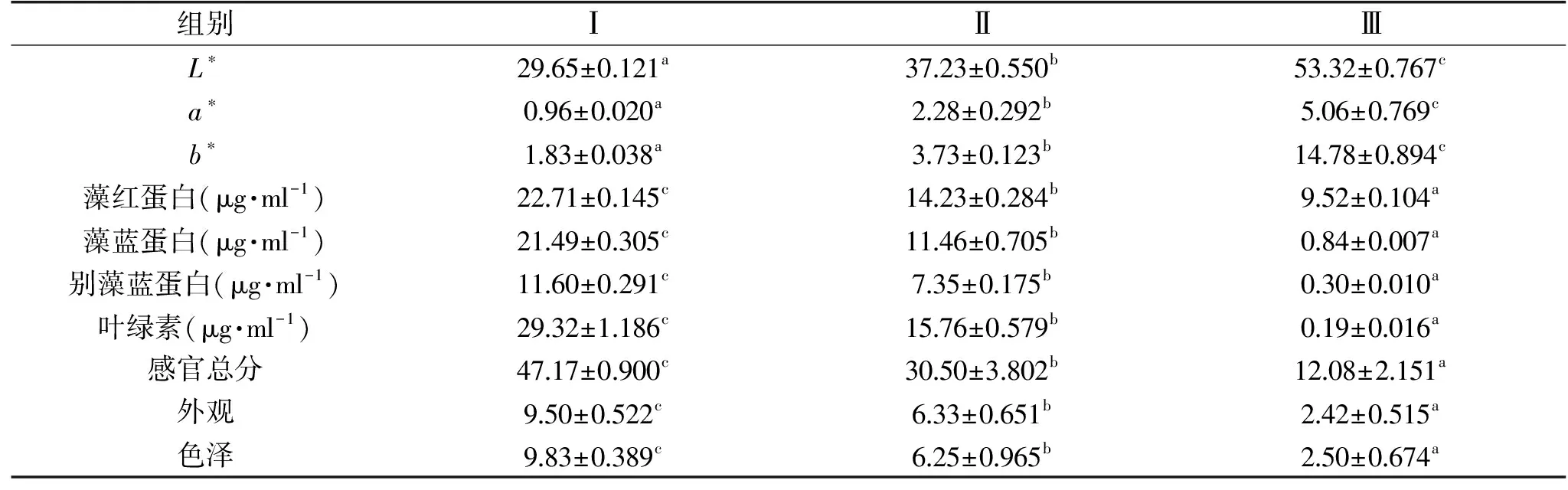
表4 不同坛紫菜干品的色差值、色素含量及感官评价结果Table 4 The chromatic aberration,pigment content and sensory evaluation of dried laver
2.4.2 Pearson相关性分析 经Pearson相关分析,结果如表5所示,L*、a*、b*值与各色素含量呈极显著负相关(P<0.01);L*、a*、b*值与感官总分、外观和色泽评分呈极显著负相关(P<0.01)。同时Ⅰ组中L*、a*、b*值的变异系数低,分别为0.41%、2.06%、2.08%均低于其它两组,其它两组的色差值的变异系数较大(Ⅱ组L*、a*、b*值的变异系数分别为1.48%、12.81%、3.30%;Ⅲ组分别为1.44%、15.20%、6.05%),这可能是由于坛紫菜干品表面略有褶皱,而温度和光照的刺激不均匀,会引起各色素含量的变化不一致,使得色差值的变异系数较高。在色差测定条件确定的情况下,L*、a*、b*值可以很好地反映出坛紫菜干品的品质变化情况。因此在L*、a*、b*值的测定过程中对测定条件的选择十分重要,本研究所用方法适用于品质较好的坛紫菜干品,可以准确地反映出色差的变化情况,并保证了测定值的稳定性和精密度。

表5 坛紫菜干品色差与色素含量皮尔森相关性Table 5 Pearson correlation between chromatic aberration and pigment content of dried laver
3 结论
本研究通过单因素实验和正交试验结果分析,得出坛紫菜干品色差测定最优条件为白色背景、黑暗、15 ℃、环境湿度范围为0~40%和4张坛紫菜干品叠加。在此条件下,坛紫菜干品的L*、a*、b*的变异系数分别为0.41%、2.08%、2.07%。色差仪探测头与样品表面尽量紧密接触,并放置于白色的测色板中,色差仪开机进行校正后对坛紫菜干品表面进行色差测定。L*、a*、b*值可以从一定程度上体现色素含量,与叶绿素、藻红蛋白、别藻蓝蛋白、藻蓝蛋白呈极显著负相关(P<0.01),品质较好的坛紫菜干品各色差值的变异系数较低,对于色素含量与各色差值的数量关系还需进一步研究。

