人参全草免疫调节作用研究△
任国庆,邹晓峰,韩亚男,窦德强*
1.辽宁中医药大学,辽宁 大连 116600;2.辽宁万嘉医药科技有限公司,辽宁 本溪 117000
人参应用历史悠久,功能作用广泛,早在西汉时期,就在治疗和防御疾病等方面被广泛应用。人参始载于《神农本草经》,书中描述其“味甘,微寒。主补五脏,安精神,定魂魄,止惊悸,除邪气,明目,开心益智”。现代药理研究表明,人参具有益智[1]、免疫调节[2-3]、改善心血管系统[4-5]、抗衰老[6]和抗肿瘤[7]等多种药理作用。自古野生人参资源稀少,园参的栽种虽解决了人参药用资源不足的问题,但园参的毁林种植方式严重破坏了生态资源。近年来,林下山参发展迅速。林下山参是人为地把人参种子撒播到山林野生状态下,任其自然生长而长成,因林下山参的生态环境与野山参相似,其品质及药用价值又接近野山参的水平,且能保护生态平衡。2008年国家标准委颁布的《野山参鉴定及分等质量》中,将林下山参纳入野山参的范畴。现如今林下山参已成为高品质商品人参的主要来源。人参根和地上部分都有较好的药用价值,目前人参方面的研究主要是单独对人参根或人参茎叶进行研究,本研究拟对林下山参全草的免疫调节作用进行研究,从细胞免疫功能、体液免疫功能、单核-巨噬细胞功能、NK细胞活性4个方面对林下山参全草在免疫功能方面的作用进行研究,以期为林下山参全草的综合利用奠定基础,为林下山参全草调节免疫作用提供相关理论依据。
1 仪器与试药
1.1 实验材料
林下山参全草由参仙源生物工程有限公司提供,由辽宁中医药大学王冰教授鉴定为五加科植物人参PanaxginsengC.A.Mey.。将样品粉碎,以林下山参根∶林下山参茎叶=1∶2的比例混合(因十五年生林下山参的干燥品根与茎叶比重约为1∶2,故以此比例混合林下山参根和茎叶粉末)。参考2015版《中华人民共和国药典》人参日摄入量,将林下山参全草日摄入量设计为1.5 g/60 kg,以生药粉作为受试物,蒸馏水做溶剂。
1.2 实验动物
选用辽宁长生生物技术有限公司繁殖的SPF级18~22 g雄性昆明种小鼠(SCXK 2010-0001)。动物实验室,恒温恒湿,温度(22±1.5)℃,湿度50%±10%,人工照明12 h,黑夜12 h。
1.3 仪器与试剂
电子分析天平(上海光正医疗器械有限公司);KC-100酶标分析仪(深圳凯特生物医疗电子科技有限公司);二氧化碳培养箱(日本三洋公司);UV2100型紫外可见分光光度计(尤尼柯上海仪器有限公司);奥林巴斯BX51TRF显微镜;TD24-WS台式低速离心机(湖南湘仪实验室仪器开发有限公司);电热恒温水浴锅(北京永光明医疗仪器有限公司)。
豚鼠血清、小牛血清(杭州四季青生物工程公司);硝基氯化四氮唑(INT)、乳酸锂、刀豆蛋白A(Con A)、噻唑蓝(MTT)、Hank’s液(pH 7.2-7.4)(美国Sigma公司);水杨酸缓冲液(SA缓冲液)、PBS缓冲液(pH7.2~7.4)(北京索莱宝科技有限公司);琼脂糖(上海耐今实业有限公司);印度墨汁(北京笃信精细制剂厂);Na2CO3(天津市科密欧化学试剂有限公司);绵羊红细胞(SRBC)、鸡红细胞、YAC-1细胞(中国科学院上海细胞库);RPMI 1640细胞培养液(美国Gibco公司);吩嗪二甲酯硫酸盐(PMS)(Biochemika公司);Tris base(Amresco公司);2,4-二硝基氟苯(2,4-dinitrofluorobenzene,DNFB)(中国医药集团上海化学试剂公司);丙酮、盐酸、异丙醇(天津市大茂化学试剂厂);氧化型辅酶Ⅰ(NAD)(Roche公司)。
2 方法
2.1 细胞免疫功能实验
2.1.1 Con A诱导的小鼠脾淋巴细胞转化实验
2.1.1.1 实验动物分组及给药 雄性昆明种小鼠40只,适应性喂养3 d,随机分为4组,分别为溶剂对照组、低剂量组、中剂量组和高剂量组,每组10只小鼠。分别给予林下山参全草生药粉低剂量(0.25 g·kg-1)、中剂量(0.50 g·kg-1)、高剂量(0.75 g·kg-1)(相当于人体日摄入量的10倍、20倍、30倍),溶剂对照组给予等量的蒸馏水。每天灌胃1次,连续30 d,按体重调整灌胃量(灌胃量按20 mL·kg-1计算)。
2.1.1.2 脾细胞悬液制备 末次给药12 h后,取脾放入盛有Hank’s液的平皿中,将脾磨碎制成单细胞悬液,1000 r·min-1离心10 min,用Hank’s液洗2遍,最后将细胞悬浮于完全培养液中,计数活细胞并调整细胞浓度。
2.1.1.3 淋巴细胞增殖反应与测定 参照文献[8]进行测定。将细胞悬液分两孔加入24孔培养板中,每孔1 mL,一孔加75 μL Con A液,另一孔作为对照,置5%CO2、37 ℃二氧化碳培养箱中培养72 h。培养结束前4 h,每孔吸去上清液0.7 mL,加入0.7 mL不含小牛血清的RPMI 1640培养液,同时加入MTT50 μL,继续培养4 h。培养结束后,每孔加入1 mL酸性异丙醇,混匀使结晶完全溶解。使用分光光度计在570 nm波长下测定吸光度。
2.1.2 二硝基氟苯(DNFB)诱导小鼠迟发型超敏反应(DTH)实验 实验动物分组及给药同2.1.1.1。
2.1.2.1 致敏 给药24 d后,大鼠腹部脱毛,用DNFB溶液50 μL均匀涂抹进行致敏处理。
2.1.2.2 DTH的产生与测定 5 d后,用DNFB溶液10 μL均匀涂抹于小鼠右耳。于涂抹后24 h处死小鼠,剪下左右耳壳。用打孔器取下耳片,称重。
2.2 体液免疫功能实验
2.2.1 抗体生成细胞检测 参照文献[9]进行测定,实验动物分组及给药同2.1.1.1。
2.2.1.1 SRBC免疫 取新鲜绵羊血,用0.9%氯化钠溶液洗涤3次,每次离心(2000 r·min-1)10 min,将压积SRBC用0.9%氯化钠溶液配成2%(v/v)的细胞悬液,在第24天给药结束后,每只鼠腹腔注射0.2 mL。
2.2.1.2 制备补体 将1 mL压积SRBC加入到5 mL豚鼠血清中,4 ℃冰箱放置30 min,经常振荡,离心取上清,分装,-70 ℃保存。用时以SA液按1∶8稀释。
2.2.1.3 片架的制作 取洁净的载玻片,粘两条透明胶带,中间留有约15 mm的间隔,在胶带上薄涂一层凡士林。
2.2.1.4 脾细胞悬液制备 将SRBC免疫5 d后的小鼠处死,取脾脏,放入盛有Hank’s液的平皿内,将脾磨碎制成细胞悬液,1000 r·min-1离心10 min,用Hank’s液洗2遍,将细胞悬浮在RPMI1640培养液中,计数细胞并调整细胞浓度。
2.2.1.5 空斑的测定 将表层培养基(1 g琼脂糖加双蒸水至100 mL)加热溶解后,放45 ℃水浴保温,与等量pH7.4、2倍浓度的Hank’s液混合,分装小试管,每管0.5 mL,再向管内加50 μL 10%SRBC(v/v,用SA液配制),20 μL脾细胞悬液,迅速混匀,倾倒于已刷琼脂糖薄层的20 mm×20 mm盖玻片上,待琼脂凝固后,将盖玻片水平扣放在自制片架上,用镊子尾端将盖玻片压平贴牢。放入二氧化碳培养箱中孵育1.5 h。用凡士林将盖玻片一端封住,然后将用SA缓冲液稀释的补体(1∶8)加入到凹槽内,继续孵育1.5 h后,观察凹槽内空斑,低倍镜下检查并计数出现的溶血空斑。真正的溶血空斑必须中心有一个淋巴细胞,周围为透明区。
样本出现的空斑数
(1)
2.2.2 血清溶血素的测定 实验动物分组及给药同2.1.1.1。SRBC免疫同2.2.1.1。末次给药12 h后,小鼠眼眶取血,制备血清,用0.9%氯化钠溶液将血清倍比稀释,将不同稀释度的血清分别置于微量血凝实验板内,每孔100 μL,再加入100 μL 0.5%(v/v)的SRBC悬液,混匀,装入湿润的平盘内加盖,于37 ℃温箱孵育3 h,观察血球凝集程度。血球凝集程度一般分为5级(0~Ⅳ)记录,按下式计算抗体积数。
抗体积数=(S1+2S2+3S3……nSn)
(2)
式中1、2、3……n代表对倍稀释的指数,S代表凝集程度的级别,抗体积数越大,表示血清抗体越高。0级:红细胞全部下沉,集中在孔底部形成致密的圆点状,四周液体清晰;Ⅰ级:红细胞大部分沉集在孔底成圆点状,四周有少量凝集的红细胞;Ⅱ级:凝集的红细胞在孔底形成薄层,中心可以明显见到一个疏松的红点;Ⅲ级:凝集的红细胞均匀地铺散在孔底成一薄层,中心隐约可见一个小红点;Ⅳ级:凝集的红细胞均匀地铺散在孔底成一薄层,凝块有时成卷折状。
2.3 单核-巨噬细胞功能实验
2.3.1 小鼠碳廓清实验 实验动物分组及给药同2.1.1.1。末次给药12 h后,从小鼠尾静脉注入稀释5倍的印度墨汁,按每10 g体质量0.1 mL计算。待墨汁注入,立即计时。注入墨汁后2、10 min,分别从内眦静脉丛取血20 μL,并立即将其加到2 mL Na2CO3溶液中。以600 nm波长测定吸光度A,以Na2CO3溶液作空白对照。将小鼠处死,取肝脏和脾脏,用滤纸吸干脏器表面血污,称重。以吞噬指数表示小鼠碳廓清的能力。按下式计算吞噬指数α。
(3)
t1:注入墨汁后第一次从内眦静脉丛取血的时间;t2:注入墨汁后第二次从内眦静脉丛取血的时间;A1:第一次取血测得的吸光度;A2:第二次取血测得的吸光度。
(4)
2.3.2 小鼠腹腔巨噬细胞吞噬鸡红细胞实验 实验动物分组及给药同2.1.1.1。参照文献[10]进行测定。末次给药12 h后,每鼠腹腔注射20%鸡红细胞悬液1 mL,间隔30 min,颈椎脱臼处死动物,将其仰位固定于鼠板上,正中剪开腹壁皮肤,经腹腔注入0.9%氯化钠溶液2 mL,转动鼠板1 min。然后吸出腹腔洗液1 mL,平均分滴于2片载玻片上,放入垫有湿沙布的搪瓷盒内,移置37 ℃孵箱温育30 min。孵毕,于0.9%氯化钠溶液中漂洗,以除去未贴片细胞。晾干,以1∶1丙酮甲醇溶液固定,4%(v/v)Giemsa-磷酸缓冲液染色3 min,再用大豆色拉油漂洗晾干。油镜下计数巨噬细胞,每张片计数100个,以吞噬百分率表示小鼠巨噬细胞的吞噬能力。按下式计算吞噬百分率。

(5)
2.4 NK细胞活性实验
实验动物分组及给药同2.1.1.1[10]。
2.4.1 LDH基质液的配制 乳酸锂5×10-2、INT 6.6×10-4、PMS 2.8×10-4、NAD 1.3×10-3mol·L-1,将上述试剂溶于0.2mol·L-1的Tris-HCl缓冲液中(pH8.2)。
2.4.2 靶细胞的传代(YAC-1细胞) 实验前24 h将靶细胞(YAC-1细胞)进行传代培养。应用前以Hank’s液洗3次,用RPMI 1640宪全培养液调整细胞浓度为4×105个/mL。
2.4.3 脾细胞悬液的制备(效应细胞) 末次给药12 h后,无菌取脾,置于盛有适量无菌Hank’s液的小平皿中,用200目滤网将脾磨碎,制成单细胞悬液。用Hank’s液洗2次,每次离心(1000 r·min-1)10 min。弃上清将细胞浆弹起,加入0.5 mL灭菌水20 s,裂解红细胞后再加入0.5 mL 2倍Hank’s液及8 mL Hank’s液,1000 r·min-1离心10 min,用1 mL含10%小牛血清的RPMI 1640完全培养液重悬,用台酚兰染色计数活细胞数(应在95%以上),最后用RPMI 1640完全培养液调整细胞浓度为2×107个/mL。
2.4.4 LDH活性检测 取靶细胞和效应细胞各100 μL(效靶比50∶1),加入U型96孔培养板中;靶细胞自然释放孔加靶细胞和培养液各100 μL,靶细胞最大释放孔加靶细胞和2.5%Triton各100 μL;上述各项均设3个平行孔,于5%CO2、37 ℃CO2培养箱中培养4 h,然后将96孔培养板以1500 r·min-1离心5 min,每孔吸取上清100 μL置平底96孔培养板中,同时加入LDH基质液100 μL,反应3 min,每孔加入1 mol·L-1的HC1 30 μL,在酶标仪490 nm处测定吸光度A。按下式计算NK细胞活性。
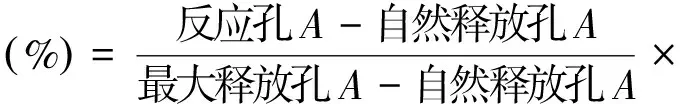
(6)
2.5 脏器指数测定
实验动物分组及给药同2.1.1.1。末次给药12 h后,小鼠称重,眼眶取血,制备血清,备用;小鼠脱颈椎处死后,取其胸腺和脾脏,称重,计算胸腺指数和脾脏指数。
(7)
2.6 实验数据统计
3 结果
3.1 脏器指数测定结果
由图1知,各实验组胸腺及脾脏指数与样品溶剂对照组比较,差异均无统计学意义。
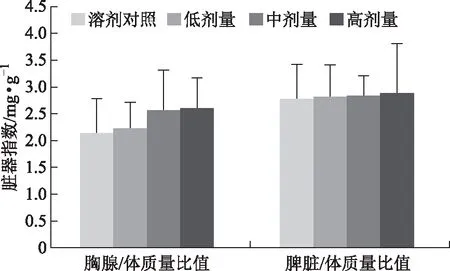
图1 小鼠脏器指数测定结果
3.2 DNFB诱导小鼠DTH实验结果
由图2知,各实验组的左右耳质量差值与样品溶剂对照组比较,差异均无统计学意义。
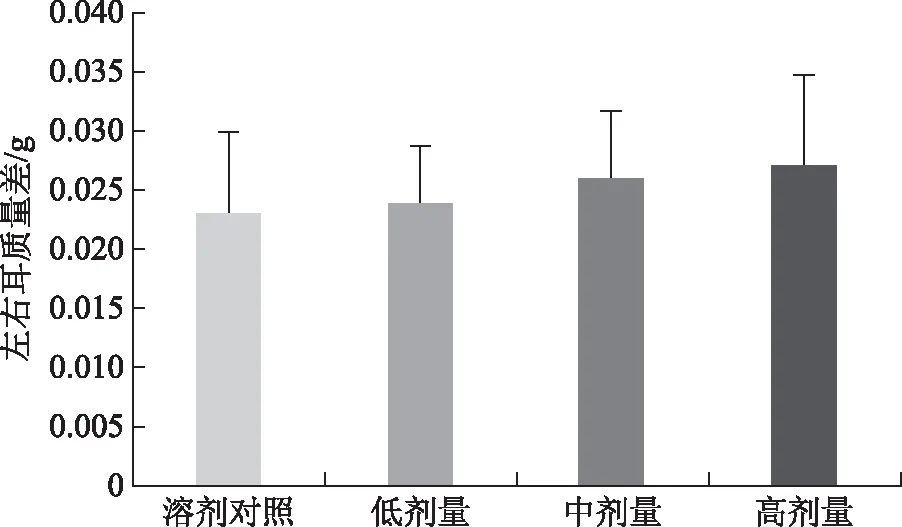
图2 DNFB诱导小鼠DTH实验左右耳质量差测量结果
3.3 ConA诱导的小鼠脾淋巴细胞转化实验
由图3知,中、高剂量实验组的波光度差值显著高于样品溶剂对照组(P<0.01),而低剂量实验组差异无统计学意义(P>0.05),提示林下山参全草对小鼠脾淋巴细胞转化有增强作用且与其剂量呈正相关。
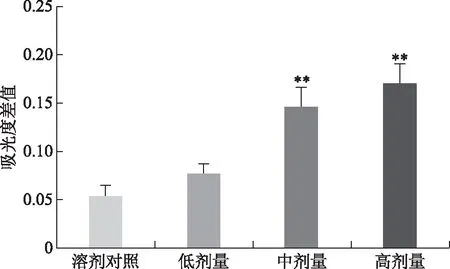
注:与溶剂对照组比较,**P<0.01。
3.4 小鼠抗体生成细胞检测和小鼠血清溶血素测定结果
由图4(A)知,低、中剂量实验组中溶血空斑数显著高于样品溶剂对照组(P<0.01);由图4(B)知,低、中剂量实验组中血清溶血素抗体积数显著高于样品溶剂对照组(P<0.01),表明林下山参全草对血清溶血素和抗体生成细胞的产生有增强作用。
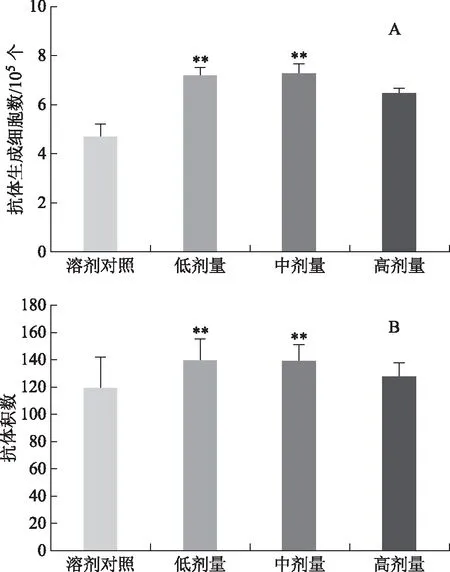
注:A.抗体生成细胞检测空斑数;B.血清溶血素实验抗体积数测定结果;与溶剂对照组比较,**P<0.01。
3.5 小鼠碳廓清实验结果
由图5知,只有低剂量实验组的吞噬指数α显著高于样品溶剂对照组(P<0.01),表明林下山参全草对调节小鼠碳廓清能力作用较缓和。
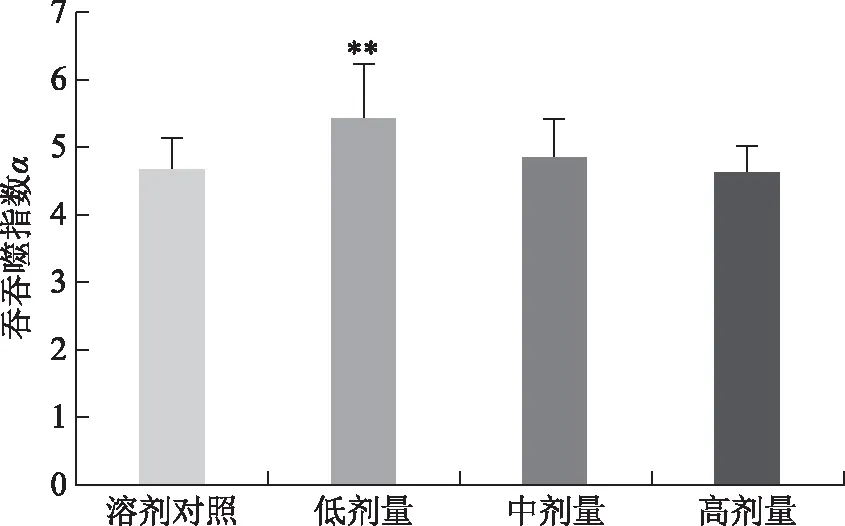
注:与溶剂对照组比较,**P<0.01。
3.6 小鼠腹腔巨噬细胞吞噬鸡红细胞实验结果
由图6知,各实验组的吞噬百分率与样品溶剂对照组比较差异均无统计学意义,表明林下山参全草对小鼠腹腔巨噬细胞吞噬功能的调节作用不显著。图7中,蓝紫色为被染色剂染为蓝紫色的未吞噬的巨噬细胞,紫黑色为吞噬鸡红细胞的巨噬细胞。
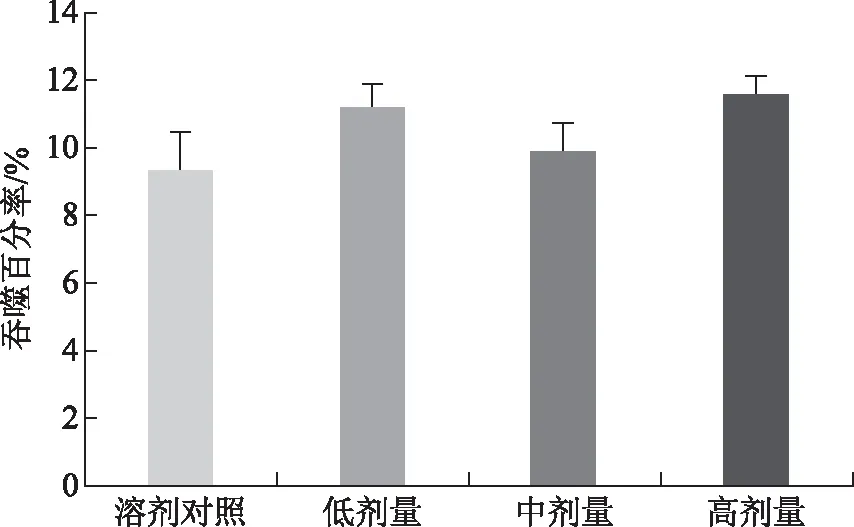
注:A.未吞噬的巨噬细胞;B.吞噬鸡红细胞的巨噬细胞。

图7 小鼠腹腔巨噬细胞吞噬鸡红细胞实验吞噬细胞显微图片
3.7 小鼠NK细胞活性测定实验结果
由图8知,各实验组小鼠NK细胞活性与样品溶剂对照组比较差异均无统计学意义,表明林下山参全草对NK细胞活性无显著性调节作用。
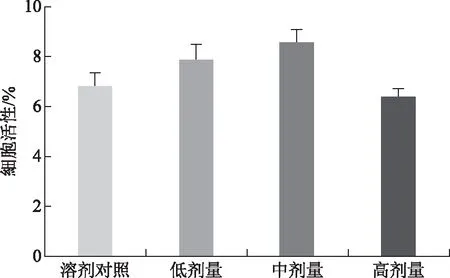
图8 小鼠NK细胞活性测定结果
4 讨论
人参历为大补元气之圣药,全草均可入药,其自上而下以叶补肺气、根茎补脾胃之气、果填补肾精,犹若人体之有肺、脾胃及肾三脏,浑然一体,不仅切合取象比类思维,同时“全人参”作为一个整体,入药补气亦是中医整体观的具体体现[11]。目前主要针对人参根或人参茎叶免疫作用研究,而未见对人参全草免疫作用相关报道,本文以林下山参全草为对象,从细胞免疫功能、体液免疫功能、单核-巨噬细胞功能和NK细胞活性4个方面,探讨其对小鼠免疫功能的影响。
细胞免疫主要是由T淋巴细胞介导的一种特异性免疫反应。正常机体的T淋巴细胞在体外培养过程中受到特异性抗原或有丝分裂原刺激,可转化为淋巴母细胞。淋巴细胞转化率降低表示细胞免疫水平低下。Con A诱导的小鼠脾淋巴细胞转化实验,其转化率常被用来衡量机体细胞免疫水平;T淋巴细胞转化率低,意味着在外来因子的刺激下淋巴细胞的增殖反应降低,机体的免疫力下降[8]。DHT是T细胞功能的测定方法,其反应主要是由T细胞介导的免疫损伤,DNFB是常用的诱生接触型超敏反应致敏原[12]。有研究表明,淋巴细胞转化实验可对DTH实验的结果进行验证[13],确保结果的准确性。所以对小鼠进行脾淋巴细胞转化实验和DTH实验,以确定林下山参全草对小鼠细胞免疫的调节作用。本实验研究发现,林下山参全草中、高剂量组与对照组相比均极显著提高脾淋巴细胞转化,但林下山参全草对小鼠DTH无显著性影响。DNFB诱导的迟发型超敏反应则是反应细胞免疫的经典实验,且淋巴细胞转化实验结果多用来佐证DTH,该结果阴性,表明林下山参全草对促进细胞免疫功能的调节无显著性作用,但可以调节淋巴细胞的转化。
体液免疫是由B淋巴细胞介导的特异性免疫反应。B细胞可以识别相应的抗原,通过抗原-抗体反应清除病原体,维持体内环境的稳定[10]。抗体生成细胞检测实验中每个释放溶血性抗体的B淋巴细胞在补体的参与下可溶解周围的绵羊红细胞,在周围形成一个可见的空斑。一个空斑代表一个抗体生成细胞,空斑的数量反映机体的体液免疫功能。血清溶血素的水平是机体免疫功能的主要指标,反映了B细胞的增殖分化以及与补体结合后向体液中分泌溶血素的能力,用以检测药物对机体防御能力的影响[14]。本实验结果显示,林下山参全草低、中剂量组与对照组相比能显著提高血清溶血素和抗体生成细胞的水平,表明林下山参全草能促进小鼠产生血清溶血素和抗体生成细胞,从而增强B淋巴细胞介导的体液免疫反应,并且其药理作用有最适剂量。
固有免疫也称为非特异性免疫,其中单核巨噬细胞的作用是在激活免疫应答前发挥吞噬功能清除外来病原体。巨噬细胞是单核巨噬细胞系统的主要成员,它的主要作用是吞噬病原体,促进活化T细胞和NK细胞杀伤感染的细胞[15]。评价单核巨噬细胞的吞噬功能常采用碳廓清实验,当碳颗粒进入血液后,血液中的吞噬细胞便开始吞噬异物颗粒。NK细胞是一种对靶细胞的杀伤不具有特异性的细胞,可以直接清除感染病原的细胞和肿瘤细胞,在抵抗病原感染和清除肿瘤细胞过程中发挥着非常重要的作用[16]。由于吞噬细胞强大的吞噬和杀伤作用,它们的功能强弱常用来反映了药物对机体非特异性免疫功能调节作用的强弱。免疫器官可分为中枢免疫器官(胸腺、骨髓)和外周免疫器官(脾脏、淋巴结等),是机体免疫细胞产生和寄宿的地方,对维持机体免疫性能起重要作用。本实验发现,与对照组相比,各实验组中脾脏指数、胸腺指数、腹腔巨噬细胞吞噬功能、NK细胞活性差异不显著,只有低剂量组的碳廓清吞噬指数α有显著性升高。表明林下山参全草对小鼠免疫器官发育和固有免疫的作用不显著。
周娅红[17]研究发现,人参总皂苷可提高免疫低下小鼠的脏器指数、碳廓清指数和吞噬指数;提高免疫低下小鼠血清IgM和IgG的生成;促进免疫低下小鼠DTH。赵萧萧[18]从人参叶中提取水溶性多糖,并观察其对小鼠免疫功能的影响,发现给予小鼠人参叶多糖,可以显著增加小鼠脾脏、胸腺器官指数,明显提高腹腔巨噬细胞吞噬能力及脾细胞增殖能力。曾祥云等[19]研究人参片对小鼠免疫功能的影响,发现其对小鼠脾脏、胸腺器官指数、脾细胞增殖能力、腹腔巨噬细胞吞噬能力及抗体生成细胞数均无显著性影响,但显著性提高DNFB诱导小鼠DTH形成能力及NK细胞活性。结合已有报道,林下山参全草与之相比对小鼠免疫调节作用的差异较大。首先免疫器官方面,胸腺和脾脏的脏器指数常作为评价药物对机体免疫器官发育的变化的调节指标。已有研究表明,人参及其总皂苷均能促进免疫器官发育,这与本文结果不同,推测未能促进免疫器官发育可能和人参地上部分的药理作用有关联。但人参叶多糖也具有促进免疫器官发育的作用,所以推测可能与人参叶中非多糖成分有关,而人参叶中含有较多的人参皂苷Re和Rd,其是否对免疫器官发育有影响,有待进一步研究。其次细胞免疫功能方面,Cho等[20]研究发现,人参皂苷Rb1和Re能显著地促进Con A诱导淋巴细胞增殖,Rb2能强烈地抑制Con A、植物血凝素(PHA)和脂多糖(LPS)的诱导作用。本文中林下山参全草能显著提高小鼠脾淋巴细胞增殖能力,推测林下山参全草因含地上部分较多,故含有较多的人参皂苷Re,且人参皂苷Re的促进作用强于人参皂苷Rb2抑制作用,促进了淋巴细胞的转化。而对促进DNFB诱导小鼠DTH形成能力无显著性影响,推测可能是某单体皂苷抑制了DNFB的诱导作用,具体有效成分有待进一步研究;然后体液免疫功能方面,Wang等[21]研究发现,人参皂苷Rh1体外对LPS诱导的B淋巴细胞的增殖无明显作用。杨秀伟等[22]对近些年人参及其皂苷的药理学作用的总结中表明,在LPS刺激的巨噬细胞模型中,Rg1能抑制转移生长因子的表达且能显著提高小鼠肿瘤模型的免疫功能。丁艳芳[23]总结近些年对人参皂苷Rh1的药理作用,认为其与Rg1有相似的药理作用。本文林下山参全草能提高小鼠的抗体生成细胞数和血清抗体积数,而人参只能提高小鼠的血清抗体积数,故推测人参皂苷Rd对小鼠的体液免疫有调节作用。
综上,林下山参全草与人参对小鼠免疫功能的影响差异主要在于细胞免疫及NK细胞活性;人参叶多糖对小鼠免疫功能的影响差异主要在于固有免疫和免疫器官;与人参总皂苷对小鼠免疫功能的影响差异主要在于细胞免疫和固有免疫。以上研究说明对小鼠免疫调节的不同作用可能与人参皂苷的种类及其含量有关,且各组分间相互影响。林下山参全草能够调节小鼠免疫功能,主要体现在体液免疫功能方面,对于其免疫调节作用机理及各单体皂苷对免疫调节的影响,还有待于进一步研究。

