Math1基因在内耳毛细胞发育及再生过程中的作用
房冉 ,孟飞龙 ,李高鹏 ,饶琳 ,赵小立 ,2*
(1.浙江大学生命科学学院,浙江杭州310058;2.浙江省细胞与基因工程重点实验室,浙江杭州310058)
0 引 言
哺乳动物的听觉感受器即螺旋器(又称柯蒂氏器)中存在线性排列的内、外感觉毛细胞,在成熟的耳蜗管内,基底膜上的毛细胞被各种支持细胞包围。内耳毛细胞作为感受器在听觉发生中起重要作用,其中外毛细胞负责声音的机械放大,增强感觉上皮对不同声音频率的响应能力,检测低强度声音;内毛细胞负责将声音刺激传递给基底部的神经末梢[1],从而将传到耳蜗的声音刺激转变成神经兴奋,兴奋又沿耳蜗神经传到听觉中枢,产生听觉。但是由于毛细胞对外界刺激非常敏感,年龄、家族遗传、噪声、氨基糖苷类药物等因素都会对毛细胞产生一定的影响,并有可能造成听觉螺旋神经节损伤[2],导致听力障碍或永久性感音神经性耳聋。耳聋已成为全球主要的健康问题之一,越来越多的人受其困扰。研究表明,哺乳动物包括人的毛细胞损伤引起的听力损失是不可逆的,因为损伤的毛细胞无法自发再生[3],在鸟类、两栖类、鱼类中,毛细胞可通过支持细胞转化或者重新进入细胞周期进行有丝分裂产生,并且这种再生机制可以贯穿机体生命的始终[4-7]。目前,对于哺乳动物感音神经性耳聋,只能通过助听器、人工电子耳蜗、中耳移植等辅助手段进行治疗,都未从根本上解决这一难题[8-9]。有研究表明,虽然毛细胞在成熟的哺乳动物体内不能广泛再生,但在新生鼠螺旋器中的支持细胞具有直接转分化为毛细胞的潜力[10-13],与鸟类、两栖类不同的是,这一潜力在出生后的第一周就消失了[14-15]。所以,研究人员试图从此入手,探究哺乳动物中内耳的发育调控机制及毛细胞的再生途径,从根本上解决这一难题。
Math1(Mouse homolog of the drosophila gene atonal)基因编码一种转录因子,在毛细胞分化及成熟过程中起关键作用,引发了研究人员越来越多的关注。Math1最先在果蝇中发现,命名为Atonal,与小鼠中的Math1是同源基因,属于碱性螺旋-环-螺旋(bHLH)蛋白家族。1999年,BERMINGHAM等首次报道了Math1是果蝇原神经基因Atonal的同源基因,在小鼠内耳感觉上皮中表达[16],Math1基因杂合缺陷的小鼠胚胎不能生成耳蜗和前庭毛细胞[17]。也有许多研究阐明,在体外或体内的耳蜗实验中,Math1过表达会促使非感觉支持细胞形成不成熟的毛细胞[18-22],说明Math1在这一过程中起重要作用。
1 内耳发育过程与Math1表达
哺乳动物内耳起源于胚胎的外胚层,首先接近后脑的外胚层局部增厚形成听基板,听基板内陷形成听窝,听窝闭合后形成梨形的听泡。其后听泡脱离外胚层逐渐形成听囊,听囊继续发育形成背侧的前庭部和腹侧的耳蜗部,前庭部分化为椭圆囊、半规管雏形和球囊雏形,耳蜗部分化为耳蜗管始基。接下来,前庭部的椭圆囊、半规管和球囊逐渐发育成熟,耳蜗上皮逐渐发育成感觉上皮,耳蜗继续由底圈向顶圈发育成血管纹和原始螺旋器。哺乳动物的螺旋器主要由内、外毛细胞和支持细胞构成,内毛细胞由大上皮嵴发育而来,外毛细胞由小上皮嵴发育而来,内外毛细胞之间由支持细胞分隔开,并且内、外毛细胞也是由底圈向顶圈逐渐发育成熟(见图1)。毛细胞和支持细胞由听囊发育过程中的感觉前体细胞发育而来[23]。在最初的外胚层发育过程中,成纤维细胞生长因子(FGF)信号通路的激活与Wnt信号通路和骨形态发生蛋白(BMP)信号通路间的相互拮抗,对外胚层的形成具有重要作用[24]。此外,在毛细胞的发育过程中,感觉前体细胞完成增殖后,开始向毛细胞和支持细胞两种细胞类型分化,而分化命运则主要依赖于Math1的表达[25-26]。以小鼠为例,小鼠螺旋器由蜗管的原始感觉区域发育而来[27-28],胚胎12.5 d Math1最先在耳蜗基部表达;胚胎13.5~14.5 d,Math1在中基部的原始毛细胞中表达上调,此后,其表达沿原始感觉区域向顶部扩展,直至胚胎17.5 d,整个螺旋器发育完成[29]。Math1最初表达于所有的感觉细胞,但随着发育分化的进程,Math1在毛细胞中持续表达,在支持细胞中的表达却逐渐下调[25,30-31]。值得注意的是,在胚胎15~17.5 d,Math1对于分化后毛细胞的存活以及毛细胞纤毛束的形成非常重要[32-33]。在此之后,敲除Math1并不影响毛细胞的数量及机械传感器通道的功能,但会导致毛细胞纤毛束形成出现缺陷或紊乱[32]。然而,Math1的表达从胚胎17.5 d后开始下降,出生后第6天降至几乎无法检测到Math1的水平[30],这可能就是哺乳动物内耳毛细胞损伤后再生能力受到限制的原因之一。研究表明,在哺乳动物中,当Math1不表达时,毛细胞不会发育,当过表达时,非感觉细胞也可以转化为毛细胞[17,21,31]。当然,在整个内耳发育及毛细胞形成过程中,仅有Math1存在是不够的,并且Math1的精确时空表达及表达量的维持,还需要上下游基因及其所形成的分子环境的共同调控。

图1 内耳听觉系统及耳蜗解剖示意图Fig.1 The inner ear hearing system and cochlear anatomical diagrams
2 Math1调控内耳毛细胞发育
2.1 Math1及其相关信号通路调控内耳毛细胞发育
2.1.1 BMP信号通路
在毛细胞感觉前体细胞增殖过程中,BMP、FGF等信号通路发挥着重要作用。骨形成蛋白(BMP)属于转化生长因子β(TGF-β)超家族,其配体在许多动物物种的耳部发育中表达,包括前体感觉区域及感觉细胞[34-35]。BMP信号通路对感觉前体细胞及毛细胞的调控,主要是通过抑制Math1的表达来维持感觉祖细胞的未分化状态[36]。通过分离的听囊实验发现,在感觉前体细胞中,Bmp4抑制Math1的表达,相反,抑制Bmp4的活性能增强Math1表达及毛细胞的生成[36]。进一步研究表明,BMP信号通路对Math1的调控作用主要通过调节Ids基因的表达来实现(见图2),Ids作为BMP信号的应答基因在毛细胞分化命运的决定中发挥重要作用[37-39]。Ids基因是与碱性螺旋-环-螺旋转录因子家族(b-HLH)有关的分化抑制基因,IDS蛋白含有与其他保守b-HLH蛋白进行二聚体反应所需要的HLH保守结构域,但缺乏DNA结合结构域。由于b-HLH(如Math1)与DNA结合之前需要与其他广泛表达的b-HLH结合形成功能性的异二聚体,然而IDS蛋白的竞争性结合,阻止了功能二聚体的形成,抑制了细胞分化的起始[40]。研究表明,Id1,Id2和Id3在耳蜗的蜗管中广泛表达,并且在分化之前的耳蜗祖细胞中Ids与Math1重叠表达,在分化的毛细胞中却特异地表达下调,但此阶段的祖细胞中仍然持续表达Ids,并且抑制其向毛细胞分化[40]。在鸡胚听囊的前体感觉区域中Bmp4、Bmp7与Ids一同表达,并且在该区域内BMP激活的Smads磷酸化形式Smad1,5,8高水平表达。此外,增强BMP信号能够诱导Id1-3的表达,进而抑制Math1功能的发挥,并且毛细胞的分化过程中Bmp4、Smad1,5,8以及Ids的表达水平都出现下调现象[39]。以上表明,BMP信号通路以及Ids的表达对毛细胞感觉前体细胞的维持及分化起重要作用。
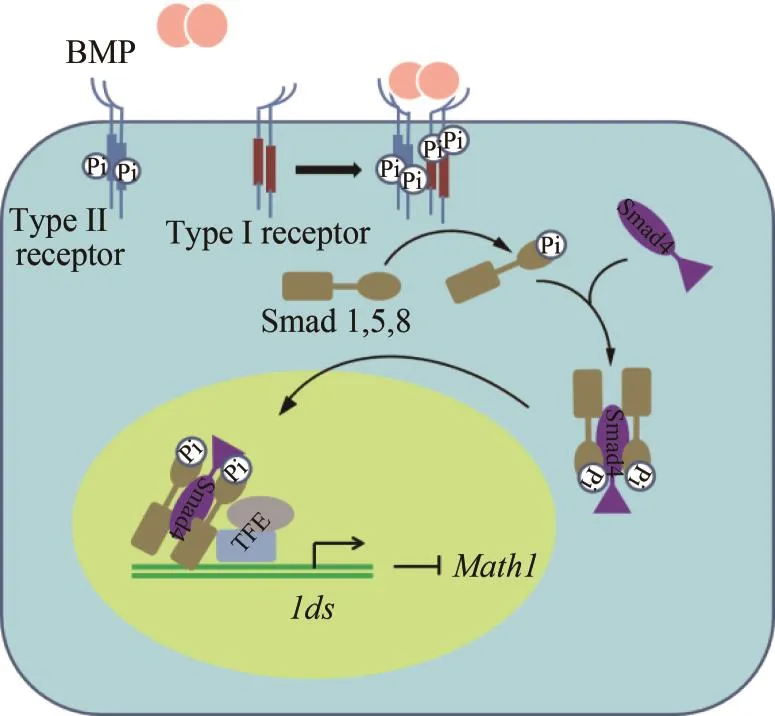
图2 BMP信号通路示意图Fig.2 BMP signaling pathway所示内容为:BMP信号活化受体,磷酸化胞内蛋白,激活Ids基因的表达,从而抑制Math1功能二聚体的形成,维持细胞的未分化状态。
2.1.2 FGF信号通路
成纤维生长因子(FGFs)信号通路通过7个受体酪氨酸激酶异构体发挥其功能(见图3),在细胞生长、分化、运动和生存等方面发挥重要作用[41]。在整个内耳发育过程中,不仅调控早期听囊的形成,还调控后期感觉毛细胞的形成。研究人员在对鸡和斑马鱼的内耳研究中发现,在最初的听基板发育过程中,Fgf3单独或Fgf3和Fgf8两者功能的缺失都足以造成整个耳组织异常。在青蛙和鸡中Fgf3或Fgf2过表达能够促使听囊的形成。在斑马鱼的听基板和听囊的发育过程中,Fgf3和Fgf8作为上游基因激活Math1的表达[42]。在小鼠胚胎14 d,抑制FGF信号通路能降低Math1基因的表达,并且影响毛细胞与支持细胞的形成。在Fgf2存在的情况下,许多神经营养因子(NGF,BDNF,NT-3)能够促进Math1的表达[43]。此外,Fgf20也通过FGFR1(成纤维生长因子受体1)及激活转录因子PEA3和ERM间接激活Math1的表达[43-44],组织特异性敲除Fgfr1会导致毛细胞支持细胞的严重缺陷[44],具体作用机制尚待进一步研究。
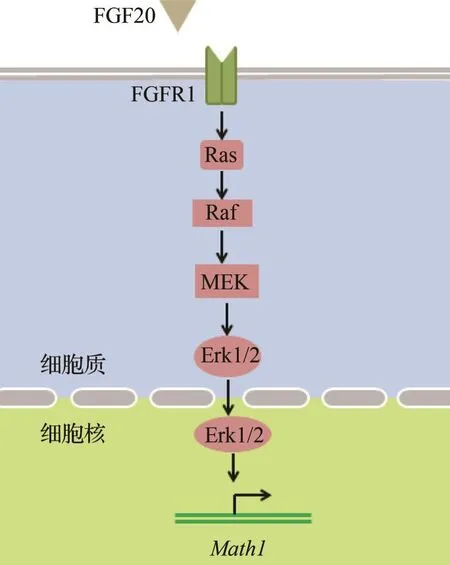
图3 FGF信号通路示意图Fig.3 FGF signaling pathway所示内容为:FGF信号通路中,FGF20/FGFR1通过激活MEKERK通路,对Math1基因发挥正向调控作用。
2.1.3 Notch信号通路
Notch信号通路通过细胞间接触依赖性作用方式发挥作用(见图4)。其信号分子及其受体都是膜整合蛋白。信号转导的启动依赖于信号细胞的信号蛋白与相邻应答细胞的受体蛋白的相互作用,激活的受体发生2次切割,释放转录因子,调节下游靶基因的表达,从而决定细胞的分化方向。在决定毛细胞与支持细胞的分化命运方面,Notch信号通过抑制Math1的正常表达,阻断感觉前体细胞向毛细胞分化,并最终分化为支持细胞。单独敲除Notch信号配体Delta-like(Dl1)或Jagged 2,可导致感觉毛细胞显著增加[45-46]。对于Notch信号通路对Math1的调控作用,相关研究表明,Math1在新生毛细胞中的选择性上调决定毛细胞的最终分化结果,但这一说法遭到后人质疑,Math1最初可能在祖细胞中表达上调,随着发育的成熟,最终在所有毛细胞和部分支持细胞中表达[30,47-48]。也就是说最终毛细胞结构的形成并不依赖于原始感觉域内特异表达Math1的阳性细胞,而是通过复杂的阻抑机制来抑制Math1在这些细胞中的表达,从而形成各种类型的支持细胞[49]。Hes和Hey家族作为b-HLH转录抑制因子,在机体发育过程中靠Notch信号通路发挥作用[50-52]。当前的模型研究显示,在内耳发育过程中,一旦Math1在新生的毛细胞中表达,Notch信号通路就会刺激Hes/Hey在临近前体感觉细胞中表达,从而使这些感觉前体细胞分化为支持细胞[30](见图5),并且,Hes/Hey的表达对支持细胞的维持起重要作用[53-54]。近来,研究者对这一抑制机制做了进一步解释,表明毛细胞与支持细胞的分化命运与Hes/Hey在Math1启动子上高度保守位点的结合有关,并且确认了这一位点,在原始感觉域中,Hes/Hey结合在Math1启动子上能及时抑制Math1的表达,最终向支持细胞方向分化。当解除这一抑制作用时,又能够刺激Math1的表达[49]。
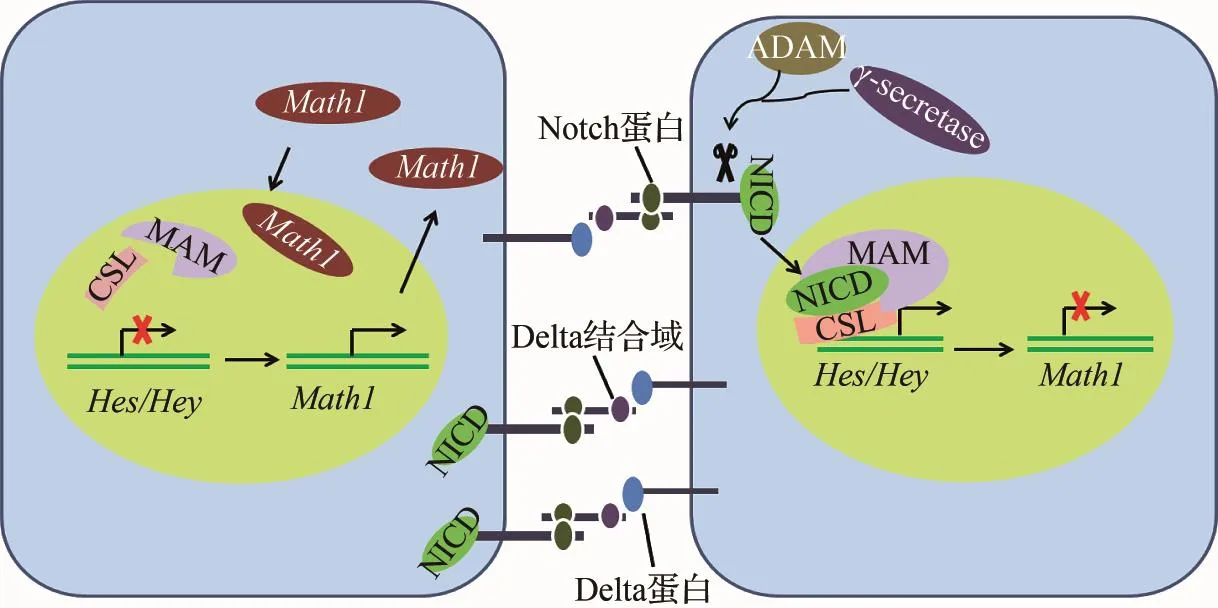
图4 Notch信号通路示意图Fig.4 Notch signaling pathway当信号细胞未与相邻的效应细胞相互作用时,Notch蛋白存在于胞内;当效应细胞与信号细胞的配体Delta蛋白结合时,效应细胞的受体被蛋白酶切割,释放Notch蛋白胞内结构域(NICD),后者入核并与核转录因子作用,激活转录。
2.1.4 Wnt-β-catenin信号通路
Wnt-β-catenin信号通路主要由Wnt信号分子及膜受体Frzzled和辅助受体LRP5/6组成,βcatenin作为转录调控蛋白,在胞质中的稳定及核内的累积是Wnt信号发挥作用的关键(见图6)。Wnt信号分子能促使β-catenin从胞质蛋白复合物中释放出来,从而调控基因的表达。在内耳发育过程中,Wnt信号通路在前庭的形成及耳蜗发育中起调控作用。有研究表明,在耳蜗发育过程中,Wnt信号通路作为Math1及Sox2的上游基因发挥作用,并且在听基板的发育过程中,Wnt信号的浓度决定听基板形成的大小[55-57]。在耳蜗的早期发育过程中,Wnt信号通路在耳蜗前体感觉细胞中表达上调,并且通过制止Wnt信号通路的表达阻碍感觉前体细胞的形成[58]。SHI等[55]发现,在神经前体细胞中,β-catenin与转录因子TCF/LEF以复合体的形式结合在Math1基因的增强子区域,并且起正向调控作用。这一结果也在后续研究中得到证明,并且体内与体外实验均显示,刺激Wnt信号的表达能增加Math1的表达,导致额外毛细胞的形成[58-59]。相反,抑制Wnt信号的表达会降低Math1的表达,继而影响毛细胞的形成。最近有研究表明,Wnt信号通路和Math1对新生耳蜗毛细胞的生成和存活具有协同效应[60],并且Math1的过表达与β-catenin的激活相结合,既能促进细胞的增殖又能形成新的毛细胞,而且新生的毛细胞能够存活到成年[60]。此外,一个单次跨膜蛋白Kremen1,也通过调控Wnt信号通路对毛细胞的分化命运产生影响。Kremen1作为DKK信号的受体蛋白,对Wnt信号通路起拮抗作用,当DKK信号与Kremen1蛋白结合形成复合体时会阻断Wnt信号通路,最终导致β-catenin的表达下降,从而影响毛细胞的命运[61]。有研究表明,Kremen1过表达极大地抑制了毛细胞的发育,并且促使受影响的细胞发育为支持细胞,而降低Kremen1的表达水平则会导致细胞向毛细胞方向发育,推测可能是通过影响Wnt信号通路来实现的[62]。
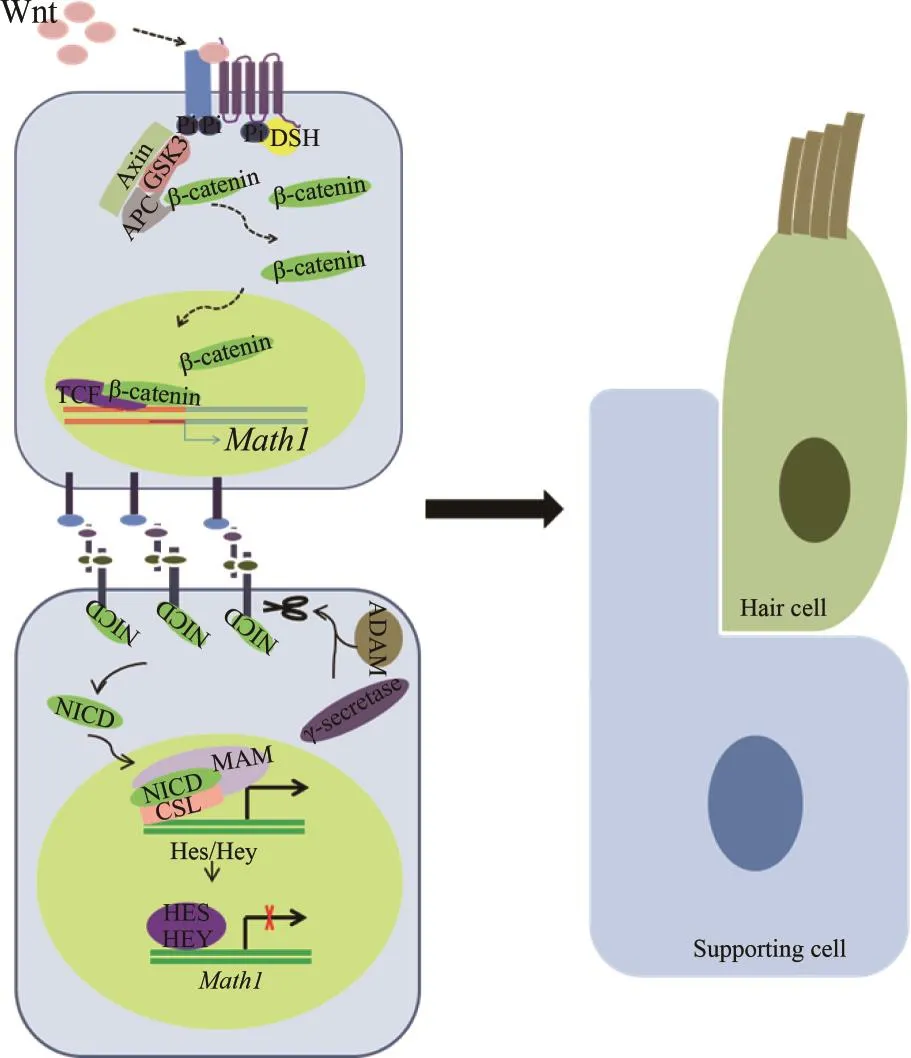
图5 Wnt和Notch信号通路在感觉前体细胞共同调控作用示意图Fig.5 Wnt and Notch signaling pathways controlling cell fate choices in the prosensory cellsWnt信号通路促进Math1在新生毛细胞中表达,此时新生毛细胞作为信号细胞,激活效应细胞的Notch信号,Notch信号蛋白就会刺激Hes/Hey在临近前体感觉细胞中表达,从而使得这些感觉前体细胞分化为支持细胞。
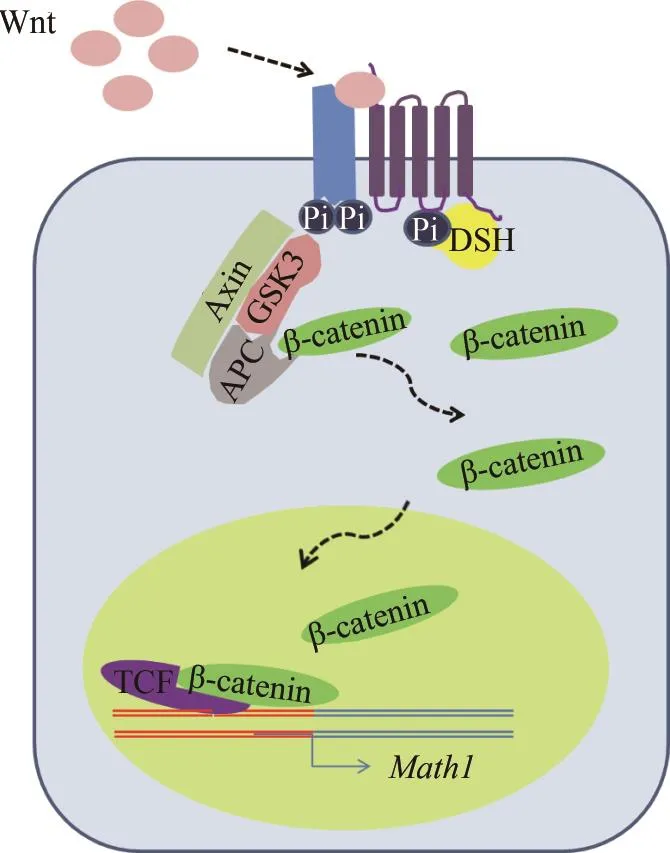
图6 Wnt-β-catenin信号通路示意图Fig.6 Wnt/β-catenin signaling pathway缺乏Wnt信号时,β-catenin与胞质蛋白复合物结合,以复合体的形式存在,不能发挥作用;当Wnt信号存在时,能激活一系列的磷酸化反应,致使β-catenin从蛋白复合体中解离出来,转位到核内,与核内转录因子TCF结合靶基因激活转录。
上述信号通路之间相互作用,共同调控内耳的发育过程。在最初听基板的发育过程中,Wnt和Notch信号通路共同决定听囊向耳蜗或前庭系统分化的方向[57];并且共同参与调控毛细胞的形成以及感觉前体细胞的分化[12,31,58,63],此外,2个信号通路之间存在相互作用,有研究表明,Notch信号的受体调控Wnt信号通路中β-catenin的稳定性,并且Notch信号的配体JAG1是Wnt信号的靶基因[64-66],在小鼠的听基板中,β-catenin不足会抑制JAG1的表达。另外,Wnt信号通路一个非常重要的基因Dishevelled能与Notch信号受体的胞内区域结合,使其内化[67-68]。
2.2 Math1及其相关基因调控内耳毛细胞发育
Math1是毛细胞分化及维持过程中重要的分化基因,但是这一功能的发挥是在许多其他因子共同协调作用下完成的[69](见图7)。转录因子如Sox2、PAX2、EYA1、GATA3等,先于 Math1表达,同时影响毛细胞的分化过程[70-72],而Math1同时调控下游上百个基因的表达。
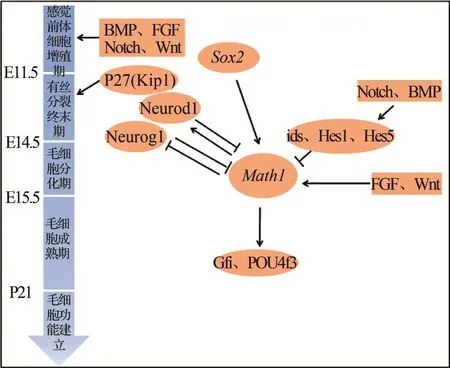
图7 小鼠内耳毛细胞发育的基因调控示意图Fig.7 Genes regulation pattern in mice inner ear development
Sox2是高活性族-盒转录因子,属于Sox蛋白家族的b1亚族[73]。Sox2是感觉前体细胞的标志基因,在感觉前体细胞中广泛表达,并通过激活和上调Neurog1与Math1的表达来促进祖细胞向神经和感觉细胞方向发育[74]。有研究表明,感觉祖细胞晚期向毛细胞分化时需要Sox2的表达,并通过浓度依赖的分子间相互作用与Math1的3端增强子结合来刺激Math1表达[75],Sox2的下调将诱导神经和感觉祖细胞的分化[76]。在敲除Sox2的突变体时,即使在祖细胞完全成熟后的阶段,Sox2的缺失也会影响毛细胞的发育、抑制新生毛细胞的正常分化,形成甚至导致毛细胞和支持细胞的丢失[75]。Sox2在内耳发育早期表达于前体细胞,随着前体细胞发育为毛细胞和支持细胞,Sox2则仅限于支持细胞中表达[77]。由此表明,Sox2在感觉前体细胞发育过程中发挥着关键作用。
Gfi1是锌指转录因子家族中GPS(Gfi1/PAG-3/SENS)家族的成员。在毛细胞的发育过程中,锌指转录因子Gfi1对毛细胞的正常分化和成熟起重要作用。小鼠胚胎12.5 d时,Gfi1的mRNA在中枢神经系统、外周神经系统及许多感觉上皮都有表达,包括发育中的内耳上皮细胞。在后期的发育过程中,Gfi1的表达贯穿于内耳毛细胞及神经元的发育。并且在毛细胞中,Gfi1是Math1的下游目标基因[78]。有研究表明,在胚胎15.0 d时的内毛细胞及胚胎15.5 d的外毛细胞中,Math1和Gfi1两种蛋白共同表达[79]。后来的转录组分析也证实它们在毛细胞分化后期共表达[80]。
在小鼠中,当Gfi1基因存在缺陷时,即使内耳毛细胞的形成不受影响,但前庭和耳蜗毛细胞仍然表现出杂乱无章的现象。此外,在Gfi1突变小鼠中,所有耳蜗毛细胞在出生前后都会以凋亡的方式缺失[78]。所以,Gfi1对毛细胞的存活起重要作用,在胚胎13.5~15.5 d,Math1活性对毛细胞的生存至关重要。推测可能是Math1通过调节Gfi1的表达来防止细胞死亡或者二者共同调节毛细胞的存活[81]。但具体的相互作用机制尚待进一步研究。
POU4F3,POU家族成员中的POU域4型转录因子3,也是毛细胞发育过程中的重要转录因子,在小鼠中,Pou4f3在内耳的耳蜗和前庭毛细胞中高表达,并且对毛细胞的最终分化及成熟至关重要[82-84]。在前庭的感觉上皮中,Pou4f3在胚胎12.5 d开始表达,在耳蜗中,Pou4f3在胚胎14.5 d开始表达,并且也是沿螺旋器由基底部向顶部逐渐表达[20,79,83]。在Pou4f3突变的小鼠中,Gfi1的表达也会受到影响,敲除Pou4f3不仅使毛细胞在形态上表现出缺陷、畸形、缺乏纤毛结构、前庭毛细胞错误定位及毛细胞退化现象,而且导致前庭和耳蜗毛细胞凋亡[82-83,85]。但是Gfi1和Pou4f3单独作用,不能起始毛细胞的分化,而这一过程中,Math1的作用是至关重要的[81]。Pou4f3作为Math1的下游基因,同样受Math1的直接调控[86-87]。近来,MASUDA等[88]在转基因小鼠中通过染色质免疫沉淀的方法得到,在POU4F3 5,端的近端保守域和远端保守域存在着Math1,TFE2,GATA3,NMYC,ETS2和ETV4等转录因子的结合位点,并且Math1与其他转录因子共同作用于Pou4f3上游时比Math1单独作用更能促进Pou4f3的表达。
Neurod1是bHLH转录因子家族中的一员,参与内耳感觉神经元的发育、小脑颗粒细胞的形成、视网膜神经节的形成等多种细胞分化过程的调节[89-91]。在内耳感觉神经元发育过程中,Neurod1基因调控螺旋神经节神经元前体细胞退出细胞分裂周期,开始向成熟感觉神经元分化。在内耳发育中,Neurod1作为Math1的下游基因,Math1基因表达的沉默会导致Neurod1基因表达的缺失[20],同时Neurod1对Math1的表达也存在负反馈调节作用,由于Math1存在自我调控回路,能刺激自身表达,而Neurod1以负反馈调节的方式使Math1的表达维持在相对稳定的状态。有研究表明,在Neurod1基因敲除小鼠时,Math1会过度表达,并且使感觉神经元转化成毛细胞[92]。与Neurod1类似,Neurog1也在听囊发育的早期阶段调控感觉神经元的分化,并与Neurod1存在相互调控关系。在内耳的球囊和椭圆囊发育过程中,神经发生与毛细胞形成在时间上存在一定的重叠,作为调控两部位发育的关键基因,Neurog1与Math1相互拮抗共同促进内耳感觉神经元和感觉上皮的发生,Math1的缺失会导致曾表达Neurod1的感觉区域出现神经细胞过量及异常发生。同样,降低Neurog1的表达量会使表达Math1的细胞增多,并且这种效应具有剂量敏感性[93]。
2.3 内耳毛细胞发育过程中Math1的表观遗传学调控
组蛋白修饰在基因沉默和发育调控过程中起至关重要的作用。5种组蛋白(H1、H2A、H2B、H3、H4)残基的磷酸化、乙酰化、泛素化、甲基化、腺苷酸化、ADP核糖基化等修饰作用之间既相互协同,又互相拮抗,共同调控基因的表达及机体的发育过程。Math1作为内耳毛细胞发育的关键基因,其时空表达同样受组蛋白修饰的影响,尤其是组蛋白H3,如其第4位赖氨酸残基的甲基化与基因激活相关,第9位与第27位赖氨酸残基的甲基化与基因沉默相关[94]。有研究发现,在小鼠胚胎干细胞中,三甲基化的H3K27(组蛋白H3第27位赖氨酸)在Math1启动子区域富集,从而抑制Math1在该细胞中的表达。并且这些激活基因(H3K4me3)或抑制基因(H3K27me3)的二价表观遗传标记在内耳前体感觉细胞和新生支持细胞内的Math1基因座中都有出现[95]。近来,STOJANOVA等[29]利用µChIP技术和qPCR检测流式纯化的小鼠耳蜗感觉前体细胞,追踪Math1在感觉上皮发育过程中的表观遗传变化,发现H3K4me3(组蛋白H3第4位赖氨酸三甲基化)/H3K27me3,H3K9ac(组蛋白H3赖氨酸9乙酰化)和H3K9me3组蛋白修饰的动态变化,即从静止到激活再到沉默的过程与Math1表达的起始及其后的表达沉默相关联。在感觉前体细胞阶段,组蛋白通过抑制Math1来维持其未分化状态,在毛细胞分化过程中,Math1的表达依赖于H3K27的甲基化及H3K9组蛋白的乙酰化[96],并且抑制组蛋白的乙酰化还会造成螺旋器由基底圈向顶圈发育过程中Math1表达的受阻,同时影响毛细胞的分化形成。在毛细胞成熟阶段,Math1的下调与组蛋白H3的去乙酰化及H3K9me3的富集有关。这种二价组蛋白修饰模式为毛细胞发育过程中Math1瞬时表达调控机制的研究提供了新的思路。
2.4 MicroRNA在内耳毛细胞发育过程中对Math1的表达调控
MicroRNA(miRNA)是由内源基因编码,长度约为22个核苷酸的非编码单链RNA分子,在动植物中参与基因转录后表达调控。除了参与感觉器官的发育和成熟,还与肿瘤、神经、自我免疫缺陷等疾病的发生有关。目前,发现miR-183家族(miR-96、miR-182、miR-183)、miR-200a、miR-200b、miR-15a1、miR-18a、miR-124等 microRNA在内耳发育过程中都有表达。对miR-183家族在小鼠内耳、大脑、心脏及整个胚胎中表达状况的研究发现,与其他部位相比,miR-183家族在内耳中限制性表达[97]。此外,miR-96的种子区域突变,会造成人类非综合征型耳聋[98]。在感觉神经元与毛细胞形成过程中,miR-183家族在Neurog1和Math1的下游发挥功能,并且在内耳中Math1的缺失会造成阳性表达miR-183的细胞消失。近来,EBEID等[99]通过全转录组实验比较Math1和miR-183家族对多能干细胞及多能耳祖细胞的影响发现,miR-183家族与Math1联合表达不仅有利于毛细胞命运的决定,而且有利于其他毛细胞特异基因的表达。这种MicroRNA与Math1相结合的调控途径为毛细胞再生及维持研究提供了新的思路。
3 Math1与毛细胞再生
在鸟类的基底乳头中,通过2种不同的机制使毛细胞再生,即支持细胞可以增殖并分化成毛细胞,也可以进行重新编程转分化为毛细胞[100]。这种转分化可能是由基底乳头受到损伤后Math1的表达被重新激活所致[101]。在斑马鱼的侧线中,感觉细胞再生是通过支持细胞进行增殖,然后,其中一部分增殖的细胞分化成毛细胞的机制实现的[102]。近来有研究表明,Wnt信号通路在这一过程中起重要作用,激活Wnt信号的表达可促进增殖,抑制其表达会使进行分裂的细胞减少[103]。也有研究表明,Wnt只能促进支持细胞的增殖,但不能起始毛细胞再生。毛细胞再生需要Notch、FGF等信号通路发挥作用,这些通路成员的表达会在毛细胞死亡后立即出现下调现象[104]。Notch信号可以通过调节细胞周期抑制剂的表达来阻止细胞的增殖,从而降低支持细胞的活性,诱导其向毛细胞分化。研究人员利用γ-分泌酶抑制剂抑制Notch信号通路,可以增加损伤后的斑马鱼侧线或鸡耳蜗中的再生毛细胞数量[105-106]。
但成熟的哺乳动物听觉感受器中的毛细胞损伤后不能自发再生。小鼠出生后毛细胞周围的支持细胞转变成毛细胞的能力就会下降,直至一周内消失。哺乳动物毛细胞的再生能力与鸟类等非哺乳动物存在巨大差异,是因哺乳动物支持细胞本来就不能增殖再生成毛细胞,还是因存在某种缺陷或者存在抑制再生信号,具体原因尚不明确。研究人员进一步研究发现,如果将哺乳动物的支持细胞放在培养基中培养,确实能够增殖和分化成毛细胞,由此推测这是由于毛细胞创伤后体内存在抑制作用信号,从而影响其再生作用[13]。研究人员试图利用鸟类等内耳再生机制实现哺乳动物中的毛细胞再生。Math1作为实现毛细胞再生的首选基因,已分别在小鼠的胚胎期、新生期、成年期的耳蜗中过表达,而在胚胎干细胞水平上的过表达也在不断探索中[107-108],并且取得了不同的效果。与成年期相比,胚胎和新生期Math1的过表达能够使更多的支持细胞分化成毛细胞,并且更好地恢复听力[109]。但是,由于用来转分化的支持细胞的数量有限,转分化得到的毛细胞并不能达到完全成熟的状态,此外,支持细胞的转分化受年龄的限制,单独过表达Math1还不足以达到理想的效果,尚需其他信号通路或因子的共同调控[110]。
在哺乳动物前庭中,前庭毛细胞损伤会抑制Notch信号的表达,支持细胞能够激活Math1基因的表达并且转变为成熟的毛细胞[111-113]。椭圆囊中的损伤会伴随着Math1的上调及Notch信号靶基因Hes5的下调。众多研究表明,在新生小鼠中,通过γ-分泌酶抑制剂抑制Notch信号通路能够促进毛细胞再生。此外,在未受损的新生小鼠耳蜗中,抑制Notch信号通路也可以使支持细胞转变成新生毛细胞[114-115]。由此说明哺乳动物存在像非哺乳动物中的毛细胞再生的潜力。虽然目前在哺乳动物耳蜗中还未能形成成熟的具有功能的毛细胞,但这些结果表明,Notch信号通路在支持细胞与毛细胞的分化中起关键作用,也为损伤毛细胞的再生提供了一种有效的研究思路。
Wnt信号通路可以通过促进细胞增殖以及Math1表达来促使毛细胞再生[63,116-117]。在这一过程中,Lgr5(富含亮氨酸重复序列G-蛋白偶联受体5,Leucinerich repeat-containing G protein-coupled receptor 5,Lgr5)发挥了重要作用,Lgr5作为Wnt信号的靶基因,在小鼠胚胎期的蜗管感觉前体细胞中广泛表达,但出生后Lgr5的表达只限制在支持细胞[118]。CHAI等[63]假设Lgr5阳性细胞是Wnt响应的感觉前体细胞,将其从新生的转基因小鼠(Lgr5-EGFP-CreERT2/+)中分离出来进行体外培养,发现有新的感觉细胞形成并显示特定的毛细胞标志基因(Myo7a,Calretinin,Parvalbumin,Myo6),而且表现出纤毛样结构并表达F-actin和Espin等标志基因。在体内过表达β-catenin能够促进耳蜗感觉上皮细胞的增殖,并且导致Lgr5阳性细胞在耳蜗感觉上皮上瞬时扩增。后来,SHI等[116]也证实维持βcatenin在新生动物支持细胞的稳定能促进支持细胞的增殖及毛细胞的产生,并且,Wnt/β-catenin能促使Lgr5阳性细胞向毛细胞的祖细胞方向发育,以决定细胞的分化命运。
近来,许多研究表明,多个基因(Pou4f3,Gfi1,Math1)共同作用比单独过表达Math1更能促进胚胎干细胞向毛细胞方向分化[119]。有研究表明,敲除p27Kip1基因同时过表达Math1基因克服年龄相关的衰退,能使成熟的鼠耳蜗在遭受损伤后其支持细胞转化为毛细胞。但在新生小鼠中,一些受影响的细胞出现了死亡现象,而且,转化后的毛细胞不能进一步成熟,这一结果并不比Math1单独过表达取得的效果好。p27在成熟的支持细胞中抑制Gata3的表达,然而Gata3能促进Math1调控的成熟支持细胞向毛细胞转化。此外,Pou4f3表达上调同样对Math1调控的支持细胞向毛细胞转化起重要作用。虽然,单独过表达Pou4f3或者Math1也足以引起成熟支持细胞中毛细胞特异基因的表达上调,但Math1基因与Pou4f3基因联合的过表达能促进更多支持细胞转化成毛细胞。在胚胎及新生小鼠的耳蜗中,将Math1与Tcf3,Gata3,Etv4,N-Myc或Ets2共表达比Math1单独过表达能产生更多的毛细胞[120-121]。
4 结语与展望
内耳的发育是一个极其复杂的过程,在此过程中任何生物化学因素或者分子途径的异常都会导致听力损失或前庭功能紊乱,并且听力受环境、遗传等多种因素的影响,听觉功能受损最常见的就是感觉神经障碍,每500个新生儿中就有一个患儿,此外,这种障碍对大部分老年人也有影响。与哺乳动物听觉相关的感觉毛细胞,损伤后不可自发再生,一旦感觉细胞足量损伤或死亡,就会导致永久性感觉神经性耳聋。所以,阐明感觉毛细胞背后的损伤、修复及再生机制,对于临床诊断和治疗是至关重要的。近年来,研究人员已在内耳毛细胞的发育及再生方面取得了很大进展,包括发现调控毛细胞发育及分化的关键基因Math1,与Math1有关的BMP信号通路、FGF信号通路、Notch信号通路、Wnt-β-catenin信号通路,相关基因、表观遗传调控等都在毛细胞的发育及分化中起关键作用。应用基因、干细胞和分子疗法以及基因编辑等技术来恢复听觉功能取得了一定进展。但目前得到的毛细胞仍然是未成熟的,缺乏正常的毛束且未能表达成熟的毛细胞标志基因Prestin等,另外还会出现一些明显的凋亡迹象。要想得到完整且具有功能的毛细胞,仍存在巨大挑战,各种生物化学因素以及分子途经会影响毛细胞的再生,此外,合适的定位、有序的排列、适当的整合以及足够的神经支配细胞等因素,也会影响毛细胞正常功能的恢复,进而阻碍听力功能的恢复。未来,有待发现更多与毛细胞发育及再生相关的基因,并且在基因、分子和干细胞水平上进一步研究听力恢复机理。

