小鼠后肢特异表达基因的筛选及验证
王茂春,段维旺,李凯,周宇荀,肖君华
(东华大学生物研究所,上海 201620)
哺乳动物的肢体发育是一个自身基因按时空被严格调控表达的过程,涉及细胞增殖、分化、迁徙和凋亡[1-6]。其中,Hox、Fgfs和Shh等信号通路发挥着重要作用。模式动物的研究表明,这些通路相关基因突变会造成的肢体发育缺陷。Hoxd12、13突变小鼠表现出前肢腕骨、掌骨和指骨不同程度的畸形[7-8]。小鼠Hoxa和Hoxd基因簇发生缺失突变时,小鼠肢体在发育早期停止发育,表现出严重的肢体远端组织的缺失,并且Shh的信号通路无法生成[9]。在人类中存在因肢体发育异常造成的出生缺陷,美国疾病控制中心(CDC)调查数据显示,在美国每年约有1500 例上肢缺陷和700 例下肢缺陷新生儿,发病率达到了0.02% ~ 0.04%[10]。对于肢体发育的研究越来越受到生物学和医学的重视。
关于前后肢发育是如何被分别调控的,相关的研究目前较少。Logan等[11]通过鸡胚模型研究表明,将该后肢发育的信号来源极化活性区移植到前肢,会诱导异位的后肢结构。已有的文献表明,通过鸡胚和小鼠等模型的研究发现前后肢的形态分别受Tbx5/4基因所影响,Tbx5 基因的产物与前肢发育有关,而Tbx4 基因产物与后肢的发育相关[12-14]。Nemec等[15]研究表明后肢特异表达的Pitx1基因对于后肢形态的形成起着重要的作用。
本研究通过小鼠前后肢基因表达谱芯片差异基因的聚类分析及信号通路分析,获得后肢特异表达核心基因,并通过qPCR验证部分基因,为哺乳动物肢体发育研究提供基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
8周龄SPF级C57BL/6 J小鼠(3只雄鼠,体重24 ~ 26 g;6只雌鼠,体重18 ~ 20 g),购自上海斯莱克实验动物有限公司【SCXK(沪)2017-0005】,饲养于东华大学实验动物房【SYXK (沪) 2014-0022】,环境温度20 ~ 24℃,相对湿度40% ~ 70%,期间给予充足的饲料及洁净饮用水。小鼠饲料为上海普路腾生物科技有限公司生产的辐照大小鼠繁殖料【沪饲证(2014)04001】。所有动物实验操作均得到东华大学实验动物委员会批准(编号:东华伦审[2018] 6号)。
1.1.2 主要试剂及仪器
Trizol试剂(Invitrogen公司,美国),First Strand cDNA Synthesis Kit逆转录试剂盒(Thermo Fisher Scientific公司,美国),SuperReal PreMix Plus qPCR试剂(天根生化科技有限公司,中国)。
Nanodrop 2000c核酸定量仪(Thermo Fisher Scientific公司,美国),PCR仪(Bio-Rad公司,美国),7500实时荧光定量PCR仪(Applied Biosystems公司,美国)。
1.2 方法
1.2.1 RNA抽提
实验鼠采用一雄两雌的方式合笼,次日清晨通过观察阴栓判定孕期,如果见栓记为0.5 d,在雌鼠怀孕10.5 d时,使用脊椎脱臼法牺牲母鼠,剖取胎小鼠,使用Trizol试剂抽提胎鼠前后肢胚芽RNA,使用Nanodrop 2000c进行RNA浓度及纯度的检测,RNA保存在-80℃备用。
1.2.2 芯片数据下载
小鼠前后肢基因表达芯片数据下载于National Center for Biotechnology Information Gene Expression Omnibus(NCBI GEO)数据库(GSE30138)。
1.2.3 基因表达验证
采用Thermo Fisher Scientific公司的First Strand cDNA Synthesis Kit试剂盒,按照操作说明进行1 μg RNA逆转录,包括3个前肢胚芽RNA及3个后肢胚芽RNA。使用ddH2O将得到的cDNA进行5倍稀释。按照下列体系进行qRT-PCR检测,包括:10 μL SuperReal PreMix Plus,0.4 μL Rox,2.5 μL cDNA模板,300 nmol/L的上下游引物,补水至20 μL,同时设置阴性对照。采用两步法PCR反应程序进行反应:95℃预变性2 min;95℃ 15 s,62℃ 32 s,40个循环,每个样本做3个重复。结果使用相对定量的方法进行分析,数据以平均值±标准误差表示,采用t检验进行组间差异统计分析,P< 0.001差异有显著性。
1.3 数据分析
使用Transcriptome Analysis Console软件对原始数据(5个前肢E10.5 d芯片及4个后肢E10.5 d芯片)进行质控,利用差异倍数为2倍以上或0.5倍以下及P值小于0.05进行数据过滤,使用软件的Volcano Plot及Hierarchical Clustering功能进行差异表达基因的火山图绘制及聚类分析。根据聚类分析结果将后肢特异表达的差异基因导入DAVID数据库,进行Gene Ontology(GO)功能分析,将后肢特异表达的差异基因导入Geneminia数据库,进行基因分子网络绘制。
2 结果
2.1 小鼠前后肢差异表达基因及功能分析
为了了解哺乳动物前后肢基因表达谱差异及差异基因的生物学功能,我们首先将芯片数据进行质量检查及标准化,对比分析前肢及后肢组间差异表达的基因。差异基因分析结果如图1所示,以差异倍数为2倍以上或0.5倍以下及P值小于0.05进行数据过滤,小鼠胚胎E10.5 d后肢相较于前肢差异表达的基因共有275个:其中红色的点表示上调的基因,共45个;蓝色的点表示下调的基因,共230个。将差异基因列表导入David数据库,进行GO分析,结果如表1所示,这些差异表达的基因主要涉及基因的转录翻译调控、多器官的发育、骨骼系统的发育、细胞粘连和细胞分化等方面的功能。

表1 差异表达基因参与的前15个生物过程Table 1 Top 15 biological processes involving the differentially expressed genes
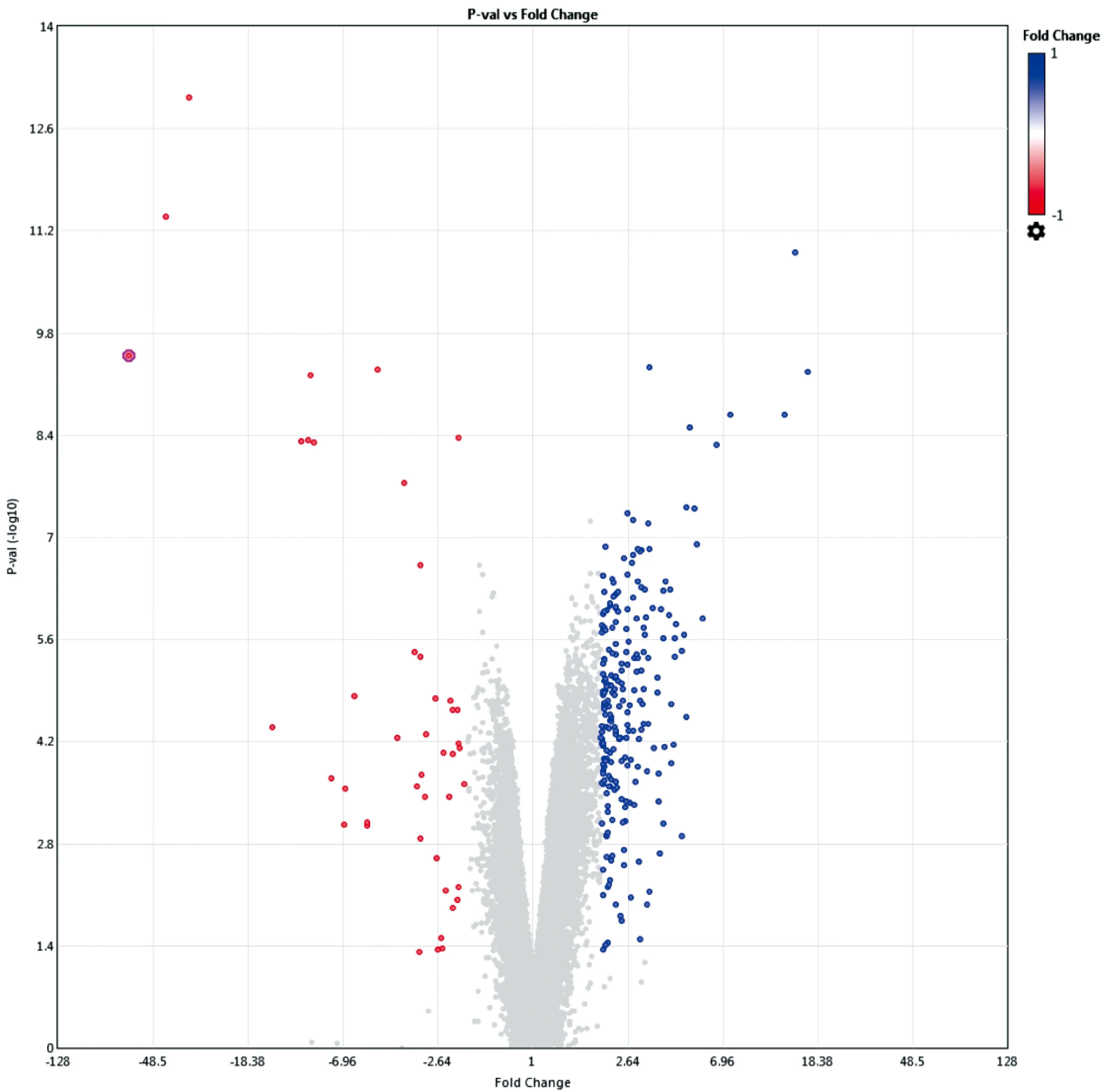
图1 前后肢差异表达基因的火山图Figure 1 Volcanic map of the differentially expressed genes in the fore and hind limbs
2.2 聚类分析
为了进一步确认后肢特异表达的基因,我们将差异表达的基因进行了层次聚类分析。层次聚类分析结果如图2所示,我们可以看到前后肢差异表达基因可以分为4个cluster, cluster 1显示前肢和后肢表达量都较高,cluster 2显示前肢和后肢表达量都较低,cluster 3显示前肢表达量较高,后肢表达量较低,cluster 4显示后肢表达量高,前肢表达量低。同一天相较于前肢,后肢在特异表达的基因对于后肢发育起到更突出的作用。
2.3 分子网络图
为了了解后肢特异表达的差异基因在分子层面相互作用关系,我们通过聚类分析,将cluster 4仅在后肢特异表达的基因进行基因相互作用分子网络图的绘制(图3)。共表达前十个基因为:Upk3b、Aldh1a2、Hoxb9、Hoxc9、Tcf3、Gata6、Prrx2、Crmp1、Pitx1、Agrp;基因相互作用核心节点前十个基因:Ifi204、Skor1、Tle1、Rxra、Rarb、Lhx3、Ldb1、Lbx1、Isl1、Gata6。

图2 前后肢差异表达基因层次聚类分析热图Figure 2 Heat map of hierarchical analysis of the differentially expressed genes between the fore and hind limbs
2.4 qPCR验证
我们从基因相互作用分子网络图中,随机挑选了Hoxc10、Hoxc9、Pitx1基因进行qPCR检测,以及在cluster3中前肢特异表达的Tbx5基因作为阴性对照。qPCR结果如图4所示,在小鼠胚胎期E10.5 d,后肢特异的Hoxc10、Hoxc9、Pitx1基因的表达量相较于前肢分别提高了397.4倍、5.5倍及59.2倍,阴性对照前肢特异的Tbx5基因,后肢表达量仅仅为前肢的0.03倍,结果表明qPCR结果真实可靠。再与芯片结果比较,后肢相较于前肢Hoxc10、Hoxc9、Pitx1及Tbx5基因的Fold Change值分别为42.5(上调)、4.9(上调)、33.7(上调)及-16.7(下降),qPCR结果与芯片结果一致,说明芯片结果可靠。
3 讨论
小鼠在胚胎发育过程中,在胚胎期E10.5 d开始出现后肢的胚芽形态,多种基因及信号因子的开始表达,调控后续肢体的位置及形态[16-17]。利用这一特征,我们通过小鼠胚胎期E10.5 d前后肢表达谱芯片筛选出275个差异表达的基因,而这些基因在基因的转录翻译调控、多器官的发育、骨骼系统的发育、细胞粘连和细胞分化等方面发挥着重要的功能。其中,大部分生物学功能集中于基因的转录翻译调控中,包括基于DNA的转录过程和基于DNA的翻译过程等,表明之所以后肢相对于前肢位置及形态上会有差别,是因为后肢发育还受到多种基因转录过程中转录因子及基因翻译过程中信号因子的表达调控。
将差异表达的基因进行了层次聚类分析,其中后肢特异表达的cluster 4中的基因,通过MGI人类/小鼠疾病模型数据库的搜索,我们发现Aldh1a2、Hoxc9、Gata6、Pitx1等14个基因都与肢体、骨骼发育缺陷的疾病模型相关(数据未显示)。Niederreither等[18]研究发现Aldh1a2基因的突变会导致小鼠后肢的完全缺失。Kozhemyakina等[19]研究发现条件敲除Gata6基因的小鼠后肢的前端会发生Shh信号及下游基因紊乱表达,并在后肢前端出现多趾头的性状。Marcil等[20]研究发现Pitx1和Pitx2基因的纯合突变会导致小鼠后肢股骨缩短、腓骨及胫骨形态的异常、以及脚趾缺失。

图3 后肢特异表达的基因相互作用分子网络图Figure 3 Network diagram of the gene interaction molecules specifically expressed in the hind limbs
为了更好的认识后肢区别于前肢分子水平的表达变化及重要的核心基因,我们对后肢特异表达的基因进行了分子网络图的绘制。从图3中,我们可以看出这些基因在分子网络上的相互作用关系,机制复杂,大部分基因涉及基因的转录调控过程。其中,我们挑选了在基因转录调控上具有代表性的Hoxc10、Hoxc9、Pitx1这3个基因,在表达水平上进行qPCR验证,其结果与芯片结果一致,表明芯片结果可靠。并通过已有研究显示Tbx4和Pitx1基因都是已知的特异调控后肢形态的转录因子[11,15]。因此,分子网络中的这些基因将为哺乳动物后肢形态形成的发育调控研究提供重要的依据。
综上所述,本研究通过小鼠前后肢基因表达谱芯片差异基因的聚类分析及信号通路分析,获得后肢特异表达核心基因,并通过qPCR验证部分基因,为哺乳动物肢体发育研究提供基础。
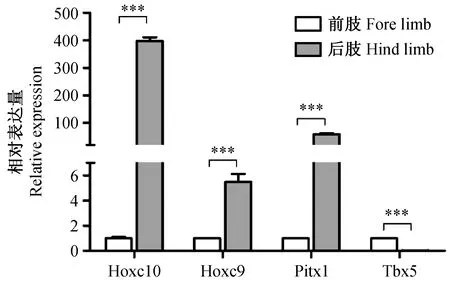
注:后肢特异的Hoxc10、Hoxc9、Pitx1基因的表达量相较于前肢分别提高了397.4倍、5.5倍及59.2倍,而前肢特异的Tbx5基因,后肢表达量仅为前肢的0.03倍。P< 0.001。图4 qPCR检测前后肢Hoxc10、Hoxc9、Pitx1及Tbx5基因相对表达水平Note. The expression levels of hindlimb-specific Hoxc10, Hoxc9, and Pitx1 genes were 397.4-fold, 5.5-fold, and 59.2-fold higher than those in the forelimbs, respectively, while the forelimb-specific Tbx5 gene was only 0.03 times in the hind limbs than in the fore limbs. P< 0.001.Figure 4 Relative expression levels of Hoxc10, Hoxc9, Pitx1 andTbx5 genes between the fore and hind limbs with qPCR detection
参考文献
[1] Hill RE, Lettice LA. Limb Development. In: Kaufman’s Atlas of Mouse Development Supplement [M]. UK: Elsevier, 2015: 193-205.
[2] Petit F, Sears KE, Ahituv N. Limb development: a paradigm of gene regulation [J]. Nat Rev Genet, 2017, 18(4): 245-253.
[3] Sheeba CJ, Logan MP. The roles of T-Box genes in vertebrate limb development [J]. Curr Top Dev Biol, 2017, 122: 355-381.
[4] Taher L, Collette NM, Murugesh D, et al. Global gene expression analysis of murine limb development [J]. PLoS One, 2011, 6(12): e28358.
[5] Hiscock TW, Tschopp P, Tabin CJ. On the formation of digits and joints during limb development [J]. Dev Cell, 2017, 41(5): 459-465.
[6] Havis E, Bonnin MA, Olivera-Martinez I, et al. Transcriptomic analysis of mouse limb tendon cells during development [J]. Development, 2014, 141(19): 3683-3696.
[7] Kondo T, Dollé P, Zákány J, et al. Function of posterior HoxD genes in the morphogenesis of the anal sphincter [J]. Development, 1996, 122(9): 2651-2659.
[8] Johnson KR, Sweet HO, Donahue LR, et al. A new spontaneous mouse mutation of Hoxd13 with a polyalanine expansion and phenotype similar to human synpolydactyly [J]. Hum Mol Genet, 1998, 7(6): 1033-1038.
[9] Kmita M, Tarchini B, Zàkàny J, et al. Early developmental arrest of mammalian limbs lacking HoxA/HoxD gene function [J]. Nature, 2005, 435(7045): 1113-1116.
[10] Parker SE, Mai CT, Canfield MA, et al. Updated national birth prevalence estimates for selected birth defects in the United States, 2004-2006[J]. Birth Defects Res A Clin Mol Teratol, 2010, 88(12): 1008-1016.
[11] Logan M, Tabin CJ. Role of pitx1 upstream of tbx4 in specification of hindlimb identity [J]. Science, 1999, 283(5408): 1736-1749.
[12] Nishimoto S, Wilde SM, Wood S, et al. RA acts in a coherent feed-forward mechanism with Tbx5 to control limb bud induction and initiation [J]. Cell Rep, 2015, 12(5): 879-891.
[13] Rodriguez-Esteban C, Tsukui T, Yonei S, et al. The T-box genes Tbx4 and Tbx5 regulate limb outgrowth and identity [J]. Nature, 1999, 398(6730): 814-818.
[14] Takeuchi JK, Koshiba-Takeuchi K, Matsumoto K, et al. Tbx5 and Tbx4 genes determine the wing/leg identity of limb buds [J]. Nature, 1999, 398(6730): 810-814.
[15] Nemec S, Luxey M, Jain D, et al. Pitx1 directly modulates the core limb development program to implement hindlimb identity [J]. Development, 2017, 144(18): 3325-3335.
[16] Wanek N, Muneoka K, Holler-Dinsmore G, et al. A staging system for mouse limb development [J]. J Exp Zool, 1989, 249(1): 41-49.
[17] Sheeba CJ, Andrade RP, Palmeirim I. Getting a handle on embryo limb development: Molecular interactions driving limb outgrowth and patterning [J]. Semin Cell Dev Biol, 2016, 49: 92-101.
[18] Niederreither K, Subbarayan V, Dollé P, et al. Embryonic retinoic acid synthesis is essential for early mouse post-implantation development [J]. Nat Genet, 1999, 21(4): 444-458.
[19] Kozhemyakina E, Ionescu A, Lassar AB. GATA6 is a crucial regulator of Shh in the limb bud [J]. PLoS Genet, 2014, 10(1): e1004072.
[20] Marcil A, Dumontier E, Chamberland M, et al. Pitx1 and Pitx2 are required for development of hindlimb buds [J]. Development, 2003, 130(1): 45-55.

