11种樟科树枝水提物对樟芝液体培养的比较
景思佳,张 蕾,刘 洋,张 帆
(1. 浙江科技学院 生物与化学工程学院生物工程系,浙江 杭州 310023;2.浙江省农业生物资源生化制造协同创新中心,浙江 杭州 310023;3.浙江省农产品化学与生物加工技术重点实验室,浙江 杭州 310023;4.杭州市园林科学研究院园林科技科,浙江 杭州 310013)
樟芝Taiwanofungus camphorates 目前自然分布仅在牛樟Cinnamomum kanehirae 腐朽心材内壁或枯死倒地的牛樟树木材的潮湿表面,为担子菌门Basidiomycotina 担子菌纲Hymenomycetes 多孔菌目Polyporales 多孔菌科Polyporaceae 台芝属Taiwanofungus[1],是一种非常珍稀的药用菌,被称为“台湾森林中的红宝石”。现代研究表明樟芝含有包括三萜类化合物、多糖、腺苷等在内的丰富的活性物质[2],并证实其具有解酒护肝、抗癌、抗氧化、调节免疫系统、消炎等作用[3-9]。但因为野生樟芝生长条件苛刻,且长势非常缓慢,导致其子实体价格不菲且一直供不应求。近年来,生长周期短、成本低、易于大规模生产的樟芝液体发酵[10]是人工培养樟芝的重要方法之一,但是目前仍存在生物活性含量较低的问题,所以关于提高樟芝液体发酵产物生物活性含量的研究报道就一直层出不穷。但大多是以生物量、多糖含量及三萜类化合物含量等为检测目标,对不同碳源、氮源、碳氮比、微量元素等营养条件,初始pH 值、温度、光照等外界环境因素以及转速、接种量、溶氧、发酵周期等液体发酵条件来进行单因素或正交试验的优化。
樟芝是牛樟上发现唯一的腐木菌,故推测牛樟树中含有促进樟芝生长的某些成分,且因为樟芝寄生病原性并不强,所以牛樟很少因此而死亡,大多都可生长数百年[11]。牛樟是樟科Lauraceae 樟属Cinnamomum 植物,为台湾特有的常绿阔叶大乔木,主要分布于台湾新竹、台东等海拔在200~2 000 m 的山区。但由于为了获取椴木来人工栽培樟芝子实体等原因,猖獗的人为盗伐,使原本就稀少的牛樟已经濒临灭绝。与牛樟一样,樟科的植物大多具有药用和经济价值,富含挥发油和脂肪油,并含萜类化合物、生物碱、有机酸及多糖等成分[12],是樟脑或樟油的重要原料。通过添加与牛樟树同属或同科的植物提取物来优化樟芝液体发酵产物的报道目前尚无。本实验室前期通过添加樟脑油(委托安国中药加工提取,主要成分为樟脑、桉叶素、黄樟素,经检测有效含量为99.63%)进行液体培养基的优化,得到添加0.2 mL 樟脑油的最优方案,故本试验挑选11种与牛樟同科同属或不同属但在台湾有自然分布的樟科植物[13-18],再与前期的实验最优方案以及无添加的培养作对比,来分析11种樟科植物的提取物对樟芝液体发酵的影响。
1 材料与方法
1.1 材料
1.1.1 菌种 樟芝菌种,2012年于台湾自然科学博物馆引进,在浙江省农产品化学与生物加工技术重点实验室采用超低温保藏法于-80℃冰箱低温保藏。
1.1.2 培养基
菌种活化培养基:PDA 39.0 g·L-1,葡萄糖 10.0 g·L-1,琼脂10.0 g·L-1,pH 自然。基础液体种子培养基:PDB 24.0 g·L-1,葡萄糖 10.0 g·L-1,pH 自然。
基础发酵培养基:PDB 24.0 g·L-1,葡萄糖 10.0 g·L-1,pH 自然。
1.1.3 樟科植物 黄樟C.parthenoxylon,华南桂C.austrosinense,樟C.camphora,香桂C.subavenium,银木C.septentrionale,猴樟C.bodinieri,兰屿肉桂C.kotoense,浙江樟C.chekiangense,山橿Lindera reflexa,天竺桂C.japonicum,新木姜子Neolitsea aurata 均取自杭州植物园。
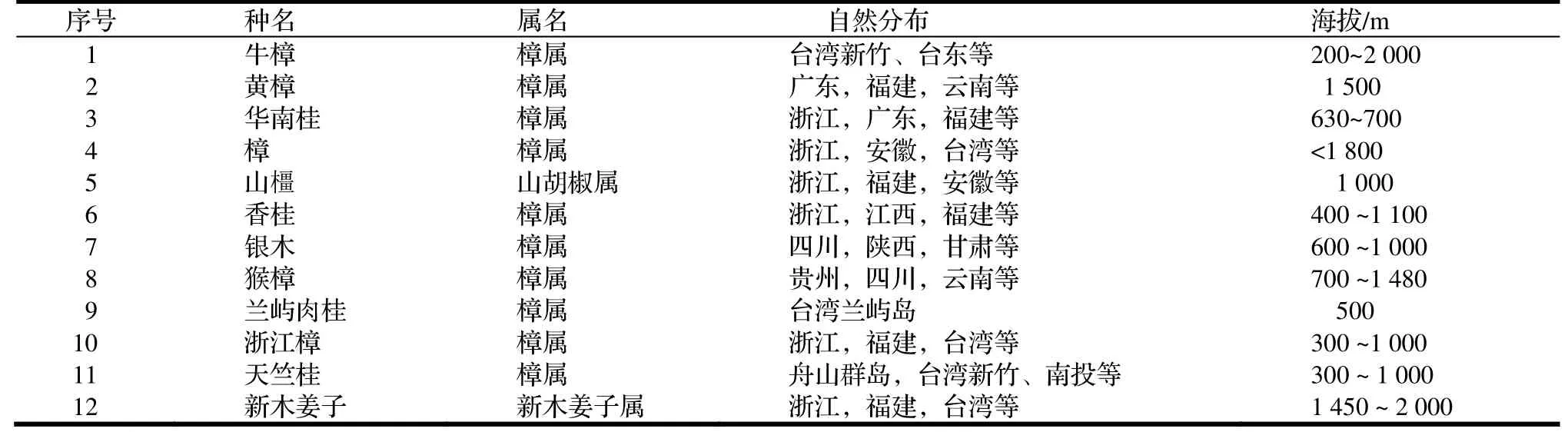
表1 牛樟与本试验11种樟科植物的情况Table 1 the situation of C.kanehirae and the 11 species of Lauraceae plants in this study
1.1.4 试剂 PDA、PDB、樟脑油、95%乙醇、齐墩果酸标准品、葡萄糖标准品、高氯酸、冰醋酸、香兰素、香草醛、二氯甲烷、浓硫酸、蒽酮,均购自浙江常青化工有限公司,其中试剂类为国产分析纯或化学纯。
1.1.5 主要仪器 分析天平,美国PTX 公司;UV-5500PC 紫外分光光度计,上海元析仪器有限公司;EYELA旋转蒸发仪,上海爱朗仪器有限公司;冷冻干燥仪,宁波新芝生物科技股份有限公司;高效液相色谱仪,美国waters 公司;无菌操作台,苏州佳宝净化工程设计有限公司。
1.2 方法
1.2.1 树枝采集 于2015年10 月在杭州植物园采集11种樟科植物的树枝,由于樟芝仅生长在牛樟树腐朽的心材内壁或枯死倒地的牛樟木的阴暗潮湿面,故使用高枝剪剪取每种同一株树5年生以上的老枝,粉碎后得到的树枝质量均大于100.0 g。
1.2.2 提取物制备 分别将11种樟科植物放入50℃下烘干至恒质量后,再分别粉碎、研磨成粉末过100 目筛后称质量。分别将100.0 g 树枝粉末以1:10 的比例放入去离子水中,煮沸1 h,过滤,再将滤渣以1:8 的比例加入去离子水煮沸1 h,过滤后将两次滤液合并,旋蒸浓缩后,保存在4℃的冰箱内备用。
1.2.3 分组
对照组 A:基础液体培养基加菌种培养的樟芝菌丝体。
实验组 B1:在基础液体培养基中添加黄樟水提物加菌种培养的樟芝菌丝体;B2:在基础液体培养基中添加华南桂水提物加菌种培养的樟芝菌丝体,B3:在基础液体培养基中添加樟水提物加菌种培养的樟芝菌丝体;B4:在基础液体培养基中添加山橿水提物加菌种培养的樟芝菌丝体;B5:在基础液体培养基中添加香桂水提物加菌种培养的樟芝菌丝体;B6:在基础液体培养基中添加银木水提物加菌种培养的樟芝菌丝体;B7:在基础液体培养基中添加猴樟水提物加菌种培养的樟芝菌丝体;B8:在基础液体培养基中添加兰屿肉桂水提物加菌种培养的樟芝菌丝体;B9:在基础液体培养基中添加浙江樟水提物加菌种培养的樟芝菌丝体;B10:在基础液体培养基中添加天竺桂水提物加菌种培养的樟芝菌丝体;B11:在基础液体培养基中添加新木姜子水提物加菌种培养的樟芝菌丝体;B12:前期实验室优化培养方案,即在基础液体培养基中添加0.2 mL 樟脑油培养的樟芝菌丝体。
1.2.4 菌株培养
(1)活化菌株 采用菌种活化培养基对低温保存的菌株进行活化。配制菌种活化培养基,在121℃,0.1 MPa条件下灭菌20 min,自然冷却至室温,将菌株在无菌条件下接入培养基后,放入28℃人工智能气候箱,无光培养15 d,保存于-4℃冰箱备用。
(2)液体菌种培养 配制液体种子培养基,在250 mL 锥形瓶中,加入100 mL 的种子培养基,然后分别添加1 mL 的11种樟科植物的水提物及0.2 mL 的樟脑油,在121℃,0.1 MPa 条件下灭菌20 min,取出培养基,自然冷却至室温;在无菌条件下每瓶接入2 粒(2 cm×1 cm)活化好的菌种,封口。在120 r·min-1,28℃的条件下震荡培养4d。每个样品设3个重复,对照为种子培养基加菌种培养。
(3)液体发酵培养 配制液体发酵培养基,在250.0 mL 锥形瓶中,加入100.0 mL 的发酵培养基,然后分别添加1 mL 的11种樟科植物的水提物及0.2 mL 的樟脑油,在121℃,0.1 MPa 条件下灭菌20 min,取出培养基,自然冷却至室温;在无菌条件下把培养4 d 后的液体种子培养基按10%的转接量转入发酵培养基,在120 r·min-1,28℃的条件下震荡培养4 d。每个样品设3个重复,对照为及0.2 mL 的樟脑油。
1.2.5 生物量测定 取A,B1,B2,B3,B4,B5,B6,B7,B8,B9,B10,B11,B12的发酵液,用3 层200 目的尼龙网过滤,得到菌丝体,用蒸馏水冲洗菌丝体3 次后,置于真空冷冻干燥机中冷冻干燥后,研磨成粉,分别测定樟芝菌丝体粉末的干质量,放于干燥皿中储存备用。
1.2.6 总三萜含量测定 取前期储存备用的A,B1,B2,B3,B4,B5,B6,B7,B8,B9,B10,B11,B12的菌丝体粉末各0.2 g,测定总三萜的含量。参照陆震鸣等[19]的方法,以齐墩果酸为标准品,采用香草醛-冰乙酸显色法测定。测定前,采用紫外分光光度计于400~700 nm 波长处进行全波长扫描,结果显示在550 nm 处具有最大吸光值,所以该反应的吸收波长设定为550 nm。
齐墩果酸标准品溶液:精确称取齐墩果酸10.0 mg,置于50.0 mL 容量瓶,加二氯甲烷定容至刻度,配制成浓度为0.2 mg·mL-1的标准溶液。
齐墩果酸标准曲线的绘制:精确量取浓度为0.2 mg·mL-1的齐墩果酸标准品溶液0.0 mL,0.1 mL,0.2 mL,0.5 mL,1.0 mL,1.5 mL,分别放入具塞磨口试管中,加热去除溶剂,然后各加入0.3 mL 的5%香草醛-冰醋酸溶液和及1 mL 高氯酸,加塞。于60℃恒温水浴20 min,取出后立即用冰水冷却,再分别加入5.0 mL 冰醋酸,在漩涡混合器混合均匀,在550 nm 处测定吸光度值。以吸光度值为纵坐标,齐墩果酸浓度为横坐标绘制标准曲线。
样品溶液及总三萜测定:取樟芝菌丝体粉末0.1 g 于10 mL 的蒸馏水中,于100℃水浴回流2 h,冷却后以1:4 的比例加入无水乙醇,置于4℃沉淀过夜,抽滤,取其滤液各1.0 mL,置于3个磨口试管中,加热蒸干溶剂,按照绘制标准曲线的方法测定吸光度值,计算不同培养基樟芝菌丝体中总三萜含量[20]。
1.2.7 多糖含量测定 取A,B1,B2,B3,B4,B5,B6,B7,B8,B9,B10,B11,B12的菌丝体粉末,测定多糖含量。参照《中国药典》的方法[21],以无水葡萄糖为标准品,采用蒽酮-硫酸法法测定。测定前,采用紫外分光光度计于400~800 nm 波长处进行全波长扫描,结果显示在620 nm 处具有最大吸光值,所以该反应的吸收波长设定为620 nm。
葡萄糖标准品溶液:精确称取105℃干燥至恒质量的葡萄糖标准品100.0 mg 定容于1 000.0 mL,配制成浓度为0.1 mg·mL-1的葡萄糖标准液。
葡萄糖标准曲线的绘制:精确吸取0.1%葡萄糖标准液0.0 mL,0.1 mL,0.2 mL,0.3 mL,0.4 mL,0.5 mL,0.6 mL,分别放入具塞磨口试管中,分别加蒸馏水至1.0 mL,各加5.0 mL 蒽酮试剂,震荡混匀,置于水浴20 min,取出冷却至室温,在620 nm 处测定吸光度值,以吸光度值为纵坐标,葡萄糖浓度为横坐标绘制标准曲线。
样品溶液及胞内多糖测定:取樟芝菌丝体粉末0.2 g 于20.0 mL 的蒸馏水中,于80℃水浴加热2 h,冷却,然后加入1:4 体积的无水乙醇混匀,置于4℃沉淀过夜,离心分离沉淀、过滤,除去滤渣,得樟芝粗多糖样品溶液,采用硫酸-蒽酮法测定多糖含量[22]。
1.3 数据处理
采用Excel 2007 软件进行数据处理,利用DPS 统计分析软件对数据进行样本检验统计分析。
2 结果与分析
2.1 樟科植物水提物对樟芝生物量的影响
图1 为11种樟科植物水提物对菌丝体生物量影响的程度及其多重比较结果,各实验组与A 间差异均极显著(F=173.34,P<0.01),其中B12的促进作用最强,其次是B11,虽不属于樟属但自然生长海拔和牛樟最为接近、且在台湾也有自然分布的新木姜子对樟芝生长的促进与B12最为接近,紧随其后的是B7,虽然猴樟在台湾没有自然分布,但海拔在700~1 480 m 与牛樟树比较吻合。B2,B10,B1,B3,B6,B8,B4,B9对樟芝生长的促进作用依次减弱,而自然分布在浙江、江西、福建等地生长海拔在400~1 000 m 的香桂(对应B5处理)对樟芝生长的促进作用最弱,但与A 相比,促进作用仍然达极显著水平(P<0.01)。
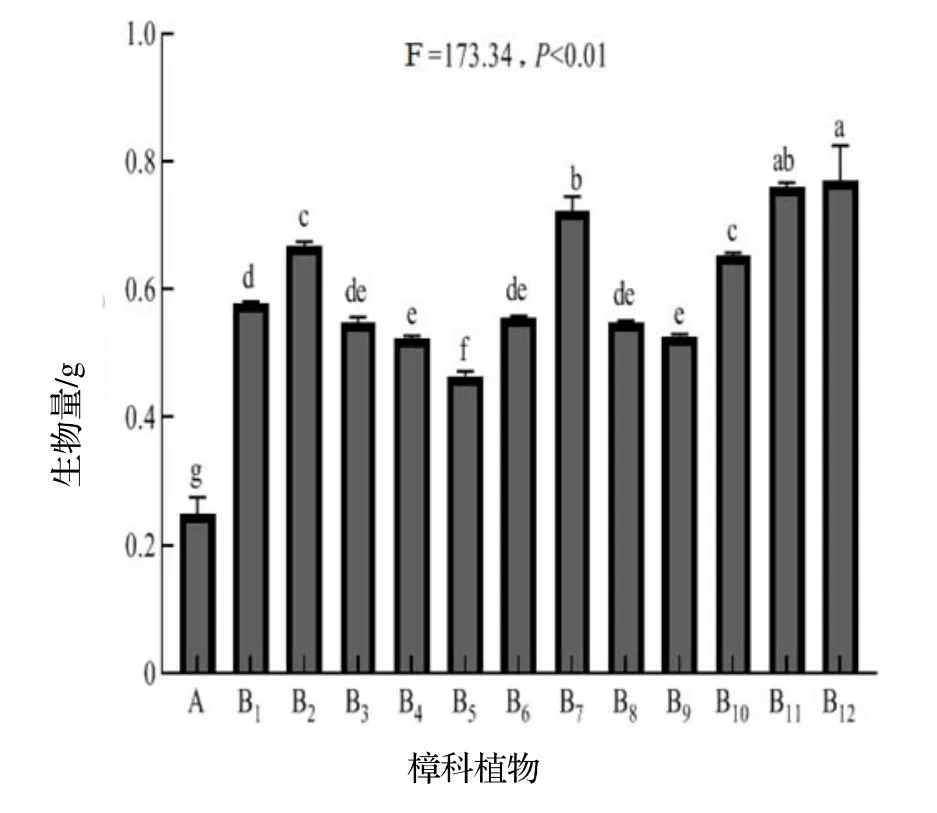
图1 11种樟科植物水提物对樟芝生物量的影响Figure 1 Effects of water extracts of 11 species of Lauraceae plants on production of biomass
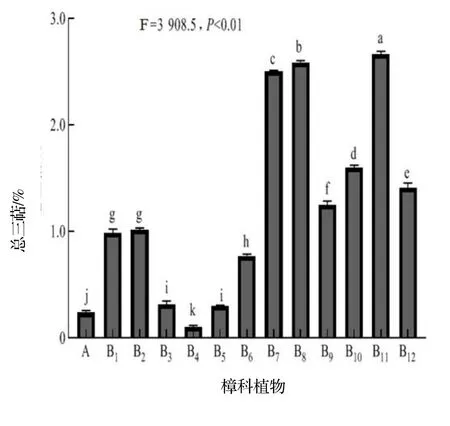
图2 11种樟科植物水提物对樟芝总三萜含量的影响Figure 2 Effects of water extracts of 11 species of Lauraceae plants on the triterpenoids production
2.2 樟科植物水提物对樟芝菌丝体总三萜含量的影响
从图2 中可以看出11种樟科植物水提物对樟芝菌丝体总三萜含量的影响,与A 相比,除B4对总三萜含量有抑制作用外,其他樟科植物都表现为不同程度的促进作用,差异极为显著(F=3 908.5,P<0.01)。
自然生长海拔和牛樟树最为接近、且在台湾也有自然分布的新木姜子虽然不属于樟属,但是其对总三萜含量的促进作用最为显著,与A 相比增加量可达13 倍,与B12相比也提高了85.0 %。其次为B8,与A 相比增加量达10 倍,与B12相比提高了78.5%。且B7、B10对于总三萜含量的促进作用显著高于B12。紧随B12后的是B9,B1,B2和B6,均极显著高于A,且B1和B2之间无显著差异;与牛樟树同属、自然海拔非常接近且在台湾有自然分布的B3,以及与牛樟树同属、自然海拔差不多且自然分布接近的B5对总三萜含量虽促进作用较弱,但与A相比仍达极显著差异水平。
2.3 樟科植物水提物对樟芝菌丝体总多糖含量的影响
图3 中与A 相比,除了B3和B9对樟芝菌丝体总多糖含量有较为明显抑制的作用,大多数樟科植物都能不同程度的提高樟芝菌丝体总多糖的含量,且差异极显著(F=121.4,P<0.01)。其中B12的促进作用最为显著,B11对总多糖含量的促进作用也极为显著,与A 相比增加量可达5 倍;B7 对于总多糖含量的促进作用紧随B11后,与A 相比增加量可达3.5 倍。B1,B5,B6,B8均较A 有极显著差异,但这4 组组间无显著差异,B10,B2对总多糖的促进作用依次减弱,但与A 相比仍有极显著差异。
3 结论与讨论
樟科植物本身就含有多种活性成分,本实验结果表明其中的某些成分可促进樟芝菌丝体的生长,提高樟芝菌丝体总三萜和总多糖的含量,只是不同的樟科植物对于樟芝菌丝体的促进程度不同,同时樟科植物中的某些成分可能也会抑制樟芝菌丝体的总三萜和总多糖的含量。
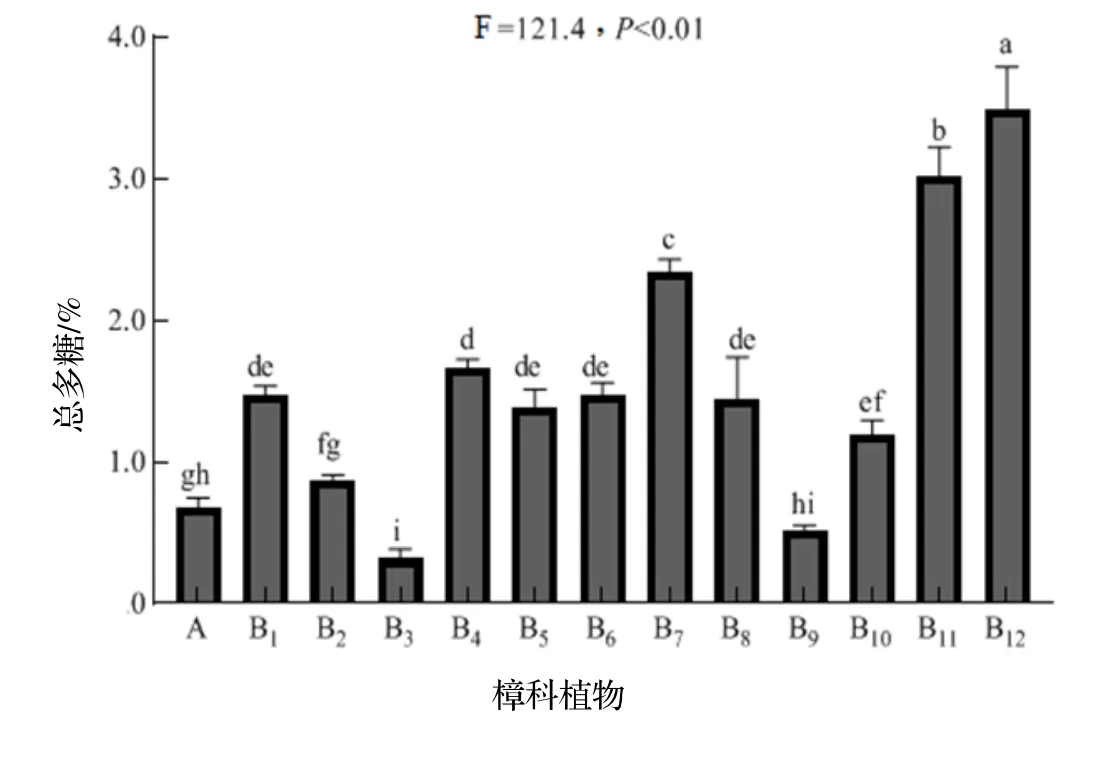
图3 11种樟科植物水提物对樟芝总多糖含量的影响Figure 3 Effects of water extracts of 11 species of Lauraceae plants on the polysaccharide production
11种樟科植物水提物对樟芝菌丝体的生长均有不同程度的促进作用,其中新木姜子、猴樟、天竺桂和华南桂的水提物对樟芝菌丝体的生长有较明显的促进作用。11种樟科植物对樟芝菌丝体总三萜含量的影响差异较大,新木姜子、兰屿肉桂和猴樟水提物对总三萜含量的影响较大,分别比无添加组增加了13 倍、10 倍和10 倍,比前期优化的液体培养分别提高了85.0%,78.5%和78.5%,产生显著的促进作用,天竺桂水提物对总三萜含量的影响略大于前期优化的培养基,而其他8种樟科植物在不同程度均有较小的促进作用。11种樟科植物对樟芝菌丝体总多糖含量的影响均不及前期优化的液体培养基,除新木姜子、猴樟水提物对总多糖含量的影响相对较大,更为接近前期优化的培养基的作用之外,与无添加组相比,山橿、黄樟、银木、兰屿肉桂、香桂、天竺桂和华南桂水提物均有不同程度的促进作用,而樟和浙江樟水提物则表现出一定的抑制作用。对樟芝菌丝体的生物量、总三萜和总多糖进行综合分析,添加新木姜子水提物对于樟芝的液体培养促进作用最为显著,其次是猴樟。
这11种樟科植物分别属于樟属、山胡椒属和新木姜子属,而从植物分类学上看分别,前者属于樟亚科的樟族,后两者属于木姜子族。根据ISSR 亲缘关系分析,不同属的樟科植物分类与樟科分类中的族一致,属间植物完全分开,而属内植物全聚在一起,与传统植物形态分类一致,说明属内植物之间的亲缘性更近。根据刘玉香等人的研究表明[23],樟科植物的核型类型有“1A”,“1B”,“2A”和“2B”四种类型,本次实验中樟属的黄樟、樟均为“2A”型,牛樟、银木为“2B”型,而新木姜子属的新木姜子和山胡椒属的山橿分别为“2B”型。一般来说,“2A”型属于较为原始类型,“2B”型在系统演化中更为进化。在这次实验中核型表现出差异的樟水提物对总多糖有较为明显的抑制作用,对总三萜和菌丝体生长均只有非常小的促进作用,与樟同是“2A”型的黄樟促进作用也较低。和牛樟同是“2B”型的新木姜子水提物促进效果最佳,虽然它和牛樟是不同族不同属,但是同是“2B”型的不同族不同属的山橿水提物以及同族同属的银木水提物却在菌丝体生物量、总三萜、总多糖上表现出和新木姜子水提物较大的差异。所以相同的核型不是促进樟芝液体培养的唯一因素。
在这11种樟科植物中对于樟芝菌丝体生长的促进作用最小的,且对总三萜、总多糖促进作用都不大的是自然生长海拔最低的香桂,同样相对低海拔的华南桂的促进作用也不是很明显;而自然生长在海拔1 450~2 000 m的新木姜子对樟芝菌丝体生长、总三萜和总多糖含量的促进作用最大,而与牛樟、新木姜子相同核型但却与新木姜子表现出较大差异的山橿和银木的自然生长海波都在1 000 m 以下;同时,自然海拔在700~1 480 m 的猴樟在菌丝体生长、总三萜和总多糖含量的促进作用都显著高于前期优化的液体培养基。故我们推测自然生长海拔高的樟科植物和牛樟可能有某些相同的成分,可促进樟芝的液体培养。
从这11种樟科植物的自然分布来看,在台湾有的新木姜子、兰屿肉桂、天竺桂均表现出较好的促进作用。根据台湾木本植物的大陆亲缘性特征分析[24],虽然受到台湾岛屿的地质、地形地貌、气候影响下形成台湾特有的树种,但这些植物可能从第3 纪中开始由大陆的西南向东迁移,所以台湾木本被子植物在大陆更多属于西南、华南、华东区域,很少属于西北、东北区域。故虽然猴樟的自然分布在西南区域,也可表现出较好的促进作用,而自然分布在西北的银木虽然和牛樟树是相同核型却因为长久以来环境的差异导致植物体内物质有较大的差异,对樟芝液体培养的促进作用不大。
综上所述,核型、高海拔、自然分布一致或接近等因素均可能影响到樟科植物内的一些成分,而这些成分中可能具有促进樟芝菌丝体生长、总三萜和总多糖的作用,虽然其作用机制需要进一步研究。但是,樟科植物水提物的添加对樟芝液体培养提高其生物量、总三萜、总多糖含量提供了创新性的方法。

