血红素氧合酶1通过影响脓毒症大鼠血栓调节蛋白表达发挥肾脏保护作用*
南川川,李 楠,李 威,洪澄英,陈怀生,刘雪燕△
(暨南大学第二临床医学院, 南方科技大学附属第一医院, 深圳市人民医院 1重症医学科, 2口腔医学中心, 广东 深圳 581000)
脓毒症(spesis)是指由感染引起的脏器功能障碍,进一步发展可导致脓毒性休克和多器官功能障碍综合征。肾脏功能障碍是脓毒症常见而且严重的并发症,急性肾功能衰竭(acute renal failure)发生率在一般脓毒症患者约为19%,在重度脓毒症约为23%,在血培养阳性的脓毒性休克患者中约为51%[1],而急性肾衰会加重病情导致患者死亡[2]。脓毒症导致肾衰的发病过程中,凝血功能障碍及炎症反应起到了重要作用[3]。
血栓调节蛋白(thrombomodulin,TM)是广泛表达于血管内皮细胞表面的跨膜蛋白受体,作为蛋白C系统的重要组成部分,它是蛋白C活化过程中重要的调节因子,不仅具有改善凝血的功能,还具有抑制炎症激活作用[4]。
血红素氧合酶1(heme oxygenase-1, HO-1)是体内血红素代谢的重要起始酶和限速酶,能够催化血红素分解为一氧化碳、胆绿素和铁离子,其代谢产物具有抑制炎症因子,抗氧化活性,同时具有调节血管张力、抗凋亡和细胞保护及改善凝血功能的作用[5-6]。Sambuceti等[7]和Maruyama等[8]在大鼠糖尿病模型中及内毒素体外细胞实验中观察到HO-1对于内皮细胞表面TM具有保护作用并促进其表达,而且在脓毒性休克时HO-1对肾脏具有保护作用[9]。但是,脓毒症时HO-1的肾脏保护作用能否通过TM介导目前还没有研究。
本实验旨在探讨HO-1对于脓毒症大鼠肾脏的保护作用机制,观察脓毒症大鼠肾脏TM表达的变化以及HO-1对其影响。
材 料 和 方 法
1 主要试剂
HO-1诱导剂氯化血红素(hemin)与抑制剂锌原卟啉(zinc protoporphyrin, ZnPP)IX购自Sigma;兔抗大鼠TM多克隆抗体购自Santa Cruz;TM的ELISA检测试剂盒购自中国易利生物公司;肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素1β(interleukin-1β,IL-1β)的ELISA检测试剂盒购自中国蓝基生物公司;活化部分凝血活酶时间(activated partial thromboplastin, APTT)和凝血酶原时间(prothrombin time, PT)检测试剂盒购自北京中勤世帝公司。
2 实验分组及动物模型
脓毒症模型的制作参照传统的盲肠结扎-穿孔(cecal ligation and puncture,CLP)法。72只雄性Wistar大鼠,6~8周,体重220 g±30 g,由辽宁长生生物技术有限公司提供,动物合格证编号为211002300018206,随机分为4组:假手术(sham)组、脓毒症(CLP)组、HO诱导剂(CLP+hemin)组和HO抑制剂(CLP+ZnPP)组,每组18只。CLP、CLP+hemin和CLP+ZnPP 3组大鼠于术前12 h分别腹腔内注射PBS、hemin(50 μmol/kg)和ZnPP(50 μmol/kg)。动物术前禁食12 h,自由饮水,戊巴比妥(50 mg/kg)腹腔注射麻醉大鼠,仰卧位固定大鼠,无菌条件下作腹白线正中切口约1.5 cm,分离盲肠,用3-0丝线在距离盲肠根部1/3处环形结扎,保持肠道通路正常,用16码针头分别在盲肠的近端和末端各穿一个孔,挤出少许粪便于腹腔内,回纳盲肠,分层缝合腹腔。术后即刻给动物皮下注射生理盐水30 mL/kg,补充术中液体丢失;假手术组仅做开腹、分离盲肠远端与大肠系膜及关腹手术。术后动物均自由进食及饮水。在术后6、12和24 h每组小鼠分别随机选取6只,暴露腹主动脉,收集动脉血,将血液与3.8%枸橼酸钠以9∶1的比例充分混合,1 660×g离心10 min,留取上层血浆至-80 ℃保存;取肾脏组织,小部分于液氮冻存,其余常规冲洗后多聚甲醛固定。
3 主要方法
3.1碳氧血红蛋白(carboxyhemoglobin,CoHb)浓度测定 留取25 μL血浆,加入连二亚酸钠溶液还原后通过双波长吸光度比值法检测血浆中碳氧血红蛋白浓度:在同等实验条件下分别应用分光光度计测得0%COHb、100%COHb及待检样品在420 nm和432 nm波长处的吸光度(A)值,应用波尔定律计算出血浆中血红蛋白及COHb的比例,从而得出COHb的浓度,以反映大鼠体内HO-1的活性。
3.2血浆中TM、TNF-α和IL-1β的检测 血浆中以上各种指标的检测应用酶联免疫吸附法按照试剂盒说明书要求检测。
3.3PT、APTT、肌酐(creatinine,Cr)及胱抑素C(cystatin-C, Cys-C)的检测 按照PT和APTT试剂盒说明书要求应用M600L全自动凝血因子分析仪检测PT和APTT。Cr和Cys-C应用FR-40全自动生化分析仪检测。
3.4肾脏组织血栓形成情况观察 肾组织用10%缓冲福尔马林固定,石蜡包埋,切片(5 μm)用马休黄/猩红/天青石蓝(Martius scarlet blue,MSB)染色法[10]确认血栓形成,红色代表微血栓,并用半定量的光镜检查。随机选取50例肾小球沿赤道切取并观察。在每个肾小球中,评估肾小球毛细血管与微血栓填充到肾小球总毛细血管面积的比率,并将肾小球分为5类:5%、6%至25%、26%至50%、51%至75%和76%至100%。每组对应的肾小球数目代表各组微血栓形成的情况。
3.5应用Western blot检测TM在肾脏的表达 液氮冻存大鼠肾脏组织裂解,提取蛋白并纯化,用考马斯亮蓝法进行蛋白定量,各组取50 μg蛋白行12%SDS-PAGE (80 V,3 h)后,转入硝酸纤维素膜,应用2%的脱脂奶粉(PBS稀释, pH 7.14)4 ℃封闭硝酸纤维素膜过夜,加入TM Ⅰ抗, 37 ℃孵育2 h。洗膜后,应用辣根过氧化物酶标记的Ⅱ抗孵育后显影曝光,经图像分析系统分析蛋白条带。
4 统计学处理
用SPSS 16.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用最小显著性差异法(LSD法),以P<0.05为差异有统计学意义。
结 果
1 HO-1的活性
与sham组相比,其余3组大鼠血浆COHb浓度均显著升高(P<0.05),且CLP+hemin组COHb浓度显著高于CLP组(P<0.05),CLP+ZnPP组则显著低于CLP组和CLP+hemin组(P<0.05),表明hemin能够增强大鼠体内HO-1的活性,见表1。
2 肾功能指标
与sham组相比,术后各时点其余3组大鼠肾功能均减低(P<0.05),血浆中Cr和Cys-C水平显著增高(P<0.05);与CLP组相比,CLP+hemin组Cr和Cys-C水平下降显著(P<0.05),CLP+ZnPP组较CLP+hemin组显著升高(P<0.05),见表1。
3 凝血功能指标
大鼠CLP后PT和APTT较sham组显著缩短(P<0.05),hemin的干预使大鼠PT和APTT较CLP组显著延长(P<0.05),CLP+ZnPP组PT和APTT较CLP+hemin组显著缩短(P<0.05),见表1。
4 炎症因子水平
3组大鼠血浆炎症因子明显较sham组显著增高(P<0.05),CLP+hemin组TNF-α和IL-1β水平较CLP组显著降低(P<0.05),CLP+ZnPP组较CLP+hemin组显著升高(P<0.05),见表1。
表1血浆中各项指标检测
Table 1.Blood samples were taken from the rats in each group, and the levels of COHb, Cr, Cys-C, TNF-α, IL-1β, soluble TM (sTM), PT and APTT were measured (Mean±SD.n=6)
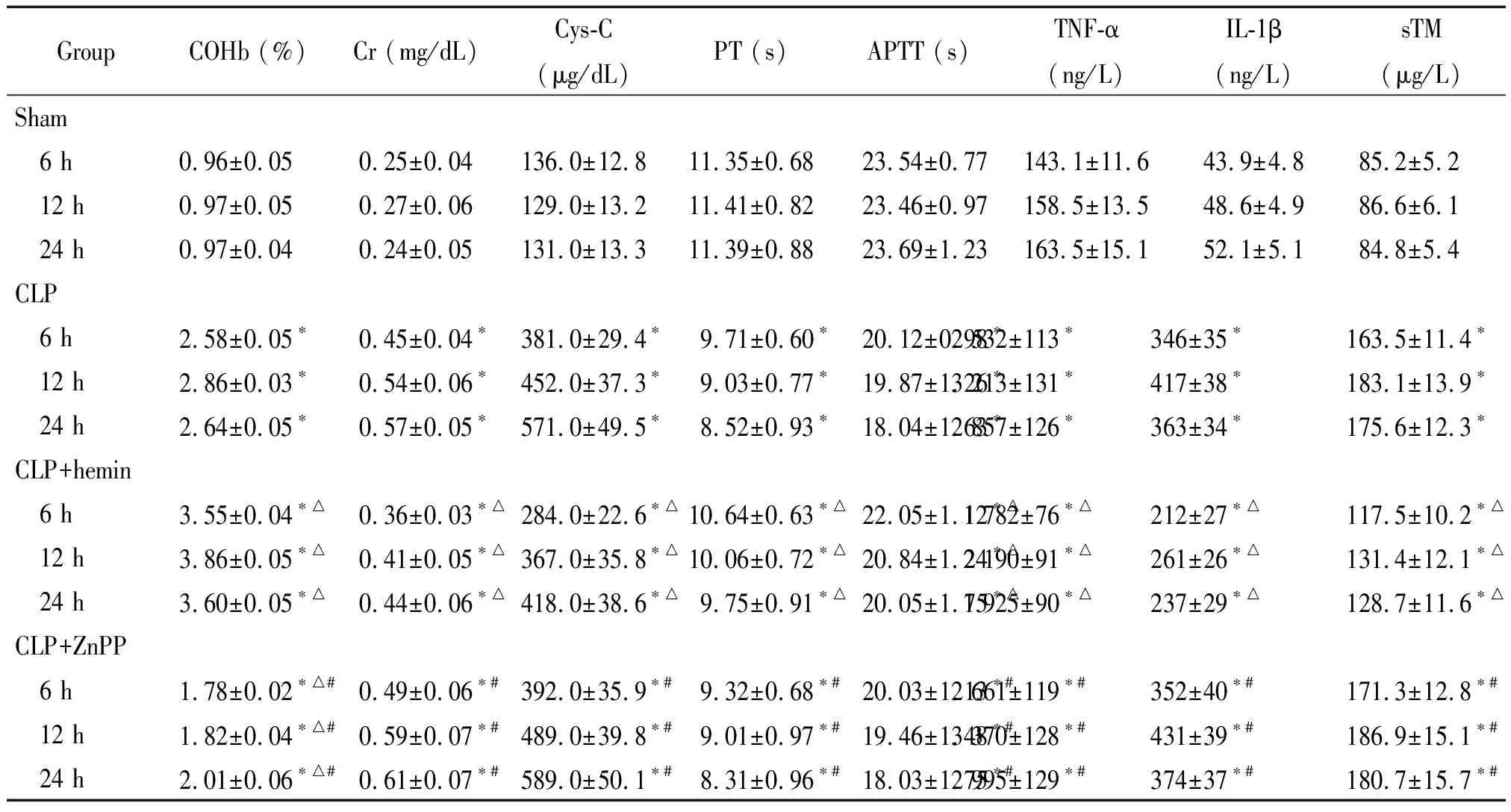
GroupCOHb (%)Cr (mg/dL)Cys-C(μg/dL)PT (s)APTT (s)TNF-α(ng/L)IL-1β(ng/L)sTM(μg/L)Sham 6 h0.96±0.05 0.25±0.04136.0±12.811.35±0.6823.54±0.77143.1±11.643.9±4.885.2±5.2 12 h0.97±0.050.27±0.06129.0±13.211.41±0.8223.46±0.97158.5±13.548.6±4.986.6±6.1 24 h0.97±0.040.24±0.05131.0±13.311.39±0.8823.69±1.23163.5±15.152.1±5.184.8±5.4CLP 6 h2.58±0.05∗0.45±0.04∗381.0±29.4∗9.71±0.60∗20.12±0.98∗2 532±113∗346±35∗163.5±11.4∗ 12 h2.86±0.03∗0.54±0.06∗452.0±37.3∗9.03±0.77∗19.87±1.26∗3 213±131∗417±38∗183.1±13.9∗ 24 h2.64±0.05∗0.57±0.05∗571.0±49.5∗8.52±0.93∗18.04±1.63∗2 857±126∗363±34∗175.6±12.3∗CLP+hemin 6 h3.55±0.04∗△0.36±0.03∗△284.0±22.6∗△10.64±0.63∗△22.05±1.12∗△1 782±76∗△212±27∗△117.5±10.2∗△ 12 h3.86±0.05∗△0.41±0.05∗△367.0±35.8∗△10.06±0.72∗△20.84±1.24∗△2 190±91∗△261±26∗△131.4±12.1∗△ 24 h3.60±0.05∗△0.44±0.06∗△418.0±38.6∗△9.75±0.91∗△20.05±1.75∗△1 925±90∗△237±29∗△128.7±11.6∗△CLP+ZnPP 6 h1.78±0.02∗△#0.49±0.06∗#392.0±35.9∗#9.32±0.68∗#20.03±1.13∗#2 661±119∗#352±40∗#171.3±12.8∗# 12 h1.82±0.04∗△#0.59±0.07∗#489.0±39.8∗#9.01±0.97∗#19.46±1.48∗#3 370±128∗#431±39∗#186.9±15.1∗# 24 h2.01±0.06∗△#0.61±0.07∗#589.0±50.1∗#8.31±0.96∗#18.03±1.75∗#2 995±129∗#374±37∗#180.7±15.7∗#
*P<0.05vssham group;△P<0.05vsCLP group;#P<0.05vsCLP+hemin group.
5 肾脏血栓形成情况
对肾脏MSB染色切片中血栓形成的分析表明,在CLP组中,所有肾小球充满微血栓,占肾小球毛细血管的大部分;与CLP相比,hemin预给药可显著降低肾小球微血栓形成;ZnPP的预处理对肾小球微血栓形成无影响,见图1。
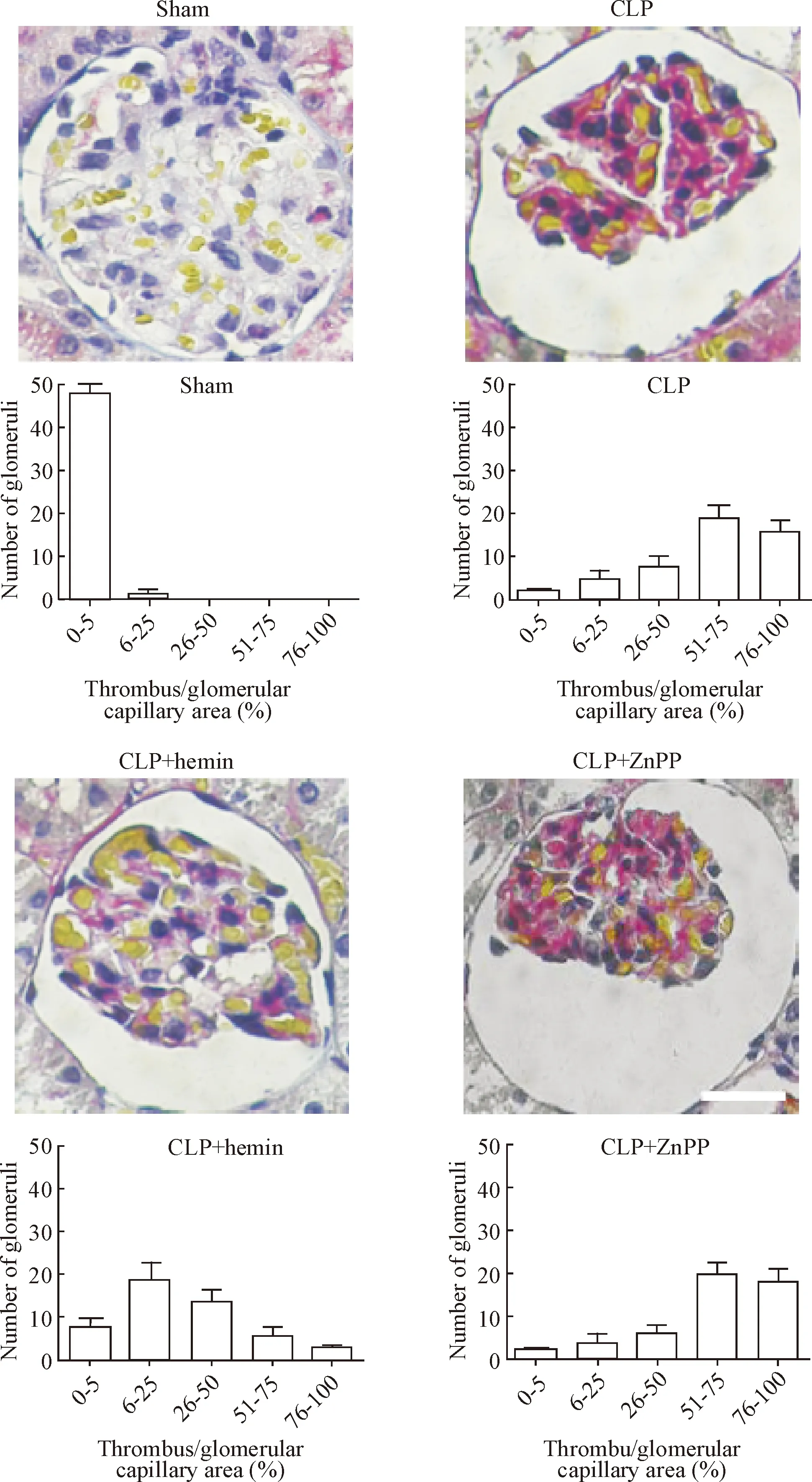
Figure 1.HO-1 attenuates microthrombus formation in the glomeruli during sepsis. The scale bar=25 μm.
图1HO-1减轻脓毒症大鼠肾小球微血栓形成
6 TM的表达
与sham组相比,CLP组大鼠肾脏TM表达显著下降(P<0.05),血浆游离TM显著增加(P<0.05),而hemin干预可以使CLP大鼠肾脏TM表达显著增加(P<0.05),血浆游离TM显著下降(P<0.05),ZnPP则起到相反作用,见图2、表1。
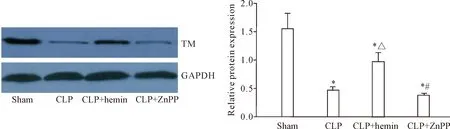
Figure 2.Western blot showed that HO-1 up-regulated the protein expression of TM in the kidney during sepsis. Mean±SD.n=6.*P<0.05vssham group;△P<0.05vsCLP group;#P<0.05vsCLP+hemin group.
图2HO-1增加脓毒症大鼠肾脏组织TM的表达
讨 论
在本实验中,我们通过盲肠结扎穿孔制备脓毒症大鼠模型,分别给予HO-1诱导剂hemin和HO-1抑制剂ZnPP,观察HO-1在脓毒症大鼠肾脏功能损伤中的作用,结果显示脓毒症大鼠血浆中炎症因子及游离TM增加,凝血功能障碍,肾脏TM表达下降,肾小球微血管内血栓形成明显,肾脏功能障碍;Hemin干预使肾脏TM表达增加,血浆游离TM下降,炎症减轻,凝血功能改善,肾小球微血栓形成减少,肾脏功能明显改善,表明在脓毒症大鼠模型中,HO-1能通过TM发挥抗炎和抗凝血作用,从而起到肾脏保护作用。
近年研究认为,凝血功能障碍和炎症反应是脓毒症引发各种器官功能障碍的重要病理过程[11],两者相互协同,共同加重了脓毒症的病理损伤。在组织严重受损时,毒素及炎症激活凝血和纤溶系统,全身呈高凝血状态,引起弥散性血管内凝血,肾小球内微血栓形成,从而形成机械性梗阻,降低肾小球滤过率[3,12]。
在多种病理状态下,HO-1可被血红素和内毒素等多种因素诱导表达增加[13],能够改善肾脏血流动力学抑制肾脏炎症反应[14],改善肾功能[15]。在我们的研究中,CLP诱导的脓毒症大鼠血浆中Cys-C和Cr水平显著升高,说明肾脏功能损伤明确存在,HO-1的诱导能够显著降低Cys-C和Cr水平,改善肾脏功能。HO-1通过调控cGMP抑制血小板聚集[16],而且外源性给予HO-1的代谢产物一氧化碳可以下调脓毒症小鼠及人脐静脉内皮细胞NF-κB的表达,并抑制组织因子及PAI-1,从而抑制微循环血栓形成[17]。尽管研究表明在脓毒症大鼠模型中HO-1表达增强具有肾脏保护作用,但是之前的研究并没有评估肾脏血栓形成情况[9]。
TM是表达于内皮细胞表面的跨膜蛋白受体蛋白,它可与凝血酶结合降低凝血酶的活性,凝血酶结合TM后能使凝血酶的灭活速度比在自然下快了20倍, 直接导致循环中的凝血酶清除[18]。同时它们的复合物特异性激活蛋白C使其转化为具有抗凝及抗炎活性的活化蛋白C;TM所含有的特定结构域可以维持细胞功能和细胞间连接的完整性, 直接抑制炎性细胞黏附, 阻止炎性细胞迁移,还可与NF-κB等促炎因子结合抑制其活性从而起到抗炎作用[19],因此TM是蛋白C系统行使抗凝及抗炎作用的重要因素[20-21]。脓毒症时肾脏受到炎症因子介导的损伤,主要是TNF-α和IL-1β,二者均可以引发其它炎症因子的释放,同时也可以导致血管的收缩,中性粒细胞的集聚,活性氧的生成,组织因子的释放和促进血栓的形成[22],而且TNF-α和IL-1β造成血管内皮细胞损伤,抑制TM转录造成内皮细胞TM表达下降[23],血浆游离TM增加,TM在血浆中的增加是由于TM从受损的血管内皮细胞释放到血流中引起的,提示炎症介导的内皮损伤确实发生[24]。
脓毒症时给予HO-1激动剂可以通过MAPK等多个途径抑制内毒素刺激的炎症因子IL-1β和TNF-α的释放[25]。在本研究,脓毒症大鼠血浆中TNF-α和IL-1β及游离TM增加,凝血功能障碍,肾脏TM表达下降,肾小球微血管内血栓形成明显;Hemin干预使肾脏TM表达增加,血浆TNF-α和IL-1β及游离TM下降,凝血功能得到改善,肾小球微血栓形成减少,表明在脓毒症大鼠模型中,HO-1能通过TM发挥肾脏保护作用。
血红素氧合酶在多种病理过程中表现出了明显的作用,但具体机制至今尚未完全阐明,本实验进一步从TM途径研究了HO-1对于肾脏功能的保护作用,丰富了HO-1改善凝血功能障碍及抗炎的机制,为HO-1的临床应用提供参考资料。

