抑制mTOR信号通路对幼鼠肺损伤时p-AKT1分子的影响及意义*
梁木林,党红星,鲁 雪,方 芳,刘成军,许 峰
(重庆医科大学附属儿童医院重症医学科, 儿童发育疾病研究教育部重点实验室, 儿童发育重大疾病国家国际科技合作基地, 儿科学重庆市重点实验室, 重庆 400014)
高体积分数氧(高氧,hyperoxia)长时间持续吸入可引发儿童肺损伤[1],高氧诱导的肺损伤在组织学上可分为急性期和慢性纤维化期2个阶段,2者的病理改变不同,即早期肺组织表现为炎症渗出和水肿,晚期则表现为肺泡明显增厚和成纤维细胞增生[2]。肺损伤纤维化发生的主要机制是炎症损伤和损伤后异常修复[3],但纤维化进展的机制尚不完全清楚,仍然缺乏有效手段干预纤维化[4]。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路参与调节细胞的存活与增殖,抑制mTOR对肺损伤及纤维化有潜在的治疗作用[5]。本研究以3周龄SD幼鼠为研究对象,复制高氧肺损伤动物模型,探讨mTOR复合物1(mTOR complex 1, mTORC1)抑制剂雷帕霉素(rapamycin,Rapa)和mTORC1/2双重抑制剂OSI-027抑制mTOR信号通路对高氧肺损伤时磷酸化AKT1(phosphorylated AKT1,p-AKT1)分子的影响及其在高氧肺损伤纤维化中的作用。
材 料 和 方 法
1 实验动物
清洁级SD幼鼠(体重44.8 g±2.75 g,雌雄不限,3周龄),由重庆医科大学实验动物中心提供,许可证编号为SCXK(渝)2018-0003,敷料、饲料和水源由重庆医科大学附属儿童医院动物房统一供应。本研究经重庆医科大学实验动物伦理委员会伦理审核批准。
2 主要试剂
抗兔p-AKT1单克隆抗体(批号ab81283)、抗兔磷酸化核糖体蛋白S6激酶1(phosphorylated ribosomal protein S6 kinase 1, p-S6K1)多克隆抗体(批号ab131436)、抗鼠β-actin单克隆抗体(批号ab8226)、生物素化山羊抗鼠IgG(H+L)(批号ab6789)及生物素化山羊抗兔IgG(H+L)(批号ab6721)均购自Abcam;山羊抗兔工作液(批号SP-9001)、正常山羊血清(批号ZLI-9021)及浓缩型DAB试剂盒(批号K135925C)购自北京中山金桥生物有限公司;雷帕霉素(批号R8140)购自北京索莱宝科技有限公司;OSI-027(批号HY-10423/CS-0257)购自MedChemExpress;全蛋白提取试剂盒(批号KGP2100)和BCA蛋白浓度测定试剂盒(批号KGP903)购自南京凯基生物公司;预染蛋白Marker(批号00215343)购自NEB;ECL发光试剂盒(批号BL520A)购自Thermo;PVDF膜购自Hybond。
3 主要方法
3.1动物分组 将72只SD幼鼠(雌雄不限,3周龄)应用随机数字表法进行完全随机化分为:空气+生理盐水组[空气(air)组]、高氧+生理盐水组[高氧(hyperoxia)组]、高氧+OSI-027(hyperoxia OSI)组和高氧+雷帕霉素(hyperoxia Rapa)组,分别建立动物模型(各组n=18)。
3.2动物模型制备 采用本课题组原创的高氧致幼年大鼠肺损伤动物模型[6]。高氧暴露各组SD幼鼠,置于自制塑料饲养氧箱(60 cm×50 cm×40 cm)中,饲养箱进气孔持续输入99.9%的高纯度医用氧气,维持氧体积分数为90%(CY-12C型数字测氧仪,浙江杭州建德市利达仪器厂),用钠石灰吸收二氧化碳,使其浓度<0.5%。环境温度25 ℃~27 ℃,湿度60%~70%。每天定时上午10:00开箱30 min,更换敷料并添加水和饲料。空气组置于同一室内空气(FiO2=0.21)中,饲养条件与高氧暴露各组相同,其中,空气组和高氧组经腹腔注射0.5 mL生理盐水,高氧+雷帕霉素组经腹腔注射雷帕霉素(1.5 mg·kg-1·d-1)[7],高氧+OSI-027组经腹腔注射OSI-027(0.5 mg·kg-1·d-1)[8],均用生理盐水稀释至总体积0.5 mL。按照每周3次的用法于第1、3、6、8、10和13天时一次性给药,给药1 h后予高氧(FiO2=0.90)或空气(FiO2=0.21)暴露。高氧暴露第1天肺组织开始发生急性肺损伤病理改变,因而药物干预选择高浓度氧暴露第1天作为研究高氧肺损伤的给药起始时点。
3.3各组SD幼鼠的生存率、一般状况及体重 观察并记录各组SD幼鼠的精神、生长、存活、觅食、呼吸、活动度、刺激后反应;体毛光泽、生长发育及体重变化等情况。
3.4标本采集 各组SD幼鼠分别于建模第3、7和14天,取肺组织用于实验研究。各SD幼鼠经腹腔注射10%水合氯醛(3.5 mL/kg)麻醉,碘伏消毒胸腹部皮肤,沿中线剪开皮肤,剪开胸腔(注意避开胸壁内的血管),然后用大头针将两侧胸壁固定在泡沫板上,充分暴露心肺及纵膈组织,用镊子从上纵膈处提起心肺及血管组织,剪下肺叶,其中左肺浸入4%多聚甲醛溶液中固定,常规石蜡包埋切片,行肺组织病理学检查及免疫组化检查;右中上肺称重后放入-80 ℃冰箱保存,用于目标蛋白的检测;取出右下肺测肺组织湿/干重比(wet/dry weight ratio, W/D)。
3.5肺组织W/D的测定 取右下肺放置吸水滤纸上蘸干表面血滞,立即用电子秤(万分之一分析天平)称重记作肺湿重;各称重后的右下肺,用滤纸包好标记,置于70 ℃烤箱内48 h后分别称重记作肺干重;计算肺W/D。
3.6肺组织病理学检查 新鲜取材的左肺组织分别置于盛有4%多聚甲醛溶液固定24~72 h,而后用流水冲洗固定肺组织,脱水、透明、石蜡浸泡、包埋、切片、脱蜡、HE染色和封片,普通光学显微镜下观察肺组织病理学改变,采集图像。
3.7肺损伤的评分 HE染色后的切片在显微镜下观察肺组织病理学改变。根据美国胸科学会2011年发布的肺组织损伤评分标准[9],按照“A:肺泡腔嗜中性粒细胞浸润;B:肺间质嗜中性粒细胞浸润;C:透明膜;D:肺泡腔渗出蛋白质碎屑;E:肺泡间隔增厚”进行肺损伤评分,每张切片观察20个视野。肺损伤评分=[20×(A)+14×(B)+7×(C)+7×(D)+2×(E)]/(观察视野数×100)。采用双盲法由2人对每张切片独立评分,计算平均值,然后进行统计分析。肺损伤评分越高表示病变程度与病变范围越大。
3.8肺泡间隔厚度测定 用专业图像分析软件Image-Pro Plus 6.0图像分析系统(Media Cyberne-tics)测定在400倍下肺泡间隔厚度,每张切片观察10个视野,每个视野随机测3个不同肺泡壁,取平均值作为肺泡间隔厚度。
3.9免疫组化检测p-AKT1和p-S6K1在肺组织中的分布 固定肺组织经脱水、石蜡包埋、切片、脱蜡,室温下行3%甲醇-H2O2阻断内源性过氧化物酶10 min;将切片浸入0.01 mol/L柠檬酸盐缓冲液(pH 6.0),微波炉加热修复抗原;滴加山羊血清封闭液,室温20 min;然后滴加 I 抗(p-AKT1抗体:1∶50;p-S6K1抗体:1∶100),4 ℃过夜,滴加生物素化 II 抗(山羊抗兔工作液),37 ℃、30 min;DAB室温显色;蒸馏水洗涤;苏木素轻度复染、脱水、透明、封片;镜检并采集图像。然后进行免疫组化结果判定:胞核和(或)胞质呈现棕黄色或棕褐色为阳性细胞。每张切片随机取10个视野,每个视野取3个分割块,每个分割块用涂色方式每次分割3~4个细胞。40倍物镜头取图,采用Image-Pro Plus 6.0图像分析系统检测其阳性信号平均吸光度以反映p-AKT1和p-S6K1蛋白表达相对含量, 平均吸光度越大,p-AKT1和p-S6K1蛋白含量越高。
3.10Western blot 法测定肺组织中p-AKT1和p-S6K1的蛋白水平 将-80 ℃冻存各组称重的肺组织剪碎后放入预冷的玻璃匀浆器中;用移液管向每管中加入0.5 mL的含有蛋白酶抑制剂及磷酸酶抑制剂的裂解缓冲液[按0.5 mL裂解液加5 μL PMSF(50 mmol/L)的比例加入摇匀至无结晶的1%蛋白酶抑制剂和磷酸酶抑制剂5 μL]作为匀浆介质;将盛有标本的匀浆器下端插入冰水混合物中,上下转动捣杆数10次,充分研磨,尽量避免产生泡沫,将组织块研磨至肉眼看不见,冰上静置30 min;用微量移液器将制备好的匀浆液转移至1.5 mL进口EP管中,置于低温高速离心机中,4 ℃、12 000×g离心30 min;小心吸取上清(原始的总蛋白样本)提取样品全蛋白分装于标记好的新EP管中;置于-80 ℃保存备用。然后行Western blot法测定样品蛋白表达:BCA法测定样品蛋白浓度,热循环仪95 ℃蛋白变性,配胶、上样、SDS-PAGE后转膜,TBST buffer稀释的5% BSA液封闭,分别滴加I 抗[p-AKT1(1∶2 000)、p-S6K1(1∶200)和β-actin(1∶5 000)]4 ℃孵育过夜,II 抗(1∶5 000)室温孵育2~3 h,ECL显影、定影,用Bio-Rad ChemiDoc XRS+System凝胶扫描成像仪和Image Lab凝胶分析系统软件对蛋白条带进行分析处理。
4 统计学处理
采用SPSS 19.0统计软件进行统计分析。符合正态分布独立性的计量资料以均数±标准差(mean±SD)表示,计量资料的整体分析经正态性检验后采用无交互作用的双因素方差分析。组内和组间进一步比较采用给定时间做各组两两比较,给定组别做不同时间两两比较,方差齐则采用Tukey HSD法检验,方差不齐则采用Dunnett’s T3法检验,以P<0.05为差异有统计学意义。
结 果
1 高氧及mTOR抑制剂对SD幼鼠一般状况、生存、生长和体重增长的影响
各组SD幼鼠均100%存活。空气组SD幼鼠精神饱满,自主活动灵敏,饮食好,刺激后反应敏捷,体毛整洁光滑,呼吸平稳,生长发育及体重增长良好;与空气组比较,高氧组各时点SD幼鼠精神欠佳,活动减少,饮食差,刺激后反应迟钝,体毛凌乱,呼吸急促,生长发育及体重增长缓慢(P<0.05);与高氧组比较,高氧+雷帕霉素组和高氧+OSI-027组第3和7天SD幼鼠一般状况大致相同,体重增长亦缓慢,差异无统计学显著性;与高氧+雷帕霉素组比较,高氧+OSI-027组第3和7天SD幼鼠体重差异无统计学显著性,见表1。
2 肺组织的病理学观察
第3、7和14天时空气组的肺结构正常,无明显炎症病变;与空气组比较,高氧组的肺组织表现程度不同的损伤,肺泡隔增宽,肺泡腔内及肺泡间隔可见炎性细胞渗出,肺组织结构紊乱渐渐加重,第7天时肺泡隔增宽达到高峰,肺组织炎性渗出、水肿及大量肺泡萎陷,第14天时肺泡隔仍增宽,肺泡结构破坏,渗出水肿慢慢消褪,成纤维细胞增生,纤维组织呈条索样改变,片状分布,肺损伤纤维化表现明显;与高氧组比较,高氧+雷帕霉素组肺泡隔增宽更严重,肺泡腔内及肺泡间隔炎性渗出更显著,肺损伤纤维化表现更明显;与高氧组和高氧+雷帕霉素组比较,高氧+OSI-027组肺泡隔增宽程度降低,肺泡腔内及肺泡间隔炎性渗出减轻,肺损伤纤维化表现亦减轻,见图1。
表1各组SD幼鼠的体重变化
Table 1.The changes of the body weight in different groups on different days (g. Mean±SD.n=6)
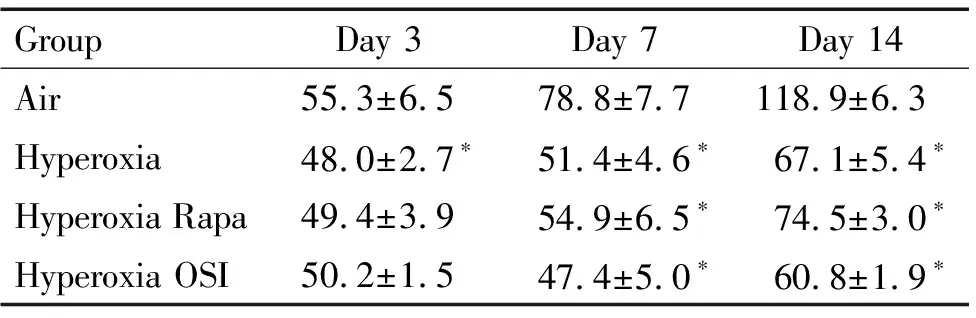
GroupDay 3Day 7Day 14Air55.3±6.578.8±7.7118.9±6.3 Hyperoxia48.0±2.7∗51.4±4.6∗67.1±5.4∗Hyperoxia Rapa49.4±3.954.9±6.5∗74.5±3.0∗Hyperoxia OSI50.2±1.547.4±5.0∗60.8±1.9∗
*P<0.05vsair group.
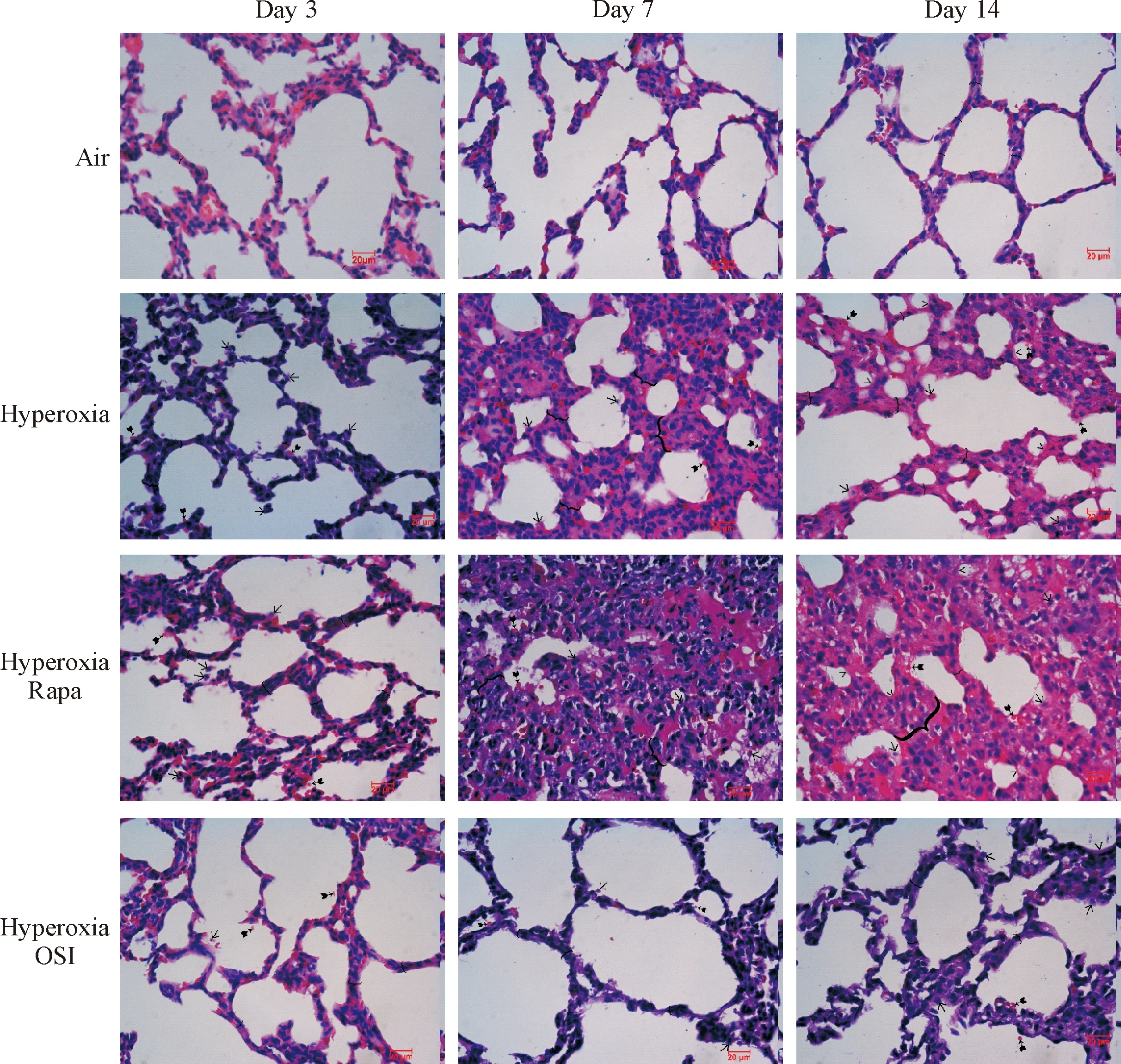
Figure 1.The pathological changes of lung tissue in juvenile SD rats from each group (HE staining, ×400). →: neutrophils in the alveolar space;: proteinaceous debris filling the airspaces; {: alveolar septum thickness; >: proteinaceous debris filling the airspaces.
图1各组SD幼鼠肺组织病理学改变
3 肺组织W/D的变化
第3、7和14天空气组的肺W/D大致无改变。除空气组外,其余各组不同时点肺组织W/D变化有显著差异(F=25.836,P<0.01),空气组肺W/D显著低于其它组(F=25.359,P<0.01),从各时点看,除第14天外(F=2.61,P>0.05),第3和7天各时点均以空气组为最低(P<0.01),见表2。
表2肺组织湿干重比的变化
Table 2.The changes of the wet and dry weight ratio (W/D) of the lung in different groups on different days (Mean±SD.n=6)
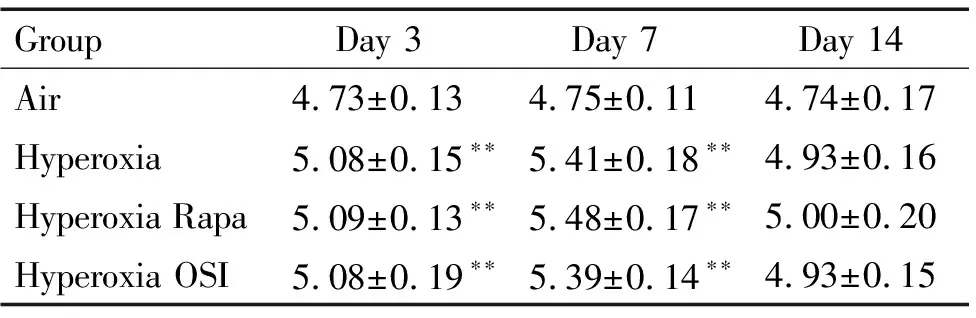
GroupDay 3Day 7Day 14Air4.73±0.134.75±0.114.74±0.17Hyperoxia5.08±0.15∗∗5.41±0.18∗∗4.93±0.16Hyperoxia Rapa5.09±0.13∗∗5.48±0.17∗∗5.00±0.20Hyperoxia OSI5.08±0.19∗∗5.39±0.14∗∗4.93±0.15
**P<0.01vsair group.
4 肺泡间隔宽度的变化
第3、7和14天随着生长发育,空气组肺泡间隔宽度逐渐呈增高趋势,但差异无统计学显著性;与空气组比较,高氧组的肺泡间隔宽度显著增加(P<0.05),第7天时肺泡间隔宽度达到最高,而后降低,但第14天时肺泡间隔宽度仍显著增加(P<0.05);与高氧组比较,高氧+雷帕霉素组肺泡间隔宽度显著增加(P<0.05);与高氧组和高氧+雷帕霉素组比较,高氧+OSI-027组第3天时的肺泡间隔宽度无改变,第7和14天各时点高氧+OSI-027组肺泡间隔宽度显著降低(P<0.05),见表3。
表3各组SD幼鼠的肺泡间隔宽度
Table 3.The changes of the alveolar septum width in different groups on different days (μm. Mean±SD.n=6)
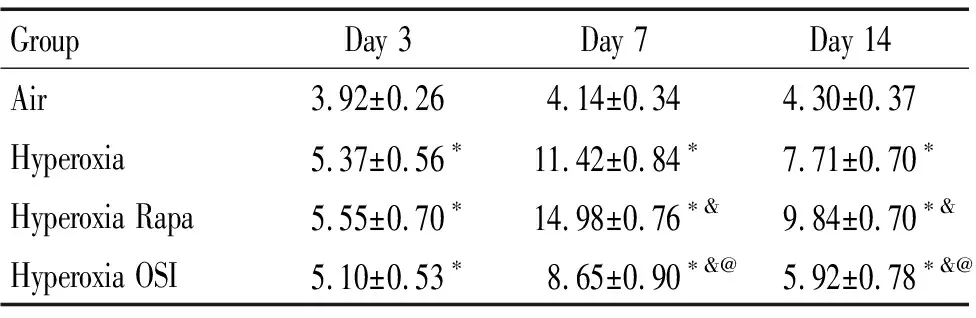
GroupDay 3Day 7Day 14Air3.92±0.264.14±0.344.30±0.37Hyperoxia5.37±0.56∗11.42±0.84∗7.71±0.70∗Hyperoxia Rapa5.55±0.70∗14.98±0.76∗&9.84±0.70∗&Hyperoxia OSI5.10±0.53∗8.65±0.90∗&@5.92±0.78∗&@
*P<0.05vsair group;&P<0.05vshyperoxia group;@P<0.05vshyperoxia Rapa group.
5 肺损伤评分的变化
第3、7和14天空气组肺损伤评分的差异无统计学显著性;与空气组比较,高氧组的肺损伤评分增高(P<0.05);与高氧组比较,高氧+雷帕霉素组的肺损伤评分增高(P<0.05);与高氧组和高氧+雷帕霉素组比较,高氧+OSI-027组的肺损伤减轻(P<0.05),见表4。
表4各组SD幼鼠的肺损伤评分
Table 4.The changes of the lung injury score in different groups on different days (Mean±SD.n=6)
GroupDay 3 Day 7 Day 14 Air0.074±0.021 0.066±0.020 0.072±0.019 Hyperoxia0.335±0.038∗0.593±0.038∗0.797±0.032∗Hyperoxia Rapa0.413±0.032∗&0.645±0.023∗&0.908±0.034∗&Hyperoxia OSI0.289±0.018∗&@0.535±0.030∗&@0.735±0.023∗&@
*P<0.05vsair group;&P<0.05vshyperoxia group;@P<0.05vshyperoxia Rapa group.
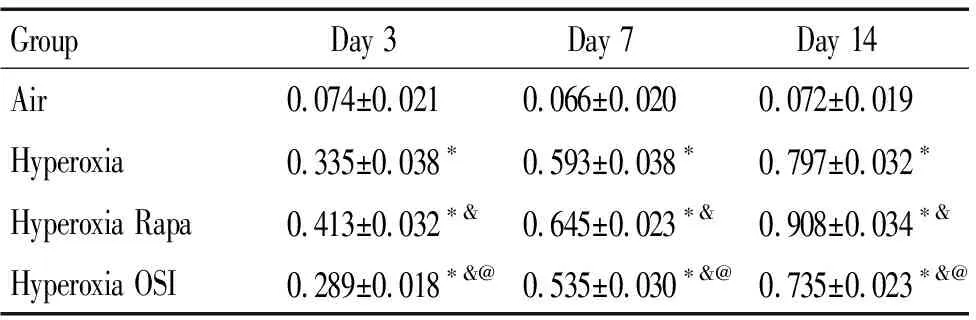
6 肺组织p-AKT1蛋白的分布
免疫组化结果显示,第3天时在高氧组SD幼鼠肺组织中p-AKT1基本为阴性,偶见阳性细胞;与空气组比较,第3、7和14天各时点在高氧组肺组织的上皮细胞、内皮细胞和间质细胞中p-AKT1阳性细胞减少(P<0.05);与高氧组比较,第3、7和14天各时点在高氧+雷帕霉素组和高氧+OSI-027组中p-AKT1阳性细胞增多(P<0.05);与高氧+雷帕霉素组比较,第3、7和14天各时点在高氧+OSI-027组的p-AKT1阳性细胞减少(P<0.05),见图2、4。
7 肺组织p-S6K1蛋白的分布
在各组肺组织内皮细胞、上皮细胞和间质细胞中p-S6K1呈阳性表达;与空气组比较,第3、7和14天各时点在高氧组肺组织中p-S6K1的阳性表达增加(P<0.05);与高氧组比较,第3、7和14天各时点在高氧+雷帕霉素组和高氧+OSI-027组肺组织中p-S6K1的阳性表达下降(P<0.05);与高氧+雷帕霉素组比较,第3、7和14天各时点在高氧+OSI-027组肺组织中p-S6K1的阳性表达水平差异无统计学显著性,见图3、4。
8 肺组织 p-AKT1和p-S6K1蛋白含量的变化
空气组随着生长发育时间的延长p-AKT1蛋白水平明显增加(P<0.05),高氧组随着高氧暴露时间的延长p-AKT1的蛋白水平明显升高(P<0.05)。与空气组比较,各时点在高氧组SD幼鼠肺组织中p-AKT1的蛋白水平降低(P<0.01);与高氧组比较,各时点在高氧+雷帕霉素组和高氧+OSI-027组SD幼鼠的肺组织中p-AKT1的蛋白水平升高(P<0.05);与高氧+雷帕霉素组比较,各时点在高氧+OSI-027组SD幼鼠肺组织中p-AKT1的蛋白水平降低(P<0.05),见图5。
空气组随着生长发育时间的延长p-S6K1蛋白表达明显增加(P<0.05),高氧组随着高氧暴露时间的延长p-S6K1蛋白表达明显升高(P<0.05)。与空气组比较,各时点p-S6K1在高氧组SD幼鼠肺组织中的表达量升高(P<0.01); 与高氧组比较,各时点p-S6K1在高氧+雷帕霉素组和高氧+OSI-027组SD幼鼠肺组织中的表达量降低(P<0.05);与高氧+雷帕霉素组比较,各时点p-S6K1在高氧+OSI-027组SD幼鼠肺组织中表达量的差异无统计学显著性,见图5。
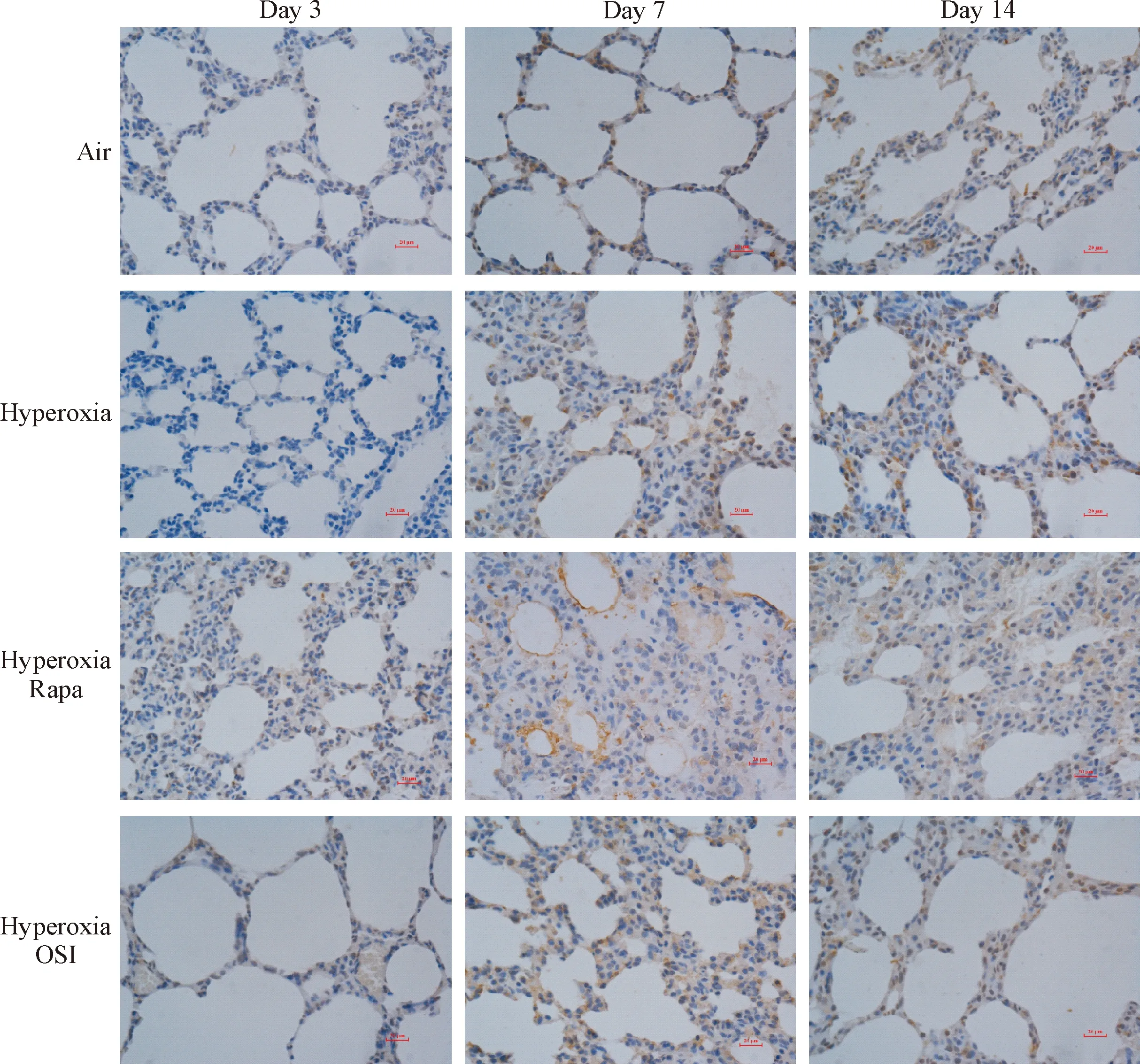
Figure 2.Distribution of p-AKT1 protein in each group (×400).
图2各组p-AKT1蛋白的分布
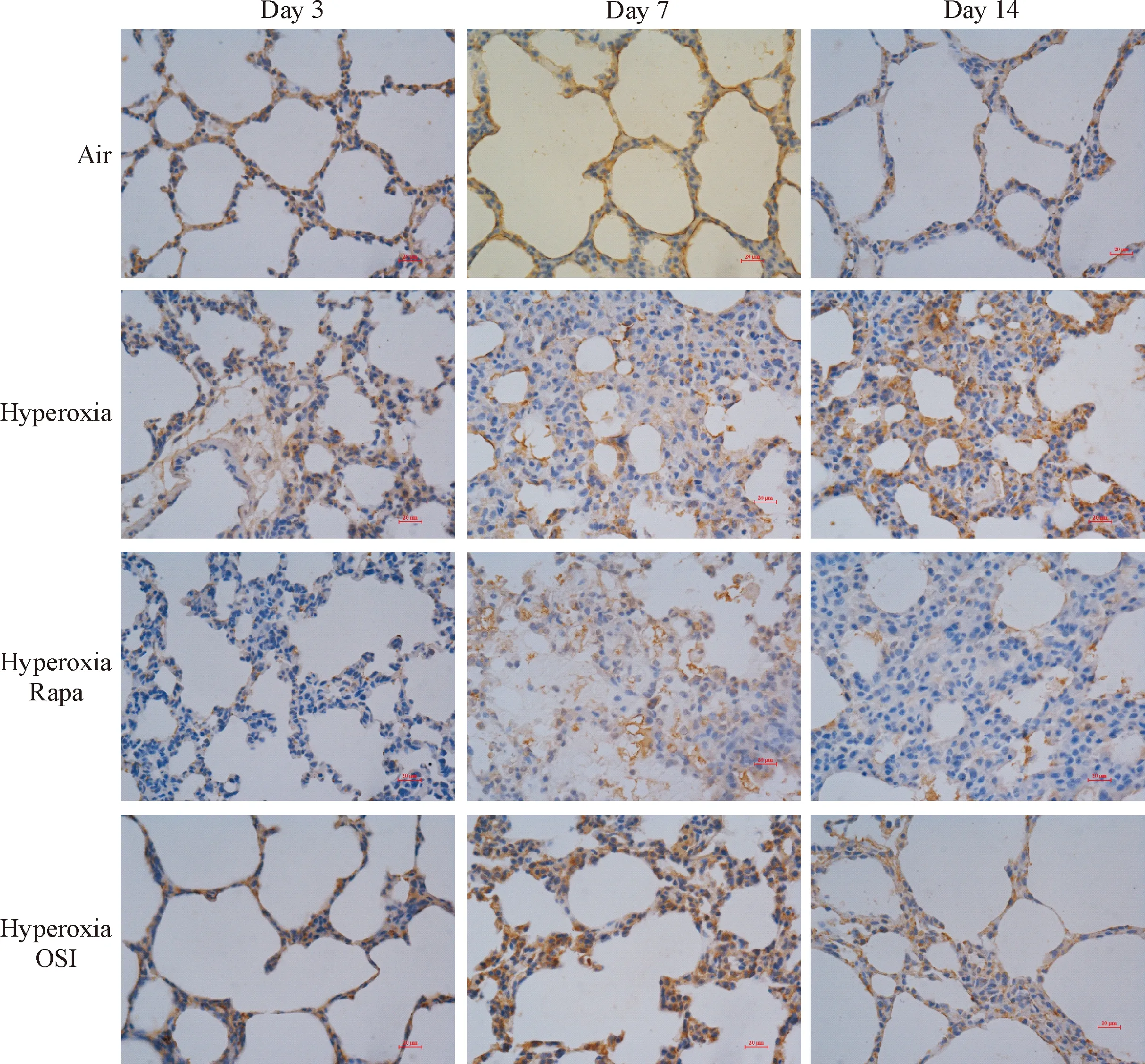
Figure 3.Distribution of p-S6K1 protein in each group (×400).
图3各组p-S6K1蛋白的分布
Figure 4.The relative protein levels of p-AKT1 and p-S6K1 in different groups on day 3, day 7 and day 14 were detected by immunohistochemistry. Mean±SD.n=6.*P<0.05vsair group;#P<0.05vshyperoxia group;△P<0.05vshyperoxia Rapa group.
图4免疫组织化学检测第3、7和14天各组p-AKT1和p-S6K1蛋白的相对水平
讨 论
高氧肺损伤的复杂病理生理过程主要表现为弥散性肺泡炎及肺损伤后修复重建,其病理学特征主要是细胞的坏死和凋亡,伴中性粒细胞渗出的肺泡炎性水肿及晚期的肺间质增生和肺纤维化的发生发展。本研究组已在高氧肺损伤方面开展了大量的相关研究[10]。本研究采用本实验室已成熟建立的高氧肺损伤动物模型[11-12],病理学检查结果显示,高氧第14天时,肺损伤评分显著增加,已出现肺间质及成纤维细胞的增生。
mTOR属于磷脂酰肌醇3-激酶(phosphatidylino-sitol 3-kinase,PI3K)蛋白家族,是一种非典型的丝氨酸/苏氨酸蛋白激酶,它被认为是调节细胞增殖、转分化、存活、生长、翻译、代谢及自噬的中心枢纽[13]。mTOR有功能不同的mTORC1和mTORC2 2个亚基。AKT1是mTORC2信号通路重要的下游靶蛋白,mTORC2具有激活AKT1的功能;AKT1又是mTOR的上游分子,可以激活mTOR,mTORC1下游信号转导通路:p-S6K1蛋白激酶能被雷帕霉素强烈抑制,但是4E-BP1磷酸化和自噬激活却对雷帕霉素不敏感[14]。由于S6K1是mTORC1的直接作用底物,因此,p-S6K1被认为是mTOR通路下游的重要效应蛋白分子,其水平升高可反映mTOR信号通路的活化情况。mTOR激活能促进基因转录和蛋白质合成,它在纤维化过程中扮演重要角色[15]。激活的AKT1参与细胞凋亡、葡萄糖代谢和蛋白质合成过程,从而调节细胞的存活和增殖[16]。因此,本实验中重点研究了肺组织pS6K1和p-AKT1 2种蛋白的表达水平。
AKT1与mTOR存在以下关系:一方面,AKT1可以直接使mTOR蛋白磷酸化而激活,促进相关蛋白的表达;另一方面,AKT1可以间接使mTOR激活,激活的AKT1促进结节性硬化复合物2(tuberous sclerosis complex 2, TSC2)发生磷酸化,抑制TSC1/2复合物的形成,从而阻碍其对mTOR的抑制作用,另外,AKT1还可以磷酸化PRAS40,抑制PRAS40对mTOR的负性调节作用[17]。
有研究发现,雷帕霉素用于抗肿瘤治疗时,可导致PI3K/AKT及Ras/Raf/ERK信号通路的激活,出现耐药现象[18]。正常状况下,mTORC1活化导致S6K1活化,活化的S6K1可磷酸化IRS-1,从而反馈抑制PI3K的活化;mTORC1被抑制后,S6K1活化水平降低,反馈抑制机制被打破,从而导致PI3K的激活,PI3K激活后作用于下游的AKT1及Ras/Raf/ERK,导致其活化[19],从而减弱雷帕霉素抑制细胞增殖的效果。同时,mTORC2对雷帕霉素不敏感,mTORC2的活化能够激活AKT1,通过下游一些信号通路,促进细胞存活与增殖[20-21]。
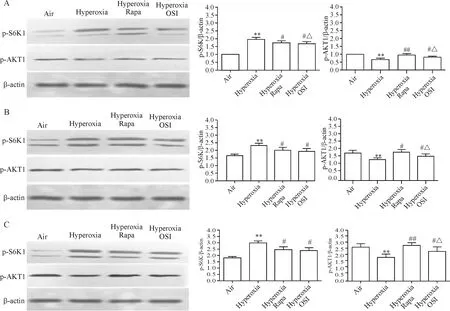
Figure 5.The relative protein levels of p-AKT1 and p-S6K1 in different groups on day 3 (A), day 7 (B) and day 14 (C) were detected by Western blot. Mean±SD.n=6.**P<0.01vsair group;#P<0.05,##P<0.01vshyperoxia group;△P<0.05vshyperoxia Rapa group.
图5Westernblot检测第3、7和14天各组p-AKT1和p-S6K1蛋白的相对水平
本实验免疫组化与Western blot的结果显示相一致,空气组和高氧组随着生长发育时间的延长p-AKT1和p-S6K1蛋白表达明显增加;与空气组比较,各时点高氧组SD幼鼠高氧暴露后肺组织p-S6K1蛋白表达显著增高,而肺组织p-AKT1蛋白水平显著减少;与高氧组比较,各时点在高氧雷帕霉素组和高氧OSI-027组肺组织中p-S6K1表达明显减少,而肺组织中p-AKT1表达明显增多,提示高浓度氧可激活mTOR/S6K1信号途径,降低AKT1的磷酸化,抑制mTOR信号通路能升高AKT1的磷酸化。
综上所述,mTORC1特异性抑制剂雷帕霉素不能减弱高氧致SD幼鼠肺损伤纤维化的作用,mTORC1和mTORC2双重抑制剂OSI-027能减轻高氧致SD幼鼠肺损伤纤维化的作用。本研究提示p-AKT1可能参与了高氧肺损伤的发生发展,激活AKT1有促进细胞存活与增殖的作用,其调控机制可能与mTOR信号通路有关。但细胞间复杂的信号网络通常伴有通讯串扰,单一信号通路的改变并不能完全阐明高氧肺损伤的发生发展机制。有关p-AKT1在高氧肺损伤纤维化中的具体作用和机制,尚有待进一步研究。
——雷帕霉素

