肝纤维化大鼠肝脏中组蛋白修饰水平的变化*
田 甜,郑 璐,汤 雷,余 蕾,谢汝佳,张金娟,韩 冰,杨 婷,丁凯泽,渠 巍,詹 玮△,杨 勤△
(1贵州医科大学病理生理学教研室, 贵州 贵阳 550004; 贵阳市妇幼保健院 2检验科, 3辅助生殖中心, 贵州 贵阳 550003)
肝纤维化是许多慢性肝脏疾病,包括感染、自身免疫反应、 药物治疗和辐射等共同的病理过程,是损伤修复过程异常调节的结果。在这个过程中,肝脏中以I型胶原(collagen type Ⅰ,ColⅠ)为主的多种细胞外基质(extracellular matrix,ECM)合成增多、降解减少以致ECM大量聚集,导致肝组织结构变化而出现肝纤维化甚至肝硬化[1-3]。有研究表明在许多肝脏疾病肝组织中组蛋白修饰水平异常,并且这种异常和肝脏疾病发生发展有关。组蛋白H3第9位赖氨酸乙酰化(histone H3 lysine 9 acetylation,acH3K9)和组蛋白H4第12位赖氨酸乙酰化(histone 4 lysine 12 acetylation,acH4K12)可中和其氨基端赖氨酸残基的正电荷,削弱组蛋白与DNA的接触,从而促进基因转录;组蛋白H3第9位赖氨酸二甲基化(histone H3 lysine 9 dimethylation,H3K9me2)后可募集异染色质蛋白1(heterochromatin protein 1,HP1)从而引发基因表达沉默;而组蛋白H3第4位赖氨酸二甲基化(histone H3 lysine 4 dimethylation,H3K4me2)对基因表达的影响却是相反的,它可以促进基因表达。本课题组前期研究发现在大鼠原代肝星状细胞(hepatic stellate cells,HSCs)活化过程中acH3K9、acH4K12、H3K4me2和H3K9me2修饰水平异常[4-5],然而在肝纤维化大鼠肝脏中上述组蛋白修饰水平是否异常,目前尚未见研究报道。因此本实验采用CCl4复制肝纤维化大鼠模型,观察肝纤维化大鼠肝脏中acH3K9、acH4K12、H3K4me2和H3K9me2修饰的变化,以探讨组蛋白修饰与肝纤维化发生发展的关系。
材 料 和 方 法
1 实验动物
清洁级雄性Wistar大鼠,体重200~220 g,由贵州省实验动物中心提供[(黔)2003-001]。
2 主要试剂
丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)检测试剂盒购自中生北控生物科技股份有限公司;透明质酸(haluronic acid,HA)、层粘连蛋白(laminin,LN)、IV型胶原(collagen type Ⅳ,Col Ⅳ)和Ⅲ型前胶原(procollagen type III,PCⅢ)检测试剂盒购自南京建成生物工程研究所;强细胞裂解液、蛋白酶抑制剂、BCA蛋白浓度测定试剂盒、兔抗H3K9me2和兔抗H3K4me2抗体购自上海碧云天生物技术有限公司;鼠抗α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)和I型胶原单抗购自Santa Cruz;兔抗H3、兔抗acH4K12、兔抗acH3K9和兔抗β-actin抗体购自Bioworld Technology。
3 主要方法
3.1实验分组 将20只大鼠随机分成2组:正常(normal)组10只和CCl4肝纤维化模型(fibrotic)组10只。
3.2动物模型的制备 皮下注射40% CCl4花生油溶液3 mL/kg(首次用纯CCl45 mL/kg),间隔3 d注射1次以制备大鼠肝纤维化模型,共8周;正常组大鼠皮下注射等量植物油溶液。造模结束后股动脉放血处死(处死前称体重),留取血液及全部肝脏。称肝脏湿重,每只大鼠取相同部位肝脏用10 %中性甲醛固定,剩余-80 ℃低温冰箱保存;血液经1 500 r/min离心10 min后将血清置于-80 ℃低温冰箱保存。
3.3肝脏指数的测定 肝脏指数(%)=肝脏重量/体重×100%。
3.4肝组织病理形态的观察 HE染色:将肝组织切片经二甲苯Ⅲ、二甲苯Ⅱ、二甲苯Ⅰ、 100%乙醇Ⅱ、 100%乙醇Ⅰ、 95%乙醇、 90%乙醇、 80%乙醇、 70%乙醇、50%乙醇、蒸馏水、苏木素染液、盐酸乙醇溶液、清水、清水、氨水溶液、伊红染液、蒸馏水、 50%乙醇、70%乙醇、 80%乙醇、 90%乙醇、 95%乙醇、 100%乙醇Ⅰ、 100%乙醇Ⅱ、二甲苯Ⅰ、二甲苯Ⅱ、二甲苯Ⅲ后入通风橱封片。 Masson 染色切片将肝组织脱蜡、苏木素染、流水稍洗、 1%盐酸乙醇分化、流水冲洗、丽春红酸性品红液染、蒸馏水、 1%磷钼酸水溶液、2.5%亮绿液染色、 1%冰醋酸、 95%乙醇、 100%二甲苯。镜下观察肝脏组织病理形态及肝损伤程度。
3.5肝功能的检测 采用全自动生化分析仪,对血清 ALT和AST进行检测。
3.6肝纤维化指标检测 放射免疫分析法检测血清 HA、 LN、 PCIII和Col Ⅳ的含量,严格按照试剂盒说明书进行操作。
3.7Western blot法检测肝脏组织中α-SMA和Ⅰ型胶原的含量及acH3K9、 acH4K12、H3K4me2和H3K9me2的修饰水平 提取蛋白,SDS-PAGE,转膜,脱脂奶粉封闭,加入对应抗体,4 ℃ 过夜。次日用TBST 洗膜后加入辣根过氧化物酶标记的 II 抗,室温孵育90 min,ECL发光成像,条带用Image Lab图像分析软件对每个条带吸光度(A)值进行定量分析。
4 统计学处理
采用SPSS 17.0统计软件包处理。数据以均数±标准差(mean±SD)表示。两组样本均数比较采用两个独立样本的t检验,以P<0.05为差异有统计学意义。
结 果
1 动物的一般情况
造模后3~4周间,模型组有1只大鼠死亡,尸检结果可见腹部有大量油状液体堆积,可能是急性感染所致。
2 正常组和模型组大鼠肝脏指数和大鼠血清肝功能的比较
对大鼠肝脏的形态学观察可见,正常对照组肝脏色泽红润,表面光滑,质地均匀、柔软,弹性好;模型组大鼠肝脏呈红褐色,表面有颗粒状结节,质地较硬。CCl4致肝纤维化模型大鼠肝指数及ALT和AST明显高于正常对照组(P<0.05),见表1。
表12组大鼠肝脏指数和血清肝功能的比较
Table 1.The levels of liver index and liver function in the rats between the 2 groups (Mean±SD)
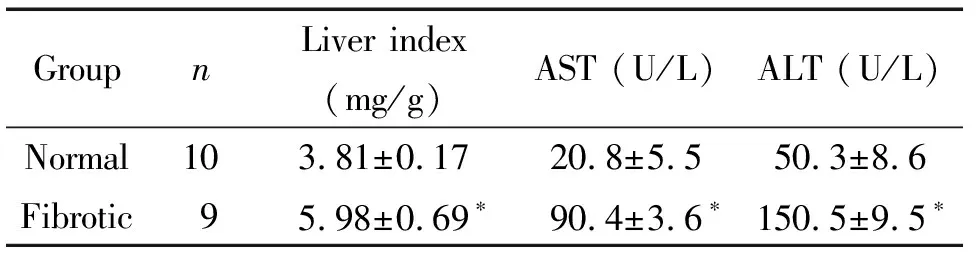
GroupnLiver index (mg/g)AST (U/L)ALT (U/L)Normal10 3.81±0.17 20.8±5.550.3±8.6Fibrotic9 5.98±0.69∗90.4±3.6∗150.5±9.5∗
*P<0.05vsnormal group.
3 正常组和模型组大鼠肝脏病理学的观察
正常组大鼠肝小叶结构正常,肝细胞以中央静脉为中心向周围呈放射状排列,窦周隙无胶原纤维增生;模型组大鼠肝索排列紊乱,有纤维结缔组织大量增生,有增生的纤维结缔组织分割原来的肝小叶并包绕形成大小不等的圆形或椭圆形的假小叶,见图1、2。
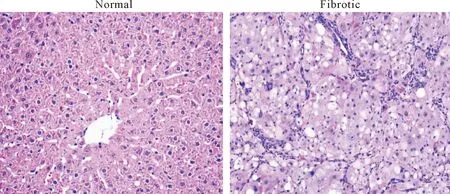
Figure 1.HE staining of rat hepatic tissues of each group (×200).
图1正常组和模型组大鼠肝组织HE染色结果

Figure 2.Masson staining of rat hepatic tissues of each group (×200).
图2正常组和模型组大鼠肝组织Masson染色结果
用METAVIR五级(F0:肝门无纤维化;F1:肝门纤维化、无分隔;F2:肝门纤维化、少许分隔;F3:大量分隔、无肝硬化;F4:肝硬化)评分系统进行胶原纤维增生程度半定量分级。结果表明模型组大鼠肝脏纤维化分级以F2~3级为主,明显高于正常对照组(P<0.05),见表2。
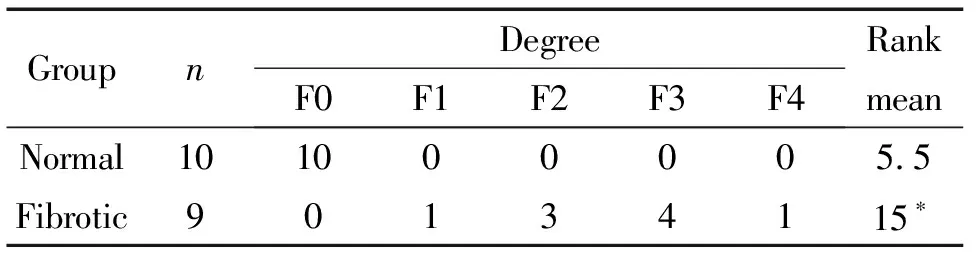
表2 大鼠肝纤维化程度分级
*P<0.05vsnormal group.
4 正常组和模型组大鼠血清肝纤维化指标的检测
与正常组比较,模型组 HA、 LN、ColⅣ和PCⅢ的水平显著升高(P<0.05),见表3。
5 Western blot法分析2组大鼠肝脏组织α-SMA和I型胶原蛋白的表达水平,以及acH3K9、acH4K12、H3K4me2和H3K9me2的修饰水平

表3 2组大鼠血清肝纤维化指标检测
*P<0.05vsnormal group.
正常组大鼠肝组织有一定量α-SMA表达,几乎不表达I型胶原,而肝纤维化组大鼠肝组织中α-SMA和I型胶原表达明显较正常大鼠高(P<0.05)。和正常组大鼠相比,肝纤维化组大鼠肝组织中acH3K9和H3K9me2的修饰水平明显增加(P<0.05),acH4K12的修饰水平较正常组大鼠明显减少(P<0.05),而H3K4me2的修饰水平与正常组比较差异无统计学显著性,见图3。
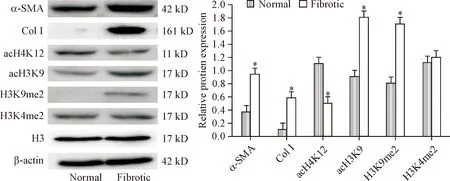
Figure 3.The protein levels of α-SMA, Col Ⅰ, acH4K12, acH3K9, H3K9me2 and H3K4me2 in the rat liver. Mean±SD.n=4.*P<0.05vsnormal group.
图3正常组和肝纤维化组大鼠肝脏组织中α-SMA和I型胶原蛋白表达水平,以及acH4K12、acH3K9、H3K9me2和H3K4me2的修饰水平
讨 论
由各种慢性肝病迁延不愈导致的肝纤维化在临床上非常常见,CCl4诱导大鼠肝纤维化是一个非常经典的肝纤维化模型,本实验中我们采取每隔3 d、连续8周对大鼠皮下注射CCl4的方法来复制大鼠肝纤维化模型。我们发现皮下注射CCl48周后大鼠的肝指数、血清ALT、AST、肝纤维化4项指标均显著增加;病理组织学HE染色、Masson胶原染色也显示皮下注射CCl48周后大鼠肝脏有较多炎性细胞浸润并伴有间质胶原纤维增加,有部分区域增生的纤维结缔组织分割包绕肝小叶形成假小叶,肝纤维化分级主要以2~3级为主,明显高于正常对照组大鼠,检测大鼠肝脏中α-SMA和I型胶原蛋白的表达量也明显高于正常组,表明我们复制的大鼠肝纤维化模型建立成功。
最近有研究发现,组蛋白共价修饰可能参与了多种慢性肝脏疾病的发生与发展过程。Jun等[6]在高脂饮食大鼠的肝脏中发现含Jumonji-C结构域的组蛋白去甲基化酶(Jumonji-C domain containing histone demethylase,JHDM/JMJD)较正常组大鼠肝组织低,由此他们推测H3K4me3和H3K9me3的修饰水平异常可能促进非酒精性脂肪肝的发展。Zhao等[7]发现在肝癌病理组织中赖氨酸特异性去甲基化酶(lysine-specific demethylase 1,LSD1)的表达明显增高,且随着肝细胞癌患者肿瘤病理分期等级增加,LSD1表达水平也逐步增高,病人的5年生存率更低,预示LSD1表达水平与肝癌肿瘤病人的恶性程度及预后相关。
本研究发现在肝纤维化大鼠肝脏中H3K9me2、acH3K9和acH4K12的修饰水平异常,具体表现为H3K9me2和acH3K9的修饰水平明显较正常对照组大鼠增加,而acH4K12的修饰水平却明显较正常对照组大鼠减少,H3K4me2的修饰水平没有明显变化。本课题组前期研究发现,在体外培养的大鼠原代激活型HSCs中acH3K9和H3K9me2的修饰水平较静止型HSCs中明显降低[4],这一结果与体内观察到的组蛋白修饰结果刚好相反,我们推测大鼠肝脏组织中主要以肝细胞为主(占肝细胞总数的55%),而HSCs仅占15%,因此在肝纤维化大鼠肝脏中观察到acH3K9和H3K9me2的修饰增加有可能代表的是肝细胞组蛋白修饰的变化。有研究观察到乙醇刺激大鼠原代肝细胞后细胞中acH3K9的修饰水平增高[8];有类似研究发现,与肝细胞相比,大鼠原代激活型HSCs需乙醇刺激更长时间,细胞中acH3K9的修饰水平才会增加[9]。这些研究结果支持我们上述推测。有研究发现,在胆汁淤积所致的大鼠肝纤维化肝脏中TGF-β基因启动子区的H3K9me2水平降低,从而促进TGF-β基因转录,使TGF-β蛋白表达升高,导致肝纤维化发生发展[10]。由此我们推测大鼠肝纤维化肝脏中H3K9me2的修饰水平降低有可能通过调控促肝纤维化相关蛋白如α-SMA和Ⅰ型胶原等的表达,从而参与肝纤维化的发生。
有研究表明在肝硬化患者肝组织中H3K4me2的去甲基化转移酶RBP2和α-SMA表达上调,沉默人HSCs细胞株LX-2中RBP2基因后发现细胞中α-SMA表达下调,而过表达LX-2细胞中RBP2基因后发现细胞中α-SMA的表达上调,因此认为RBP2调控了肝硬化患者肝脏中α-SMA的表达,从而参与肝硬化的病理过程[11]。我们在肝纤维化大鼠肝脏中发现H3K4me2修饰水平与正常组无明显变化,有可能是本实验中的肝纤维化大鼠病理分级较轻,如果延长肝纤维化造模时间,大鼠肝脏纤维化程度加重,肝组织中H3K4me2修饰水平可能会发生明显变化。
综上所述,大鼠肝纤维化肝脏中acH4K12、acH3K9和H3K9me2的修饰水平异常。这些异常变化可能与细胞外基质代谢相关基因转录调控有关,从而参与了大鼠肝纤维化发生。

