基于SSR标记的柱花草种质资源遗传多样性与群体结构分析
卞 华,申 晴,韦海燕,蒋亚君,丁西朋,白昌军
(1. 海南大学热带农林学院,海南 海口 570228;2. 中国热带农业科学院热带作物品种资源研究所,海南 儋州 571737)
柱花草(Stylosanthesspp.)属于自花授粉植物,为多年生豆科牧草,具有适应性强、耐酸瘠土、耐干旱和饲草产量高等优点[1],是全球热带及亚热带地区广泛种植的优良牧草[2]。自20世纪80年代初,我国大量引进柱花草种质资源,并将其广泛应用于土壤改良、水土保持及林草间作。随着柱花草种质资源的不断引进和改良,形成了国内独特而丰富的柱花草种质资源[3]。柱花草属包含的种和变种约50个,圭亚那柱花草(S. guianensis)、有钩柱花草(S. hamata)、头状柱花草(S. capitata)、灌木粘质柱花草(S. seabrana)、矮柱花草(S. humilis)等为常见的栽培种[4]。
环境和人工选择引起的遗传变异丰富了柱花草种质资源的基因类型。近年来,人们越来越重视柱花草种质资源的开发和利用,柱花草种质资源遗传背景也变得越来越复杂[4]。加深遗传背景的研究及遗传多样性的分析有利于柱花草种质资源分类、收集、保存和利用[4]。近年来,柱花草种质资源的研究主要集中在遗传多样性上,学者们利用SSR、SRAP、ISSR和RAPD等分子标记技术对来源不同的柱花草材料进行分类[5-9]。这些研究充分揭示了柱花草种质资源复杂的遗传背景和丰富的遗传多样性[10],但关于柱花草群体结构分析的研究鲜有报道。
目前,群体结构分析在水稻(Oryza sativa)[11]、玉米(Zea mays)[12]、大豆(Glycine max)[13]等大田作物中已经得到应用,关于柱花草群体结构的分析尚未深入开展。本研究利用SSR标记分析了68份柱花草材料的遗传多样性和群体结构,这对揭示柱花草种质资源间进化关系、加快柱花草资源利用效率和优良亲本的选配有着重要的意义[14]。
1 材料和方法
1.1 材料
供试材料为来自12个柱花草种的68份种质资源(表1)。其中有钩柱花草18份,细茎柱花草(S.gracilis)、圭亚那柱花草各9份,头状柱花草、灌木粘质柱花草各7份,狭叶柱花草(S. angustifolia)5份,大叶柱花草(S. grandifolia) 4份,卡尔奇柱花草(S. calcicola) 3份,其余4个种共6份柱花草种质资源。
上述材料均保存在中国热带农业科学院热带作物品种资源研究所基地,试验材料分小区按编号顺序种植,每份材料种植15株,株间距20 cm,行间距2 m,列间距1.5 m,常规大田管理。
1.2 DNA提取与检测
采集营养生长时期的柱花草嫩叶,每份材料采集5株,每株选取3片嫩叶,在液氮中混合研磨成粉末,根据张龙改良的CTAB法[15],提取基因组DNA。采用1%琼脂糖凝胶电泳检测DNA样品质量及纯度,利用超微量分光光度计(GE Healthcare)测定DNA样品的浓度,将DNA样品浓度用无菌水稀释到 100 ng·μL-1,并放置-20 ℃ 备用。
1.3 SSR引物来源和PCR扩增体系
从利用热研5号柱花草转录组数据开发并验证的523对SSR引物中筛选出多态性好、条带清晰的30对引物[16](表2),由上海生工生物工程公司合成,对所有材料进行PCR扩增。并对不同引物在不同种中的扩增情况以及不同材料的多态性进行分析。 PCR扩增扩增条件和程序根据丁西朋等[17]描述的方法进行。
1.4 数据收集与分析
以DL2000DNA Marker作为分子量参考,用Excel对条带进行“0,1”系统统计,有条带记为“1”,无条带记为“0”。利用PopGen1.32软件分析引物的等位基因数、等位基因频率和Shannon-Wiener多样性指数。并计算各个SSR位点的多态性信息量(poiymorphism information content, PIC)。
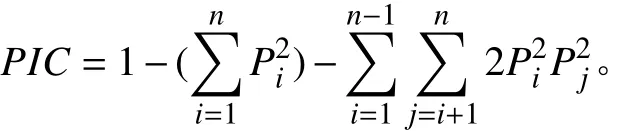
式中:n代表每个位点检测到的等位基因数目,Pi、Pj是第i、j种等位位点占总等位位点的百分率[18]。通过NTSYS-pc 2.10e软件计算出柱花草种质间的遗传相似系数 (Genetic similarity coefficient, GS),然后以GS值为基础根据非加权组平均法 (UPGMA)对试验材料进行系统的聚类分析[19],得到对应的tree plot,并用mantel检测其相关性。基于分子数据采用Structure 2.3.4软件[20]对柱花草群体遗传结构进行分析,先将K值设为1~10,开始时的不作数迭代设为10 000次,其后的MCMC设为100 000次,每个K值独立重复运行10次[12]。依据似然值最大原则从lnP(D)中选择所合适的K值,若lnP(D)一直随K值增大而不断增大,则依据Evanno等[21]提出的△K值分析法来确定最终的K值
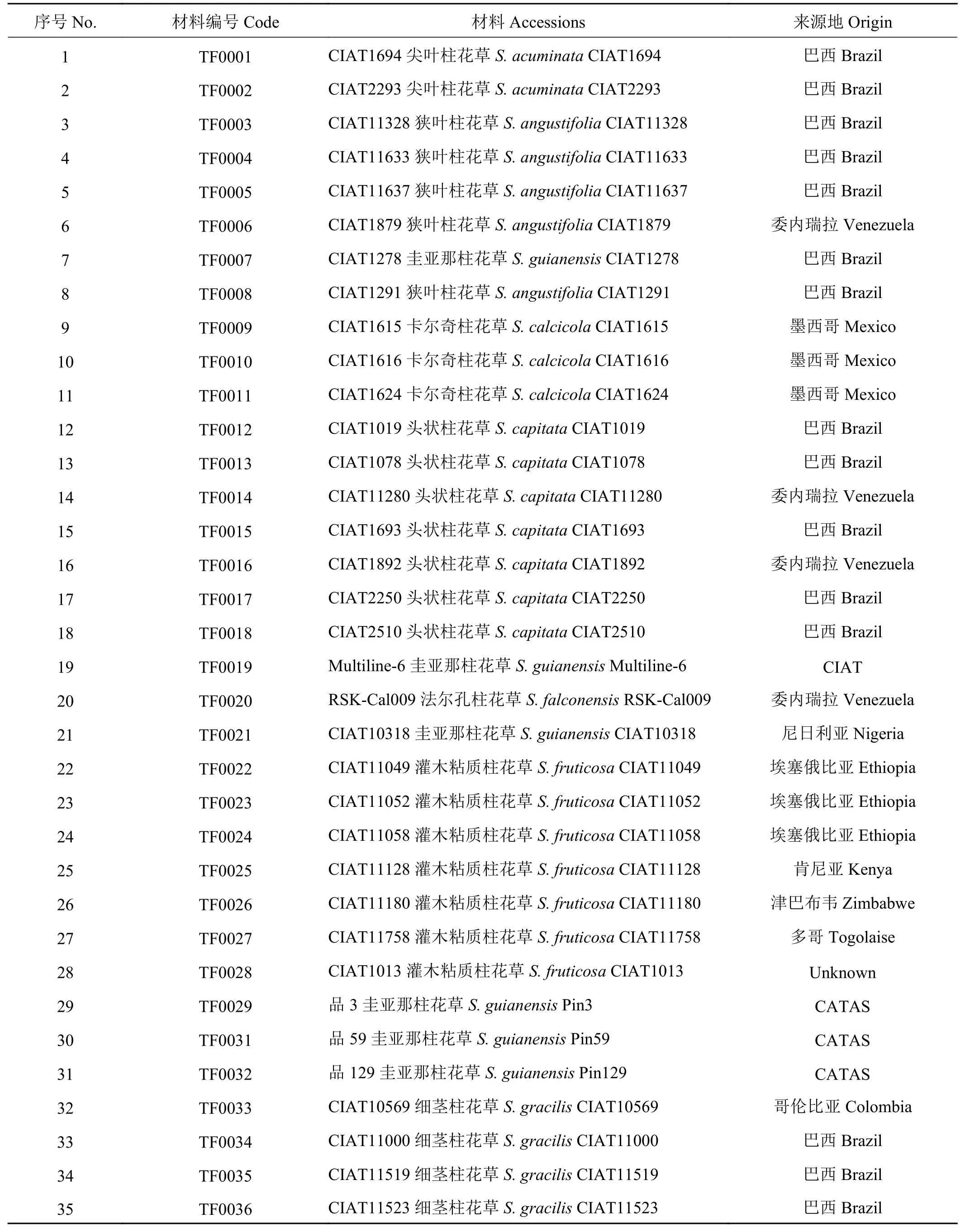
表 1 供试柱花草种质资源信息Table 1 The Stylosanthes germplasm used in this study
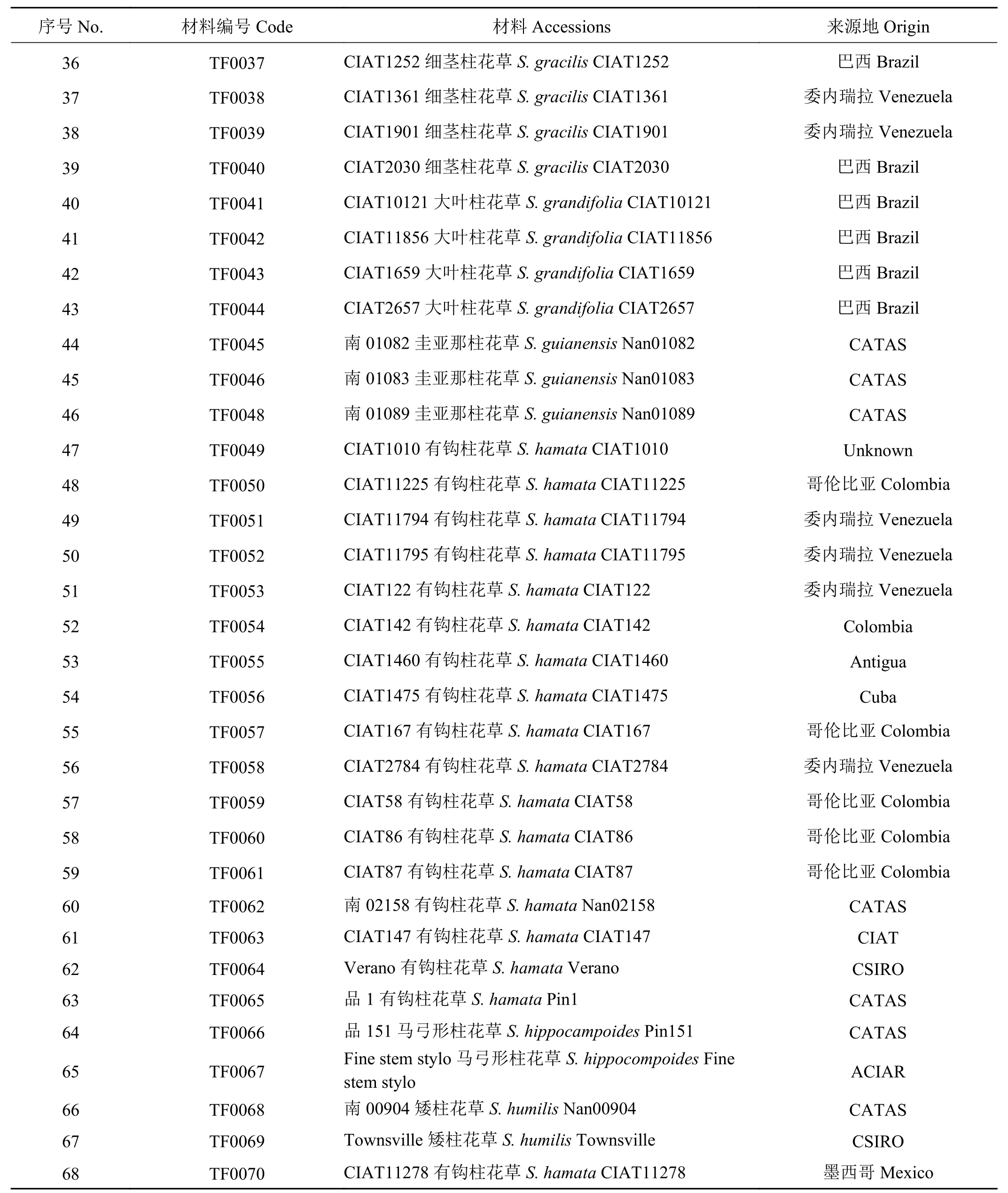
续表 1Table 1 (Continued)
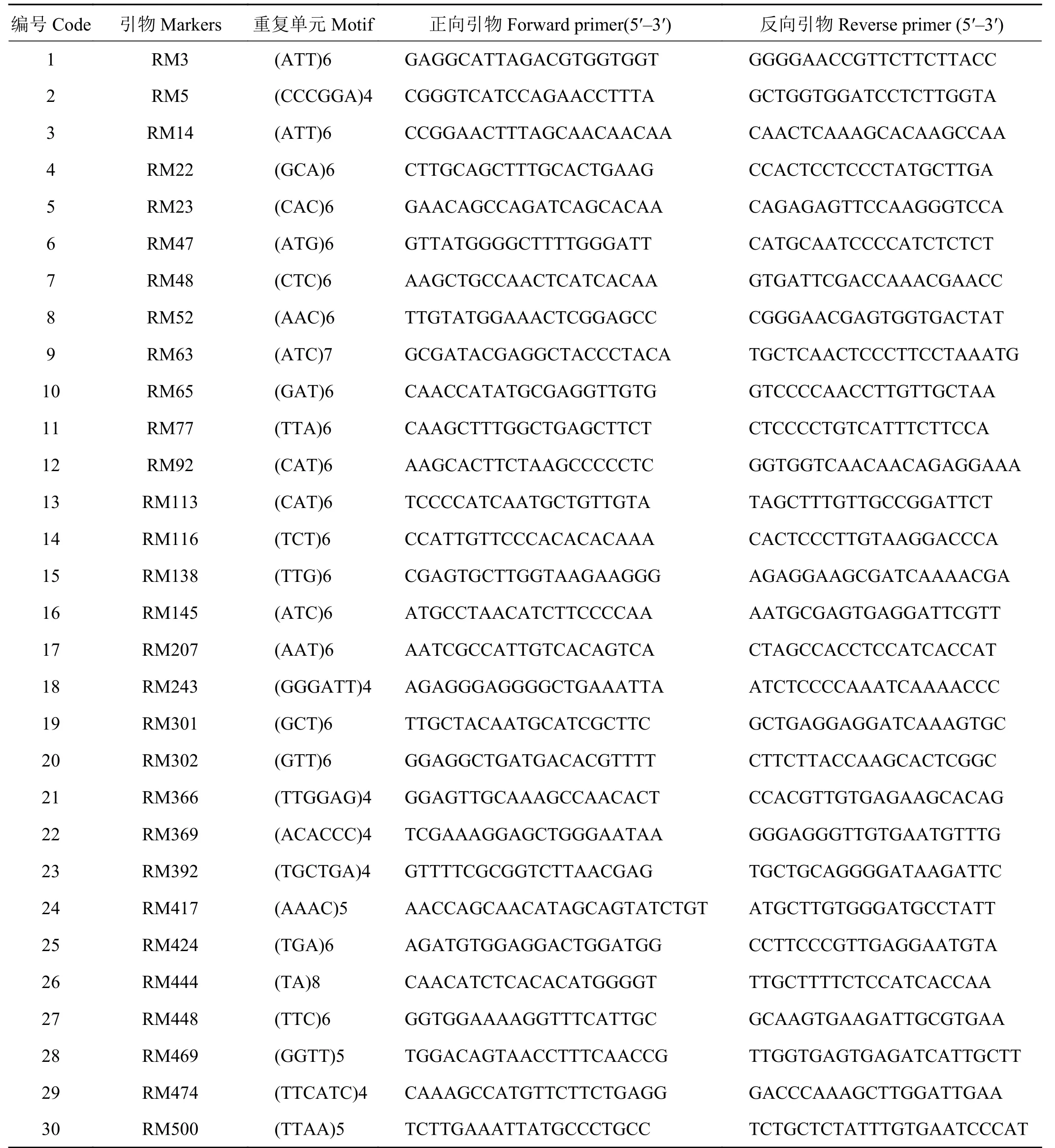
表 2 供试SSR引物Table 2 SSR primers used in this study
lnP(D)即L(K)。并根据基因组变异源在该群体中的概率Q值[22],分析群体结构。
2 结果与分析
2.1 SSR扩增结果
本研究利用30对SSR引物对68份柱花草种质资源进行了遗传多样性分析(图1)。30对SSR引物在68份柱花草材料中共扩增出146个等位基因,每个SSR标记的等位基因数为2~7个,平均观测等位基因数为4.867个。其中等位基因最多的是RM116、RM301和RM65,最少的是RM77。30个多态性SSR标记的Shannon-Wiener多样性指数I值和PIC值的变化范围分别0.676~1.690 和0.363~0.764,平均为 1.195 和0.577。各遗传多样性参数均显示RM77的多态性最低,RM301的多态性最高(表3)。
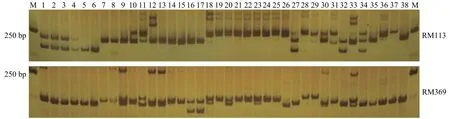
图 1 引物RM113、RM369在38份柱花草中的扩增情况Figure 1 Amplified results of primer RM113,RM369 in 38 accessions
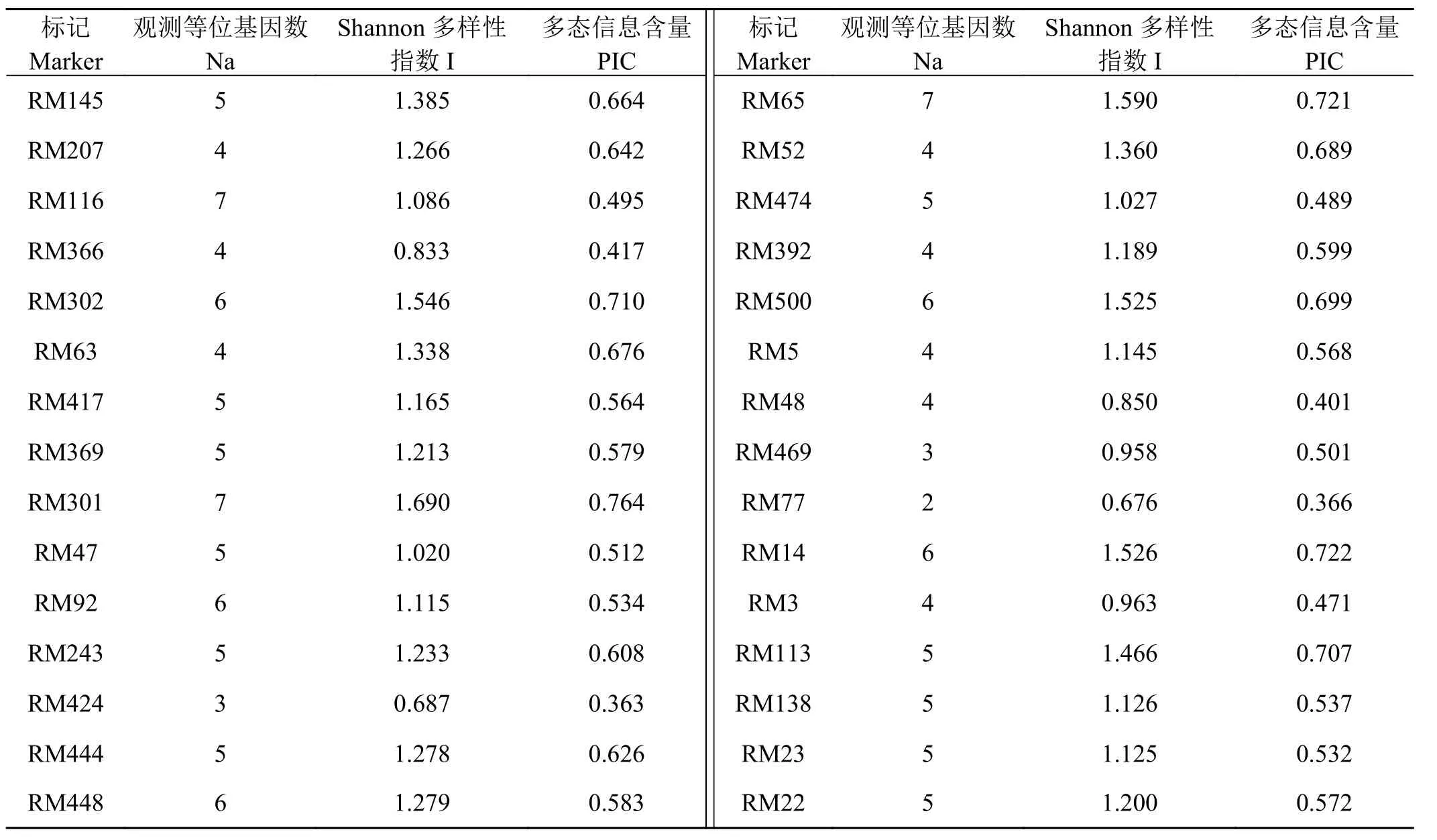
表 3 68份柱花草材料遗传多样性EST-SSR分析Table 3 EST-SSR genetic diversity analysis of 68 Stylosanthes accessions
2.2 遗传多样性分析
2.2.1 遗传相似系数分析
基于30个多态性SSR标记的带谱,利用NTSYS-pc 2.10e分析不同来源的68份柱花草材料的遗传多样性。研究显示,供试材料间的遗传相似系数介于0.493~0.986,平均为0.739。其中南01082与南01083圭亚那柱花草遗传相似性最大。而CIAT58与CIAT147有钩柱花草的遗传相似系数最低,为0.493。从各柱花草种质间平均相似系数来看,CIAT2510与其他材料的平均相似系数最低,为0.638,表明CIAT2510与其他种质的亲缘关系最远;Fine stem stylo与其他材料的平均相似系数最高,为0.856,其次为CIAT122柱花草,为0.849。不同材料之间的遗传相似系数值大多分布在0.600~0.800,这部分所占比例高达到82.61%,相似系数小于0.600的占3.27%(图2),这表现出68份柱花草材料遗传基础的异质性,柱花草种质资源的多样性。
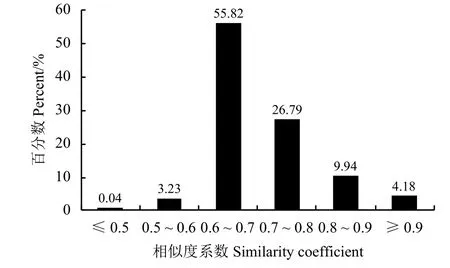
图 2 68份柱花草种质间的遗传相似系数Figure 2 The analysis of the similarity coefficient between the 68 accessions
2.2.2 聚类分析
根据遗传相似系数将供试的68份柱花草材料根据UPGMA法进行聚类分析(图3),由聚类图可以看出,在相似系数0.730处所有参试材料可明显划分为六大类群。第Ⅰ类群包括24份种质材料。在相似系数0.750处可分为2个亚类:第1亚类以细茎柱花草为主,包括2份尖叶柱花草、1份圭亚那柱花草、7份细茎柱花草、4份大叶柱花草和2份马弓形柱花草。第2亚类包括8份材料,均为圭亚那柱花草,其中南01082与南01083亲缘关系最近。第Ⅱ类群以狭叶柱花草为主,包括5份狭叶柱花草、1份有钩柱花草和2份矮柱花草。第Ⅲ类群只包括9、11和10号材料,均为卡尔奇柱花草。第Ⅳ类群包括19份种质材料,在相似系数0.820处可分为3个亚类:第1、2亚类分别为RSKCal009法尔孔柱花草和CIAT1361细茎柱花草,第3亚类为17份有钩柱花草。第Ⅴ类群为7份灌木粘质柱花草材料。第Ⅵ类群为7份头状柱花草材料。
2.3 不同来源柱花草种质的群体结构分析
根据试验所得SSR分子数据,使用Structure软件对供试柱花草进行遗传结构分析。由于似然值随K值的增大而不断增大,为选择合适的K值,参考Evanno等[21]的方法,绘制ΔK随着K值增大的变化曲线 (图 4),当 ΔK最大时,K= 6,因此将参试材料划分6个类群。在68份柱花草的遗传结构图中(图5),不同的颜色代表不同的群体,按顺序分别为红色、绿色、蓝色、黄色、紫色、青色,以上颜色分别代表1~6个群体,纵坐标表示各群体的种质占其群体祖先成分的比例,即Q值,横坐标表示各种质序号。本研究参照刘丽华等[23]的研究,将Q ≥ 0.600视为血缘相对比较单一,Q<0.600视为具有混合来源。
分析各柱花草材料在不同类群中的Q值发现,68份柱花草材料中的62份材料(91.18%)在某一类群中的Q ≥ 0.600,遗传基础比较单一,分到了某一个类群中。而其余的6份柱花草材料(8.82%)在每一类群中的Q<0.600,遗传结构比较复杂,没有明确的类群归属特性,形成了一个混合群体 (表 4)。
分析划入指定群体的62份柱花草材料发现,在6个类群中,类群1(红色)的材料共12份,头状柱花草7份狭叶柱花草5份,占群体的17.65%。类群2(绿色)中材料的遗传成分较为复杂共16份,占群体的23.53%,各材料的成分值为69.10%~99.60%,其中有3份材料遗传背景比较复杂,按Q值从小到大依次是1、2、43号。分入类群3 (蓝色)的材料最多,有17份,占总体的25.00%,主要为有钩柱花草,各材料的成分值为83.70%~97.40%,这些材料亲缘关系比较近,遗传基础差异不大,其中57号材料Q值最小,遗传背景比较复杂。类群 4 (黄色)共包含 7份材料,Q>0.900, 种质来源单一的全部为灌木粘质柱花草,这表明材料遗传背景简单,与其他亚类间缺少基因交流。归入类群5(紫色)的材料最少(3个),占总材料的4.41%,包含全部3份卡尔奇柱花草。类群6(青色)包含7份材料,均为圭亚那柱花草,占群体的10.29%,各材料的成分值为71.7%~99.5%,其中19号材料遗传背景比较复杂,Q值最小(图 5)。

图 3 68份材料遗传相似系数的UPGMA聚类图Figure 3 UPGMA dendrogram of 68 accessions based on genetic similarity coefficient
2.4 聚类分析与群体结构分析的比较
通过计算材料间的遗传距离,聚类分析将距离近的材料聚在一起。而Structure分析是将材料预先设定几个类群,然后计算每个位点的等位基因频
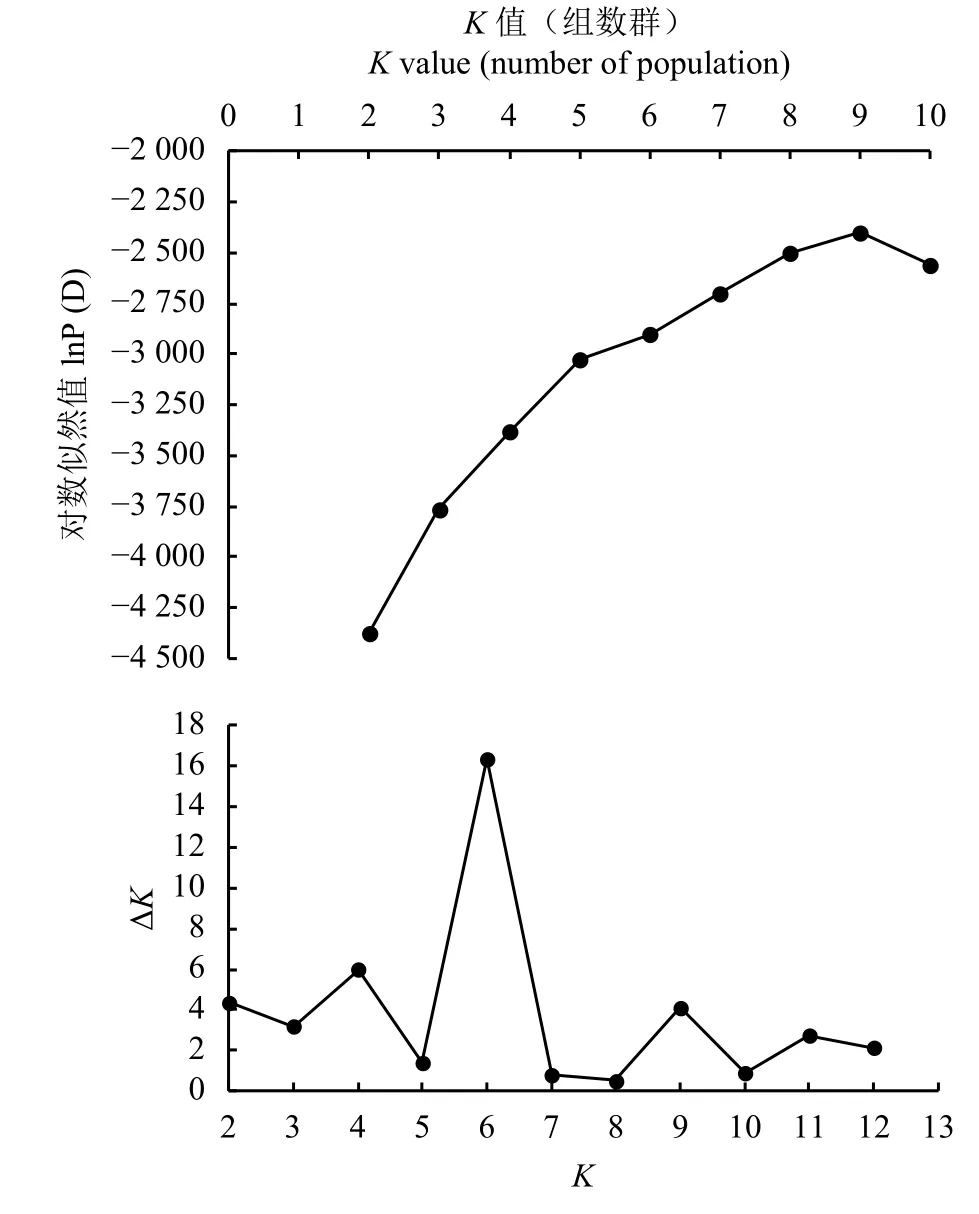
图 4 K值曲线图Figure 4 Gurve diagram of K value
率和遗传相似性比例,遗传相似比例高的材料被划分在同一个类群。聚类分析可以从宏观上显示材料的遗传一致性程度,基于模型的Structure分析可以计算出材料之间的共祖度,从更微观角度解释材料的遗传背景[24]。结果显示,两种方法对68份柱花草材料类群的划分中,遗传背景单纯的材料类群划分情况大致统一,例如在群体结构分析中被单独划分成一个类群的7份灌木粘质柱花草,在聚类分析中也聚在一起[25];同样的情况也适用于3份卡尔奇柱花草。在群体结构分析中归入第3亚类的有钩柱花草,在聚类中也都划在了第IV类群。上述两种分析方法在对遗传背景复杂、多种来源的材料的类群划分结果上有些差异,如聚类分析中聚到第IV类群的20和37号,而在群体结构分析中,则与遗传组成比较复杂的7、60、66、67号分到了混合群体中。在聚类分析中29、30、31、44、45、46号聚到了第I类群,而在群体结构分析中根据Q值则单独划分成为第6类群。
3 讨论与结论
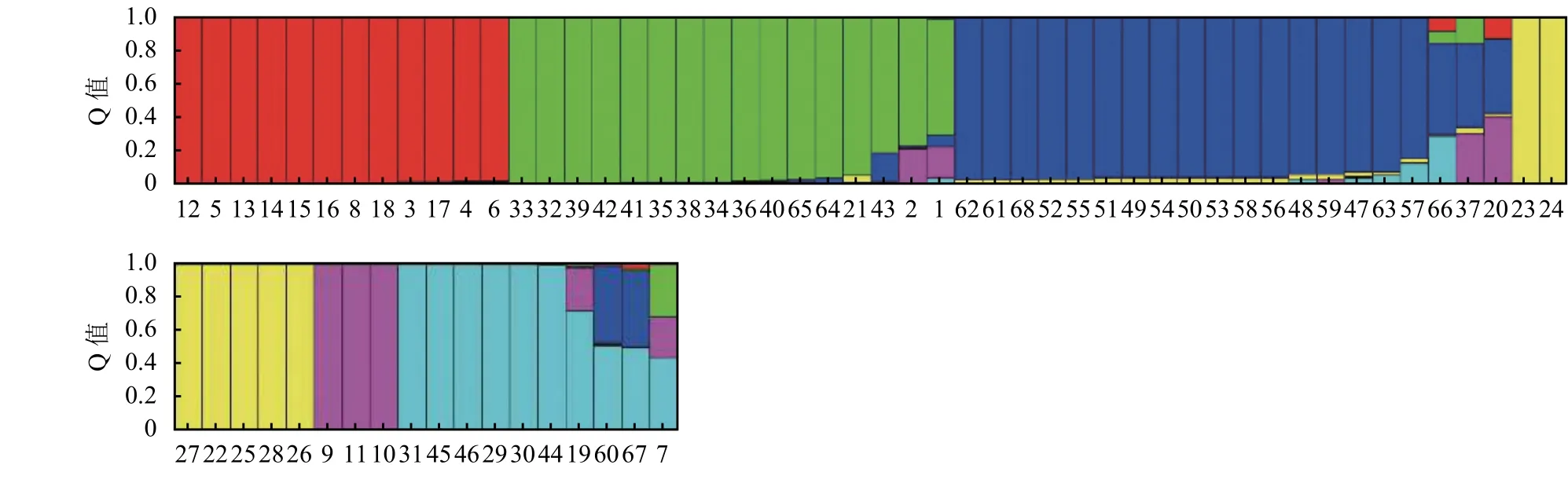
图 5 68份柱花草种质资源的遗传结构分析(K=6)Figure 5 Population structure of 68 Stylosanthes germplasm (K=6)
SSR标记具有多个优点,如数量丰富、多态性高、操作简单和重复性好,这使SSR技术应用于多个领域[26]。Santos-Garcia等[27]利用20个共显性强的SSR标记,对150份植物学分类存在争议的柱花草材料进行了遗传多样性和群体结构分析。Chandra等[28]研究并开发133个柱花草SSR标记,用于柱花草物种内的遗传改良。孙友位等[29]通过利用SSR分子标记研究玉米375个自交系间的遗传变异,认为SSR能够有效地揭示自交系之间的遗传多样性。此外其他学者利用STS、RFLP及ITS等分子标记和叶绿体DNA序列差异对柱花草属种间分类进行了研究[30-32]。在本研究中,30对引物在68份柱花草中均能有效扩增,共检测到146个多态性位点。在这30对引物中,有8对引物在柱花草遗传连锁图谱中被定位在5个不同的连锁 群[33],其中RM63、RM243、RM424被定位在1号连锁群,RM65被定位在2号连锁群,RM47、RM444被定位在4号连锁群,RM92被定位在7号连锁群,RM145被定位在8号连锁群,充分表明这些标记在整个基因组较分散,能够有效地鉴定柱花草种质间的遗传背景和亲缘关系。
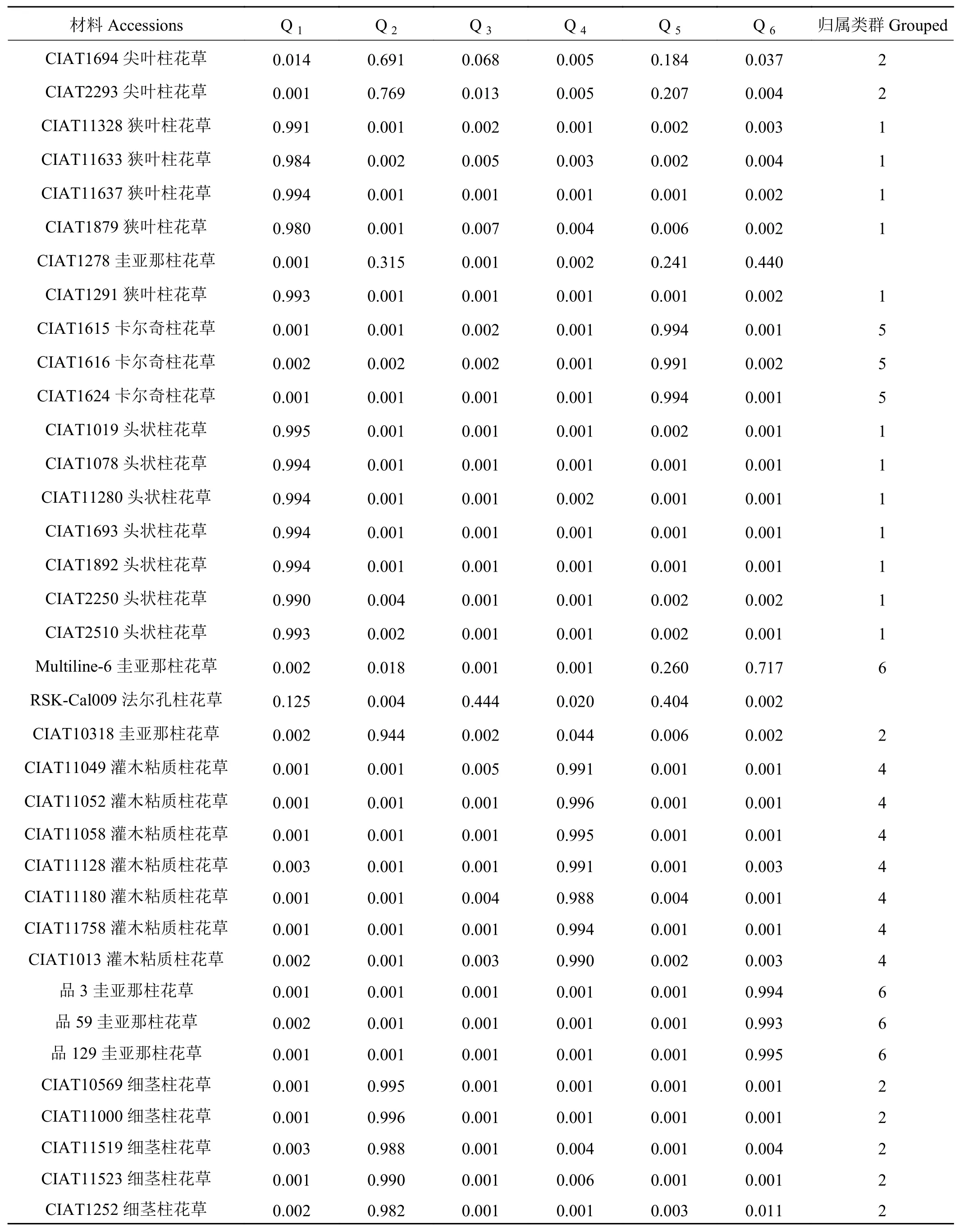
表 4 68份材料的群体结构Table 4 Population structure of 68 materials
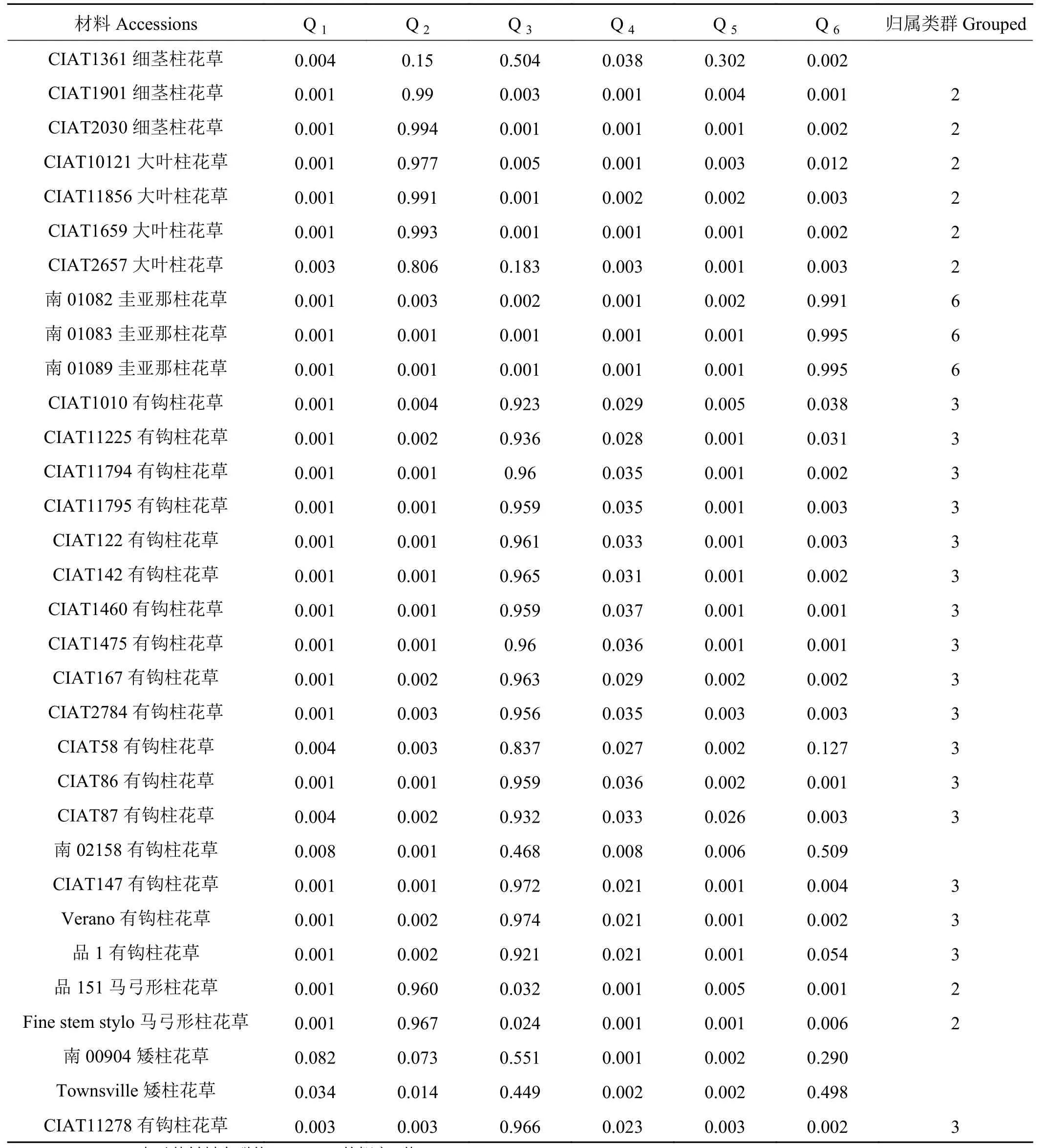
续表 4Table 4 (Continued)
利用SSR数据对68份柱花草材料进行聚类分析,从结果来看,约82.61%试验材料的相似系数分布在0.600~0.800,与Karia等[34]、唐燕琼等[35]得出柱花草种质资源遗传多样性丰富的结果一致。其中南01082与南01083有钩柱花草,遗传相似性最大,这和它们拥有相同的基因组类型有关。CIAT11052灌木粘质柱花草与南00904矮柱花草亲缘关系最远,遗传相似性最小。群体结构就是一个群体内存在的亚群情况。Wang等[36]在玉米研究中将结构相对单一的判断标准定为Q = 0.800,刘丽华等[23]在小麦 (Triticum aestivum)中定为 Q = 0.600,由于用于研究的材料复杂程度不同,因此本研究将Q(各个体归入某一类群的概率)≥ 0.600视为结构相对单一,将参试柱花草种质材料分为6个类群。占总数91.18%的62份材料Q>0.600,遗传组分单一。6份材料Q<0.600,遗传结构复杂。在这6个类群中,遗传多样性水平最高的是类群2,包含的尖叶柱花草、细茎柱花草、大叶柱花草、马弓形柱花草及少量的圭亚那柱花草,而这些种质的基因组均为G基因组,这与丁西朋等[26]的研究结果一致。类群3和类群6中均含有有钩柱花草和矮柱花草,它们都来源于南美洲,有钩柱花草的基因组为AA或AACC,而矮柱花草的基因组为CC,C基因组与AACC的的遗传关系很近,已经被多次证实[26]。类群2和类群6均有圭亚那柱花草,但类群6多为中国热带农业科学院热带作物品种资源研究所引进后经多次选育而成的柱花草材料,类群2为从哥伦比亚国际热带农业中心引进的种质,这些种质采集于巴西、委内瑞拉等南美洲地区,不同地理环境的相同种质选育同样造成了基因间的差异。本研究证明,划入混合群体的材料(8.82%),不同类群间的柱花草材料存在分子水平基因交流,因此在选择这些材料作为育种亲本时,除考虑材料间的亲疏关系外,还要考虑其复杂的遗传组分[37]。
在聚类分析中,当相似系数为0.730时,68份柱花草种质资源可分为6类。Ⅰ、Ⅱ、Ⅲ和Ⅳ这4类比较集中,和Ⅴ、Ⅵ类相对分散,这种分布与倍性及基因组类型有关,与Vogel将柱花草划分为Styposanthes(包含二倍体和多倍体)和Stylosanthes(完全为二倍体)两大分支的分类情况基本一致[38]。第Ⅰ大类中7份细茎柱花草聚为亚类iii,尖叶柱花草、大叶柱花草、马弓柱花草和所有圭亚那柱花草聚在一起,他们都为二倍体且含有G类基因组[39],亲缘关系较近,这与前人研究结果[40-41]一致。在本研究中第Ⅰ大类主要包括细茎柱花草和所有圭亚那柱花草、大叶柱花草资源,这一大类具有掌状三出复叶,不开叉龙骨瓣,小叶较长,绿色茎色等植物学形态。第Ⅲ亚类主要包括矮柱花草和有钩柱花草材料,明显特征是具有毡毛型茎毛。第Ⅵ大类包括7份材料,均为头状柱花草,这一类大多具有紫色或红褐色茎,椭圆形或卵圆形叶等明显特征。聚类分析得到的结果与实际植物学分类结果[42]比较一致,说明这种评价方式是可行的。
本研究结果表明,在大多数材料的划分上,上述两种分析方法都保持一致性,对于那些因遗传背景复杂在群体分析中处于混合亚类的材料,则存在一定程度的差异性。在遗传背景研究方面,群体结构分析比遗传多样性分析能进一步表示出育种材料的内在遗传结构,研究者可以更有针对地进行材料的选择[25]。柱花草种质资源具有丰富的遗传多样性,这些数据可以提供补充信息,对现有种质资源的保存工作具有重要意义,并有助于规划新的采集行程。此外,揭示其遗传基础的异质性,对后续关联分析和挖掘优良基因至关重要[14]。

