氨氮胁迫对凡纳滨对虾的生长状况及虾肝肠胞虫(EHP)携带量的影响
徐胜威,杨 程,斯烈钢,申屠基康,沈伟良
(宁波市海洋与渔业研究院,浙江宁波 315000)
凡纳滨对虾(Litopenaeusvannamei),又称南美白对虾,隶属甲壳纲(Crustacea)十足目(Decapoda)对虾科(Penaeidae)对虾属(Penaeus),主要分布于太平洋海岸水域[1]。由于其肌肉成分中脂肪含量低,蛋白含量高,并富含多种饱和脂肪酸,使其具有较高的营养价值。凡纳滨对虾因其生长周期短,抗逆性强,经济效益高,成为全球养殖产量最高的三大优良品种之一,并于20世纪80年代末引入我国,经过30多年的发展,其养殖面积不断扩大,技术不断更新,目前已成为我国水产品养殖面积最大的品种之一[2]。然而,由于凡纳滨对虾养殖产量高,经济效益显著,集约化养殖模式发展迅速,养殖密度逐渐提高,导致养殖环境的不断恶化,养殖水体污染严重,其中氨氮作为重要的水质因子已成为影响水产养殖品种健康生长的主要因素之一。研究表明,在一定浓度的氨氮胁迫下水产病害极易发生和流行[3]。虾肝肠胞虫(Enterocytozoonhepatopenaei,EHP)属于真菌界(Fungi)微孢子虫门(Microsporidia)单倍期纲(Haplophasea)壶孢目(Chytridiopsida)肠胞虫科(Enterocytozoonidae)肠胞虫属(Enterocytozoon)[4-5],属于细胞内寄生[6-7],是目前影响对虾养殖的主要疾病之一,最早于2009年在泰国发现,2013年我国第一次在养殖凡纳滨对虾中检测出EHP,并有很高的感染率[8]。运用PCR检测技术可以从感染EHP的凡纳滨对虾的水环境、排泄物及肝胰腺等器官中检测出EHP[9-11],其鳃、血淋巴、肠、心脏、肌肉组织也均可检测到EHP[12-13],但不同组织中EHP的含量差异及它们间的相互关系还不明确。感染后的对虾仍可以继续存活和进食,但会出现生长缓慢甚至停止生长现象,需要得到足够重视,否则病原的大规模扩散会导致养殖户浪费过多的饲料,造成严重的经济损失[14-16]。
由于EHP的特殊存在方式,目前还没有明确的治疗药物,所以在养殖过程中注意容易感染的环节,通过改善水体,辅助一些维生素、中草药成分,可以起到一定的预防效果[17]。目前关于研究主要集中在氨氮对对虾的急性毒性方面的研究[18-19],关于EHP对对虾的的生长状况的研究较少[20-21],而关于氨氮与EHP之间的关系研究鲜见报道。笔者研究了不同浓度氨氮胁迫对凡纳滨对虾体长和体重的影响,利用实时定量PCR技术分析氨氮胁迫对其EHP携带量的影响,以期为对虾养殖业提供理论依据。
1 材料与方法
1.1材料
1.1.1试验动物。试验用虾取自宁波市海洋与渔业科技创新基地,选取肢体完整、体格相近的凡纳滨对虾为试验虾,体长(4.0±0.5) cm,体重(0.38±0.02)g。试验开始前,将凡纳滨对虾捞出分别放入9个试验容器(600 L圆桶,300尾/桶)中暂养7 d,每天投喂4次(06:00、11:00、16:00、21:00),饵料适量(以2 h内吃净为准)。随着凡纳滨对虾的生长,饲料由0号料变为1号料,饵料量随之增加,投食改为每天3次(06:00、13:00、20:00),每2 d换水1次,换水量为总体积的10%。
1.1.2试剂。DNA提取试剂盒(Tissue DNA Kit)购自Omega公司;FastStart Universal SYBR Green Master(ROX,德国);氯化铵为分析纯试剂(上海生工)。
1.1.3试验用水。用经沙过滤处理的海水作为试验用水,盐度(24±1)‰,水温(25±1)℃,pH为(8.0±0.2),氨氮浓度为0.1 mg/ L,亚硝酸氮浓度为0.003 mg/ L,溶解氧含量为(6.5±0.5)mg/ L,水质符合 NY 5052—2001无公害食品海水养殖用水水质标准(中华人民共和国农业部2001)的要求;在试验用基础水中添加适量的NH4Cl母液,调配成不同浓度的NH4Cl试验水。
1.2方法参考大量文献并经过预试验,设置0.1 mg/L(空白组)、6.0 mg/L(试验组Ⅰ)、9.0 mg/L(试验组Ⅱ)3个氨氮浓度组,每组3个平行,每个平行投放试验对虾300尾,试验期为30 d,试验期间每天投料4次,每天监测养殖水体氨氮浓度,并用NH4Cl母液稳定试验所需的氨氮浓度。
1.2.1对虾体长和体重的测定。将试验对虾投放试验容器前,随机选取100尾对虾进行体长和体重的测定,并统计大虾(体长>4.5 cm)、中虾(体长4.0~4.5 cm)及小虾(体长<4.0 cm)所占的比例,再取肝胰腺置于无水乙醇中-80 ℃下保存,备用;然后,每隔10 d从每个平行组中随机取30尾凡纳滨对虾进行体长和体重的测定,并取肝胰腺置于无水乙醇中-80 ℃下保存,备用;每次采样结束后,记录每个组存活的虾数目,计算不同氨氮浓度下凡纳滨对虾的EHP感染率和存活率;第4次采样后,每组随机取100尾虾测量体长,并统计大虾、中虾及小虾所占的比例。
1.2.2实时定量PCR检测凡纳滨对虾的EHP携带量。
1.2.2.1标准曲线的绘制。取感染EHP的凡纳滨对虾肝胰腺提取的总DNA为模板,用定量用特异引物(引物EHP-F为5′-GACCAACGGAGGCGAAAGCG-3′,EHP-R为5′-CAACGGCCATGCACCACTCTT-3′)进行PCR扩增,将得到的目的片段连接、转化后提取质粒,使用核酸蛋白测定仪(NanoDrop ND-2000,Thermo)测定所提质粒的浓度,将所测浓度的质粒按10倍梯度稀释成13管,并采用实时定量PCR,以含有EHP基因片段的质粒浓度梯度所对应的CT值为纵坐标,以质粒浓度的稀释倍数为横坐标,绘制标准曲线。
1.2.2.2实时定量PCR。采用三步法在ABI 7500上进行实时定量PCR,具体操作参照FastStart Universal SYBR Green Master(ROX,德国)试剂盒说明书。反应体系(20 μL)如下:SYBR Green Realtime PCR Master Mix 10 μL、10 μmol/L EHP-F 1 μL、10 μmol/L EHP-R 1 μL、模板1 μL、ddH2O 7 μL。
将不同样品中EHP基因的表达量所对应的CT值与标准曲线相对照,即可得到该样品目的基因表达量的相对浓度值,最后根据含目的基因的质粒分子量,计算出样品的拷贝数。
2 结果与分析
2.1EHP的标准曲线将含有EHP的质粒原液经10倍梯度稀释后作为模板,进行荧光定量检测。以含有EHP基因片段的质粒浓度梯度所对应的CT值为纵坐标,以质粒浓度的稀释倍数为横坐标,绘制标准曲线。从图1可以看出,线性回归方程R2为0.998 2,线性较好,且经预试验确定样品浓度在曲线区间内。
2.2不同浓度氨氮胁迫对凡纳滨对虾存活率和感染率的影响由图2可知,0~10 d各组EHP感染率上升幅度较大,10~30 d趋于平稳;空白组先于试验组达到100%感染率,氨氮浓度越低,EHP感染率越早达到峰值,表明氨氮对EHP影响有一定的时间-剂量效应。

图1 EHP的标准曲线Fig.1 Standard curve of EHP

图2 氨氮腔迫对凡纳滨对虾EHP感染率的影响Fig.2 Effects of ammonia nitrogen stress on EHP infection rate of L.vannamei
由图3可知,试验结束时,各组凡纳滨对虾的存活率从大到小依次为试验组Ⅱ、空白组、试验组Ⅰ,表明试验组Ⅱ凡纳滨对虾的健康状况优于试验组Ⅰ和空白组。
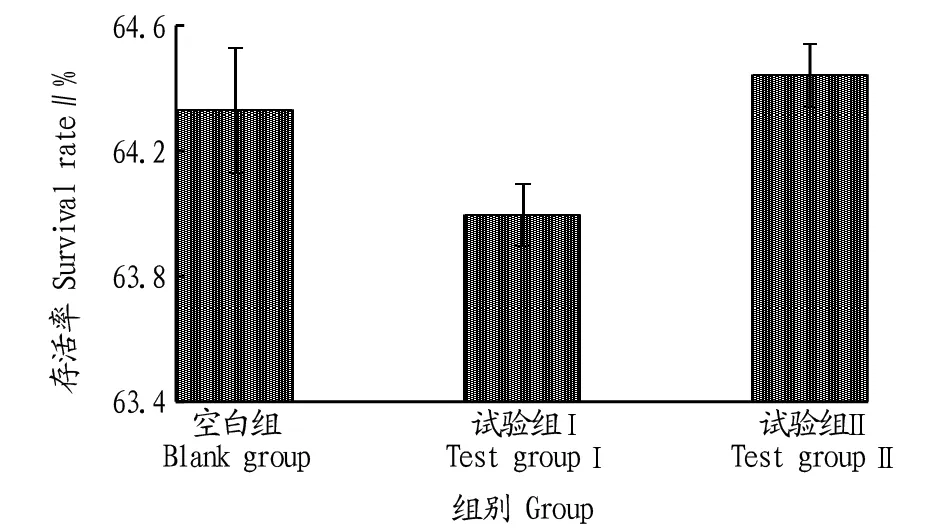
图3 氨氮胁迫对感染EHP凡纳滨对虾存活率的影响Fig.3 Effects of ammonia nitrogen stress on survival rate of L.vannamei infected with EHP
2.3不同浓度氨氮胁迫对凡纳滨对虾体长和体重的影响从图4可以看出,各组凡纳滨对虾的体长变化趋势基本一致,呈现单调递增的趋势,表明9.0 mg/L氨氮对感染EHP凡纳滨对虾的体长增长有一定的促进作用。
从图5可以看出,各组凡纳滨对虾的体重变化趋势基本一致,呈现单调递增的趋势,表明9.0 mg/L氨氮对感染EHP凡纳滨对虾的体重增长有一定的促进作用。

图4 氨氮胁迫对感染EHP凡纳滨对虾体长的影响Fig.4 Effects of ammonia nitrogen stress on body length of L.vannamei infected with EHP

图5 氨氮胁迫对感染EHP凡纳滨对虾体重的影响Fig.5 Effects of ammonia nitrogen stress on body weight of L.vannamei infected with EHP
由表1可知,试验结束后,空白组大虾增长率为9.17%,试验组Ⅰ的大虾增长率为19.29%,试验组Ⅱ的大虾增长率最高(22.65%),且小虾所占的比例下降明显。

表1 0 d和30 d各组不同大小凡纳滨对虾所占比例
2.4不同浓度氨氮胁迫对凡纳滨对虾EHP携带量的影响从图6可以看出,各组EHP携带量的变化趋势基本一致,呈现单调递增的趋势,0~10 d 3组EHP携带量差异不大,10~30 d空白组EHP携带量最高,表明试验组Ⅱ抑制EHP表达的效果优于空白组和试验组Ⅰ。
3 讨论
在养殖水体中,氨氮作为重要的水质因子之一,主要以NH3和NH4+2种形式存在,其中NH3对水生动物的损伤最严重,NH3不带电荷可以穿透水生动物体表进入体内,破坏水生动物的生理机能,能够对其组织器官造成损伤,引发甲壳动物急性中毒症状,对水生动物的健康生长有着重要的影响[22-25]。肝胰腺作为重要的新陈代谢和解毒器官,是对虾在氨氮胁迫下表现最敏感的器官[26]。研究表明,氨氮胁迫会降低虾类的免疫力,增加对病原体的感染率[27-28]。

图6 氨氮胁迫对凡纳滨对虾EHP携带量的影响Fig.6 Effects of ammonia nitrogen stress on EHP carrying capacity of L.vannamei
EHP作为对虾养殖中重要的病原之一,主要侵染对虾的肝胰腺和肠道,能够从宿主细胞获得能量,影响对虾的生长发育。该试验研究了不同浓度氨氮胁迫对感染EHP凡纳滨对虾体重和体长的影响,结果表明试验组Ⅱ凡纳滨对虾体重和体长的增长情况优于试验组Ⅰ和空白组,而试验组Ⅱ凡纳滨对虾的EHP携带量最少。研究表明,EHP的携带量与对虾的体重和体长等指标有一定的相关性,呈现负相关性[29-30];氨氮胁迫影响虾类的生长发育,而肝胰腺是受到损害最主要的器官[31],与EHP侵染的是同一器官。由于EHP进化过程中没有合成ATP 的功能[32],所以其生长繁殖和能量代谢只能利用宿主细胞的ATP,从而影响宿主的能量代谢[33]。氨氮损伤肝胰腺引起其合成ATP功能减弱,EHP在肝胰腺细胞中得不到足够的能量,从而抑制自身的生长甚至死亡,导致凡纳滨对虾EHP携带量减少,延缓EHP的感染率以及提高对虾的存活率。该试验结果表明当氨氮浓度为9.0 mg/L时,凡纳滨对虾的生长状况优于其他2组,EHP携带量少于其他2组,个体较大的凡纳滨对虾 EHP 携带量明显低于较小的个体[33],EHP感染率及存活率也低于其他2组,空白组和试验组Ⅰ除了存活率有明显差异外,其他指标均无明显差异。这说明氨氮在一定浓度范围内可以有效控制EHP的携带量,即当养殖水体氨氮浓度为6.0~9.0 mg/L时,可以有效减少凡纳滨对虾EHP 的携带量,从而为对凡纳滨对虾的养殖提供重要的指导意义。

