粪肠球菌R-WL发酵培养基的优化
胡红伟,麻啸涛,闫凌鹏,陈茹茹,张婵娟,杨京娥,李自茹,党亚鹏,任 帅
(山西大禹生物工程股份有限公司,山西运城 044600)
粪肠球菌(Enterococcus faecalis)是乳酸菌中的一类,属于链球菌科肠球菌属,是革兰氏阳性、过氧化氢酶阴性球菌,链状排列,无芽孢,兼性厌氧(Ben 等,2018;Amachawadi等,2018)。 粪肠球菌是人和动物肠道的一类重要菌群,可参与机体多种代谢活动(Hwanhlem 等,2017;Ba 等,2017)。 粪肠球菌可产生多种肠球菌菌素,对机体健康具有重要意义,另外,在菌种生长代谢过程中产生多种代谢产物,如乳酸、乙酸、过氧化氢和甘露聚糖肽等,乳酸和乙酸可使肠道pH下降,拮抗病原菌的生长繁殖,过氧化氢和甘露聚糖肽等可杀灭大肠杆菌和沙门氏菌等病原菌 (Allameh等,2017;Li等,2017;Chen 等,2017;Song 等,2016)。 粪肠球菌作为益生菌已经在医学和饲料领域得到广泛的应用(Liu 等,2017;Zeng 等,2016;Perumal等,2016)。
制备粪肠球菌高浓菌粉,需要使粪肠球菌菌体密度最大,但是粪肠球菌存在抗逆性差和培养后期自溶的缺点(Silva等,2013),因此,根据菌种生理特性,优化效果最佳的培养条件和增菌培养基,能够改进发酵进程,有效利用培养基中营养成分,获得高密度培养的粪肠球菌菌体,从而降低生产成本(Liu 等,2014;Zhang等,2009)。
本实验室前期从环境中分离得到一株乳酸菌R-WL,经鉴定为粪肠球菌,为实现该粪肠球菌的工业化生产,提高单位体积菌体密度,本研究在MRS培养基基础上,对粪肠球菌的培养条件和培养基成分进行优化,利用单因素试验、Plackett-Burman试验、最陡爬坡试验、Box-Behnken试验和响应面分析法 (Hassani等,2015;Yoo等,2008)优化粪肠球菌 R-WL的培养基成分,旨在提高发酵培养基中单位体积的有效活菌数,实现粪肠球菌的高密度培养,为粪肠球菌活菌制剂的开发奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试菌种 粪肠球菌R-WL,本实验室分离,具有较好的益生特性。
1.1.2 培养基 MRS液体培养基:蛋白胨10 g、牛肉膏10 g、酵母膏5 g、柠檬酸二铵2 g、葡萄糖20 g、乙酸钠 5 g、磷酸氢二钾 2 g、硫酸镁 0.58 g、硫酸锰0.25 g、碳酸钙 3 g、pH 6.8,水 1000 mL。115 ℃高压灭菌20 min;此培养基用于菌种活化复壮。
计数培养基:在MRS液体培养基成分中再加入2%琼脂粉,煮沸后混合均匀,调节pH为6.2,115℃高压灭菌20min,此培养基用于活菌计数。
1.2 试验方法
1.2.1 菌种活化 取冻存甘油管粪肠球菌R-WL,于MRS试管活化24 h,平板计数,挑单菌接入盛有100 mL液体MRS培养基的250 mL锥形瓶中,置于恒温摇床37℃、120 r/min培养18 h,备用。
1.2.2 发酵培养 将活化后的试管菌种按照2%的接种量接入各发酵培养基中,于37℃、160 r/min条件下,培养14 h,检测活菌数。
1.2.3 活菌数含量测定 根据GB/T4789.35-2010《食品卫生微生物学检验食品中乳酸菌》,采用MRS平板菌落计数法,测定菌液中粪肠球菌活菌含量。
1.3 试验设计
好歹他们勤劳的本色不变:杨秋香该忙家务活儿还忙家务活儿,有时她也到超市帮忙干点杂活儿。杨力生该接待往来客户,还是热心地接待往来客户,夫妻二人各尽其责,但就是谁也不肯先理睬谁。
1.3.1 生长曲线建立 取活化好的种子液,1%接种于盛有100 mL液体MRS培养基后,于37℃、160 r/min摇瓶培养,以空白MRS培养基为对照,将菌液用无菌MRS稀释3倍测定初始浓度所对应的吸光值OD600nm,每隔2 h测定一次,至48 h培养结束,以时间(h)为横坐标,OD600nm为纵坐标,绘制生长曲线。
1.3.2 R-WL培养条件优化
1.3.2.1 粪肠球菌R-WL最适生长pH的测定取活化好的种子液,1%接种到40%装液量 (250 mL三角瓶装 100 mL)的不同 pH(pH=5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0) 的 MRS 培养基, 于 37 ℃、160 r/min培养14 h后测定活菌数。
1.3.2.2 粪肠球菌R-WL最适生长温度测定 将MRS培养基调整pH 8.5,然后将粪肠球菌以1%的接种量接种到装液40%的MRS培养基中,分别置于不同温度(T=33、35、37、39、41 ℃)的恒温摇床中,160 r/min培养14 h,测定活菌数。
1.3.2.3 粪肠球菌R-WL最适接种量的测定 选择不同接种量1%、2%、3%、5%、9%,接种到装液量40%的MRS培养基中,调整pH 8.5,培养温度37℃,160 r/min培养14 h,测定培养液活菌数。
1.3.3 发酵培养基优化
1.3.3.2 氮源的筛选 硫酸铵、蛋白胨、豆粕、豆饼粉、花生饼粉、蛋白胨+酵母膏(1∶1),以 10、20、30 g/L浓度替代MRS培养基中复合氮源(蛋白胨、牛肉膏、酵母膏),另设MRS培养基为对照组,250 mL三角瓶装液量100 mL,37℃、160 r/min培养14 h后用MRS培养基计数,做两个平行。
1.4 Plackett-Burman设计法筛选显著影响因素Plackett-Burman试验设计法通过分析每个影响因素的两个水平,比较两水平的差异和整体的差异,从而确定每个因素的显著性,达到快速准确筛选出主效因素的目的;根据培养基筛选出的最适碳源、氮源、无机盐后,进行Plackett-Burman试验。选取最佳碳源、最佳氮源、柠檬酸二铵、结晶乙酸钠、柠檬酸氢二钾、无水硫酸镁和硫酸锰进行Plackett-Burman试验,以筛选影响粪肠球菌发酵活菌数的3个显著影响因子。
1.5 Box-Behnken试验设计 根据Box-Behnken试验设计模块,每个显著性因素取3个水平,以粪肠球菌R-WL活菌数对数值为响应值,设计3因素3水平共15个试验点的响应面试验,分析各因素的主效应和交互效应,绘制等高线和响应曲面,在一定范围内求出最佳值,得出最佳培养基配方。
1.6 数据统计与分析 试验结果均以 “平均数±标准差”的形式表示,利用SAS 9.3软件对试验数据进行单因子方差分析(one-way ANOVA,LSD),P<0.05和P<0.01为数据在统计学上差异显著。试验作图采用Origin 9.0完成。
2 结果与分析
2.1 粪肠球菌的生长曲线 根据所测菌液OD600值绘制粪肠球菌R-WL的生长曲线 (图1),可以看到0~2 h菌体浓度上升较缓和,这是菌种进入新环境的适应阶段,为该菌种的延滞期;2~14 h粪肠球菌菌体浓度快速生长至最高峰,该时期曲线基本接近直线,说明该时期是粪肠球菌生长最快的时期,为其对数生长期;14 h之后,菌液浓度变化比较稳定,说明此时粪肠球菌进入生长稳定期,选取14 h为该菌种最适培养时间。

图1 粪肠球菌R-WL生长曲线
2.2 培养条件优化
2.2.1 粪肠球菌R-WL最适生长pH的测定 菌种R-WL在不同pH培养基中的活菌数见图2,初始pH为7.5、8、8.5和9.0时,活菌数较高,各组间差异不显著(P>0.05),与其他pH组差异极显著(P<0.01),活菌数最高的pH为8.5,最终菌体浓度为3.8×109cfu/mL,说明随着培养基初始pH的升高,菌种后期所产乳酸的中和能力增强,减轻了乳酸对菌体的毒害作用,因此,确定该粪肠球菌最适pH为8.5。

图2 不同初始pH对粪肠球菌R-WL活菌数的影响
2.2.2 粪肠球菌R-WL最适生长温度的测定 由图3可知,不同温度之间最终活菌数差异不显著(P>0.05),说明菌株R-WL在37~41℃具有较强的适应性,随着温度升高,活菌数先升高后下降,温度在37℃时,菌种R-WL活菌数最高,达到3.96×109cfu/mL,说明温度对菌种的生长具有一定影响,该菌种在温度为37℃时,菌种的代谢最为旺盛,对营养物质利用率提高,进而提高最终活菌数。因此,确定粪肠球菌R-WL最适温度为37℃。

图3 不同培养温度对粪肠球菌R-WL活菌数的影响
2.2.3 粪肠球菌R-WL最适接种量的测定 由图4可知,不同接种量之间活菌数在P=0.01水平上差异不显著,随着接种量的增加,粪肠球菌RWL活菌数先升高后下降,在3%接种量时,活菌数达到最大值,为3.36×109cfu/mL,与1%接种量活菌数差异不显著(P>0.05),但活菌数显著高于其他各组(P<0.05),原因可能是,随着接种量的增加,缩短了菌种R-WL的延滞期,促进了菌种迅速进入对数期,但随着接种量超过5%以后,由于初始接种量过大,带入较多菌种次级代谢产物,反而抑制了菌种的生长,因此,综合考虑,选取3%为最适接种量。
2.3 发酵培养基优化
2.3.1 碳源筛选试验 由图5可知,乳糖做碳源时,与玉米粉、麸皮、糖蜜、蔗糖及可溶性淀粉各组活菌数差异极显著(P<0.01),与对照组(葡萄糖)差异不显著(P>0.05),乳糖各浓度之间活菌数差异不显著(P>0.05),以麸皮和可溶性淀粉做碳源时,活菌数显著小于其他各组(P<0.05);说明菌种R-WL能较好利用葡萄糖或乳糖,对麸皮和可溶性淀粉中的多糖较难利用,根据活菌数情况,选择最适碳源为乳糖,最适浓度为10 g/L。

图4 不同接种量对粪肠球菌R-WL活菌数的影响

图5 不同碳源及其浓度对粪肠球菌R-WL活菌数的影响
2.3.2 氮源筛选试验 由图6可知,对照组、蛋白胨组及蛋白胨+酵母膏组活菌数大于豆饼粉组、豆粕组、花生饼粉组及硫酸铵组,蛋白胨+酵母膏组、蛋白胨组最高活菌数为3.40×109cfu/mL及3.21×109cfu/mL,豆饼粉、豆粕、花生饼粉及硫酸铵组活菌数最高分别为 0.43×109、0.38×109、0.64×109、0.07×109cfu/mL, 极显著低于蛋白胨+酵母膏组、蛋白胨组和对照组(P<0.01);说明菌株R-WL对动物性氮源利用较充分,对植物性氮源及无机氮源的利用效果较差,动物性有机氮源中含有粪肠球菌R-WL生长所需氨基酸等物质,植物性氮源的氨基酸组成与菌株R-WL的生长需求不一致,无机氮源需要经微生物代谢转化才能合成菌株所需氨基酸;蛋白胨+酵母膏组活菌数高于其他各组,与对照组差异不显著(P>0.05),选取蛋白胨+酵母膏为最适氮源,最适浓度为30 g/L。

图6 不同氮源及其浓度对粪肠球菌R-WL活菌数的影响
2.4 Plackett-Burman试验结果 根据以上单因素试验结果,将筛选到的最佳碳源乳糖、最佳氮源酵母膏+蛋白胨代替MRS培养基中的葡萄糖、复合氮源作为优化培养基的成分,并将乳糖、酵母膏、蛋白胨、乙酸钠、柠檬酸二铵、磷酸氢二钾、硫酸镁、硫酸锰、碳酸钙共9个因子作为Plackett-Burman试验设计的基本因素,另设2个虚拟变量估计试验误差,各因子取高低2个水平,响应值为单位体积粪肠球菌活菌数的对数值(Y),试验设计见表1,其中F与L为虚拟项,试验结果见表2。对试验结果进行统计分析,可得各因子的效应及其显著性(表3),由表3可知,在粪肠球菌R-WL培养过程中,在α=0.1水平上,蛋白胨、乙酸钠、柠檬酸二铵对粪肠球菌R-WL活菌数的对数值影响显著,其中柠檬酸二铵为正效应,蛋白胨和乙酸钠为负效应,因此将这3个因子做Box-Behnken试验。

表1 Plackett-Burman试验设计

表2 Plackett-Burman试验结果
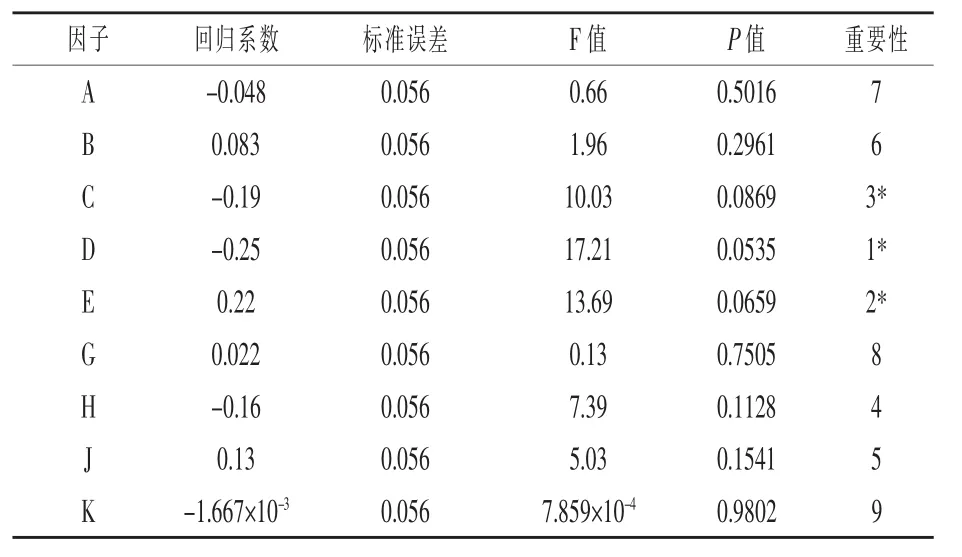
表3 Plackett-Burman试验设计各因子效应及显著性
2.5 最陡爬坡试验及结果 根据Plackett-Burman试验筛选结果,选取蛋白胨、乙酸钠、柠檬酸铵为三个显著性因子进行最陡爬坡试验以获取活菌数最高的区域,根据各因子的系数及实际情况,设置4个梯度,结果如表4所示,梯度0+2Δ所对应的活菌数最高,故采用蛋白胨11 g/L、乙酸钠4 g/L、柠檬酸二铵4 g/L为后续响应面试验的中心点。

表4 最陡爬坡试验结果
2.6 响应面设计确定显著影响因素的最佳值采用Box-Behnken试验设计,对蛋白胨、乙酸钠、柠檬酸二铵的浓度配比进行优化,以活菌数的对数值为响应值,各因子设置3个水平(见表5),优化结果如表6所示。

表5 Box-Behnken试验因素水平及其编码

表6 Box-Behnken试验设计及结果
根据Box-Benhnken试验结果,采用Design Expert 8.06软件响应面分析程序对其进行回归拟合,得到二次多元回归模型为:Y=9.77+0.040A+0.037B+0.01C+0.01AC+0.01BC-0.042A2-0.017B2-0.013C2(Y为活菌数对数预测值,A、B、C分别代表蛋白胨、乙酸钠和柠檬酸二铵),对所得回归方程进行方差分析 (表7),可知:模型P值为0.0042,回归项极显著(P<0.01),表明本模型是有效的;失拟项P值为0.2301,失拟项不显著(P>0.05),表明本模型不存在失拟现象;试验的精确度以变异系数(CV)表示,CV值越低,试验可靠性越强,本试验CV值为0.16%(表8),说明试验结果可信,R2Adj为89.88%,表明响应面89.88%的变化可以用此回归模型进行解释,该模型与实际变化拟合较好,可用于粪肠球菌R-WL培养基优化的预测。

表7 回归拟合方程方差分析

表8 模型可信度分析
利用Design Expert 8.06软件对回归模型进行响应面分析,绘制活菌数对数值的等高线和曲面图(图7~图9),等高线图的圆心越接近椭圆表示交互作用越强,等高线的稀疏表示响应面图形的平陡。从3组图中可以直观看出活菌数对数值存在最大响应值,利用Design Expert 8.06软件的Optimization模块,对响应值求极值,得出蛋白胨、乙酸钠、柠檬酸二铵添加量分别为12.18、4.5、4.5 g/L时,粪肠球菌R-WL的活菌数对数值存在最大值9.81221,所对应的活菌数为6.46×109cfu/mL。

图7 蛋白胨和乙酸钠交互影响对粪肠球菌RWL活菌数的等高线和曲面图

图8蛋白胨和柠檬酸二铵交互影响对粪肠球菌R-WL活菌数的等高线和曲面图

图9乙酸钠和柠檬酸二铵交互影响对粪肠球菌R-WL活菌数的等高线和曲面图
2.7 最优配方验证 为了检验模型的可靠性,将优化后的培养基与原培养基(MRS培养基),在相同条件下进行5次摇瓶发酵试验。试验结果见图10,优化后培养基与MRS培养基所得活菌数分别为(6.44±0.10)×109cfu/mL 和(3.76±0.17)×109cfu/mL,优化后结果与预测值接近,可见模型能较好预测发酵液活菌数。

图10 优化前后培养基活菌数变化
3 讨论
3.1 培养条件优化 乳酸菌培养过程中,利用培养基中的糖类发酵为乳酸,粪肠球菌培养后期,乳酸大量积累,对菌体的生长产生抑制作用,为减轻培养过程中高酸环境对菌体的毒害,经常在培养过程中加入碱性物质中和。许多研究表明,添加中和剂是提高乳酸菌活菌数的一个有效手段(闵伟红等,2009;张广敏等,2009)。 本研究通过调节初始pH来研究粪肠球菌R-WL活菌数的变化,发现随着pH升高活菌数升高,到一定程度开始下降,原因可能是较高的pH能中和发酵过程中更多的有机酸,有利于菌种的生长。
温度是微生物生长过程中的一个重要影响因素,改变温度会影响微生物体内所进行的多种化学反应(Lopes等,2018)。本试验在33~41℃,对培养粪肠球菌R-WL活菌数的变化进行了研究,虽然各组活菌数差异不显著(P>0.05),随着温度升高,活菌数有先上升后下降趋势,与刘香英等(2018)的研究结果一致。温度过高或过低可能会出现菌种R-WL生物合成量过低及生长延长等不良现象,微生物代谢的蛋白酶、淀粉酶等酶制剂活力受温度影响,适宜的温度能促进酶活力的发挥,有效利用营养物质,从而促进菌体密度的提高。
3.2 发酵培养基优化 碳源是微生物生长所需的重要营养要素,也是微生物细胞结构或代谢产物中碳来源的营养物质(岑沛霖等,2011),不同微生物利用碳源的能力不同。本试验研究了乳糖、蔗糖、葡萄糖、可溶性淀粉、糖蜜、玉米粉和麸皮作为碳源时对菌种R-WL生长的影响,发现乳糖、葡萄糖对菌种的促生长效果较好,麸皮、可溶性淀粉、玉米粉的效果较差,原因可能是菌种RWL对单糖和双糖利用较快,而麸皮、淀粉和玉米粉等多糖需要微生物产淀粉酶分解为二糖或单糖进行利用,菌种R-WL产酶能力较差导致对多糖的利用不充分,菌种生长受到抑制。
氮是组成核酸和蛋白质的重要元素,其对微生物的生长发育有着重要作用。不同微生物能利用的氮源差异较大。本试验分别研究了6种氮源对菌种R-WL的促生长效果,结果表明,蛋白胨+酵母膏组的活菌数最高,这与Djellouli等(2017)与 Kwon等(2000)研究结果相似。 蛋白胨、酵母膏中的氮以氨基酸形式存在,氨基酸可以被微生物直接吸收参与细胞代谢,而豆粕、豆饼粉、花生饼粉以蛋白质形式存在,需要分解为氨基酸才能利用,粪肠球菌为异氧型微生物,对硫酸铵中的无机氮无法利用,可能是菌株R-WL在豆粕、豆饼粉、花生饼粉及硫酸铵中活菌数较低的原因。
3.3 响应面试验 响应面法(RSM),也称响应曲面法,是通过对应曲面及等高线的分析寻求最优工艺参数,用多元二次回归方程来拟合响应值与因素之间函数关系的一种优化统计方法(Montgomery 等,2009;Box,1990)。 试验证明,Plackett-Burman设计与响应面方法(RSM)相结合的试验统计方法能快速、有效地影响粪肠球菌R-WL液体培养的因素,并将显著性因素进行建模分析,得到最佳工艺参数。
4 结论
本试验结果表明,粪肠球菌R-WL最适培养条件为:时间14 h、pH 8.5、温度37℃、接种量3%、最佳碳源为乳糖、最佳氮源为蛋白胨+酵母膏。优化后的培养基配方为:乳糖10 g/L、酵母膏15 g/L、蛋白胨 12.18 g/L、乙酸钠 4.5 g/L、柠檬酸二铵4.5 g/L、硫酸镁0.58 g/L、硫酸锰0.25 g/L、磷酸氢二钾2 g/L、轻质碳酸钙3 g/L,初始pH 8.5。将此优化后培养基与原MRS培养基在最适培养条件下进行培养,所得活菌数分别为(6.44±0.10)×109cfu/mL 和(3.76±0.17)×109cfu/mL,比优化前活菌数提高了71.28%。

