低温等离子放电与催化剂结合方式对生物油提质的影响
樊永胜 王佳伟 朱 雷 樊乐乐 赵卫东 纪 玮
(1.盐城工学院汽车工程学院, 盐城 224051; 2.盐城工学院江苏省新型环保重点实验室, 盐城 224051;3.江苏大学汽车与交通工程学院, 镇江 212013)
0 引言
生物油是由生物质进行热解液化而制得,具有存储运输方便、能量密度高和环境友好等优势,但较低的燃料品质严重阻碍了其进一步利用[1]。目前,利用酸性择形分子筛进行生物油催化裂解被认为是最具发展前景的技术路线之一[2]。HZSM-5分子筛具有独特的酸性分布和孔道结构,可使生物油中含氧有机物发生裂解、脱氧、重整等反应,生成脂肪烃和芳香烃等产物[3]。但在催化裂解过程中,催化剂易结焦失活,并且多环芳香烃含量较高[4-5]。为提高催化剂对轻质烃类的选择性,本课题组已对HZSM-5进行了Fe、Co、Cu、Zn、Ti和P改性研究[6-7]。结果发现,Ti改性可明显提高催化剂对轻质烃类的选择性,延缓催化剂的结焦失活,在各种改性分子筛中表现较好,但所得精制生物油产率明显下降;同时,Ti改性延缓催化剂结焦失活的程度相对有限,这也是生物油催化裂解研究中普遍存在的问题[7-9]。因此,为进一步增强生物油提质的转化效率,需引入一种高效的助催化技术。
等离子体是物质存在的第四种状态,以温度为标准,将等离子体分为高温等离子体和低温等离子体,低温等离子体中各物质未达到热力学平衡,电子温度高达104~105K,平均能量达1~10 eV,可活化和解离绝大多数分子,并且能量可通过与分子之间的非弹性碰撞传递给反应物分子、高效活化分子[10]。将低温等离子体技术与催化过程相结合,通过电场直接向反应物化学键输入能量,激发分子引发化学反应,同时催化剂活性中心对反应方向起到诱导作用,可分别发挥等离子体高效活化的优势和催化剂高选择性的特点[11]。
目前,等离子体技术常被用来使一些在常规条件下难以进行的反应得以进行或加速进行,如CH4重整偶联[12]、CO2还原[13]、NO分解[14]、VOCs降解[15]等反应过程。而将低温等离子体技术应用于生物油催化提质方面的研究报道较少见,本课题组在前期已经进行了一些探索。根据结合方式,可将有等离子体参与的催化反应分为等离子体协同催化(Plasma synergistic catalysis, PSC)和等离子体增强催化(Plasma enhanced catalysis, PEC)两种方法[16]。本文拟在PSC方法下分析HZSM-5和Ti/HZSM-5的催化提质性能,以及在Ti/HZSM-5催化的基础上,研究PSC和PEC方法的优劣,以期为生物油高效提质技术的开发和应用奠定基础。
1 实验材料与方法
1.1 生物质原料
实验原料樟木木屑收集自江苏省镇江市,将在自然条件下风干的生物质原料粉碎成粒径为1~3 mm的颗粒试样。实验前,将试样在恒温干燥箱中于105℃干燥24 h后保存备用。试样的工业分析、元素分析及高位热值(Higher heating value, HHV)如表1所示,其中O元素质量分数利用差减法测量。

表1 樟木木屑的工业分析、元素分析和高位热值Tab.1 Proximate and ultimate analysis of camphorwood and its high heating value
1.2 催化剂制备及表征
HZSM-5原粉购置于天津南化催化剂厂,硅铝物质的量比为50。Ti/HZSM-5的制备方法:将HZSM-5原粉在550℃煅烧2 h后,浸渍到一定量的TiCl3溶液中,使用集热式磁石搅拌器于80℃恒温搅拌4 h,然后经充分过滤和洗涤后,移入干燥箱中于105℃干燥4 h,最后将干燥后的催化剂置于马弗炉中以550℃高温焙烧4 h,得到Ti/HZSM-5,负载量控制在3%左右。
采用JSM-7001F型场发射扫描电子显微镜(Scanning electron microscope, SEM)配合X射线微区能谱分析仪(Energy dispersive spectrometer, EDS)检测催化剂微区表面负载元素分布;采用Builder SSA4300型比表面积分析仪测定催化剂的比表面积和孔容(单位质量催化剂微孔容积),由Brunner-Emmet-Teller (BET)模型求得比表面积,并由Barrett-Joyner-Halenda (BJH)模型计算孔容。采用Frontier型红外光谱仪配合真空吸附脱附系统测定催化剂的B酸(质子酸)和L酸(非质子酸)分布,将一定量的样品压成半透明自支撑圆片,并将样品片放入石英吸收池中,并与真空系统相连。程序升温至350℃,同时抽真空(0.02 Pa)处理样品1 h,降至室温(20℃),摄谱得样品骨架谱图;然后,在室温下吸附饱和吡啶蒸气0.5 h,摄谱得样品吸附吡啶谱图;最后,程序升温至200℃,脱附0.5 h,降至室温,摄谱得样品脱附吡啶红外谱图。同时,根据经验公式半定量计算B酸和L酸的酸量[17],公式为
CB=1.88ABr2/W
(1)
CL=1.42ALr2/W
(2)
式中CB、CL——样品B酸、L酸质量摩尔浓度,mmol/g
AB、AL——B酸、L酸吸收峰积分面积,cm-1
r——样品圆片的半径,cm
W——样品圆片的质量,mg
1.3 实验系统及方法
基于介质阻挡放电(Dielectric barrier discharge, DBD)原理,设计了等离子体与催化剂不同组合催化反应器,如图1所示。两反应器的不同点在于催化剂是否置于等离子体放电区:PSC反应器放电区与催化剂层重合,而PEC反应器中放电区前置,由于放电区与催化剂层串联布置,因此PEC反应器的高度大于PSC反应器,其他结构两反应器则完全一致,具体的结构参数参照文献[18]。
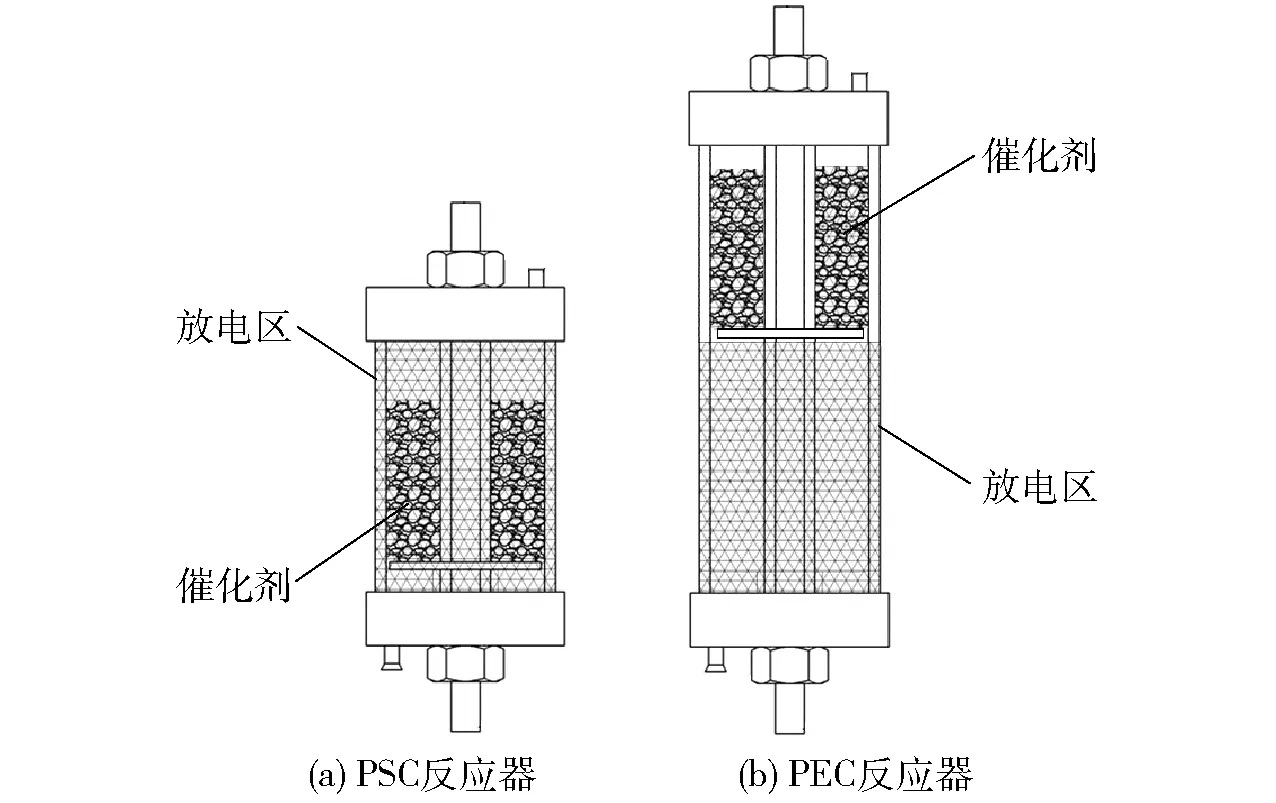
图1 PSC与PEC反应器结构示意图Fig.1 Schematic diagrams of PSC and PEC reactors
生物油在线提质实验系统如图2所示。实验时,PSC反应器和PEC反应器分别布置于催化区。系统的放电功率采用Lissajous图形法测量,测量回路是由C1、C2组成的容性分压电路、取样电容Cm和示波器构成[19]。生物质热解反应器与催化反应器呈两段式布置,热解反应器位于下段。两反应器连接处采用石棉垫片以保证气密性,并起到隔热作用。生物质热解温度与催化温度均采用反馈控制,分别以两反应器中心盲管内的测温为反馈信号,实时控制加热电流通断,对两反应器进行加热,由于存在热滞后效应,温度在反应器径向分布上存在一定的梯度,测温与控温存在±3℃的误差。实验时,体系内部在真空泵的作用下处于负压状态,通过调压阀调节体系压力,并利用压力表实时监测体系内部压力。
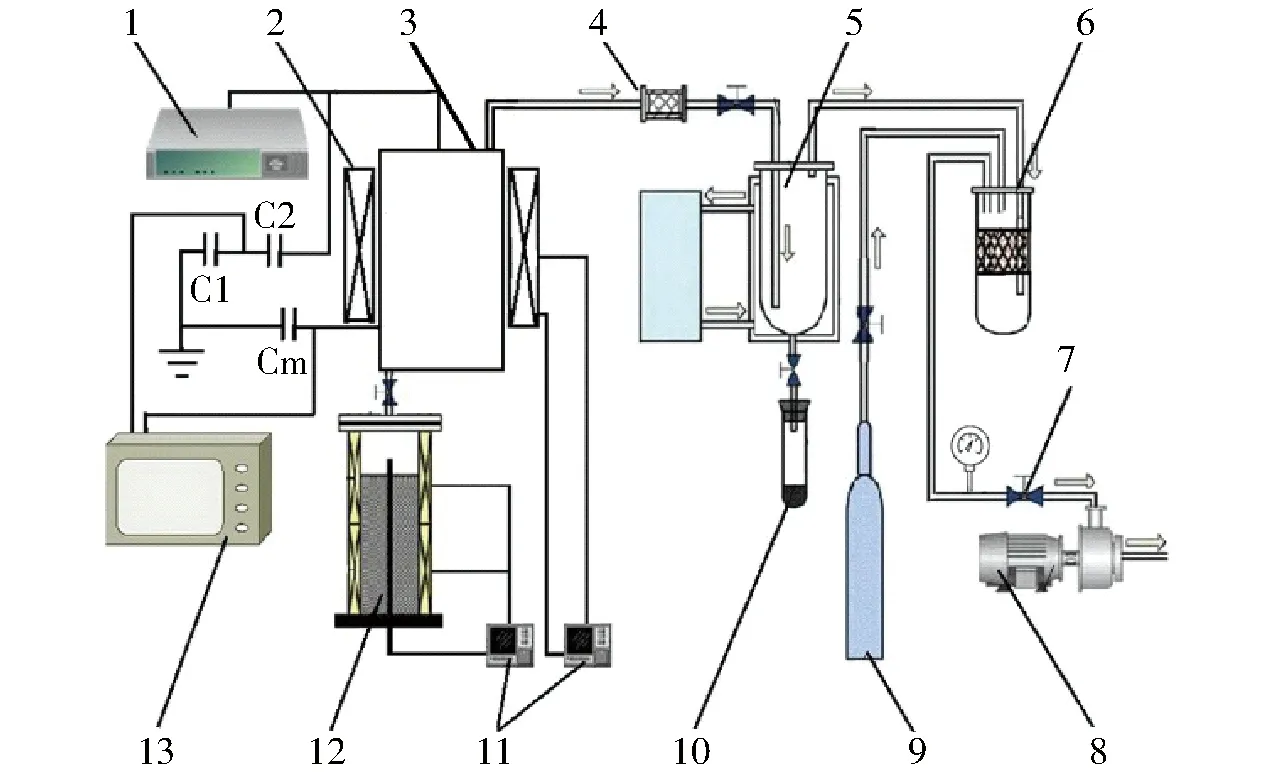
图2 生物油在线提质实验系统Fig.2 Experimental system of bio-oil online upgrading 1.等离子体电源 2.加热套 3.催化区 4.过滤器 5.冷却塔6.稳压筒 7.调压阀 8.真空泵 9.氮气瓶 10.生物油收集器 11.控制器 12.热解反应器 13.示波器
文献[20]表明,当催化温度为400℃,体系压力为5 kPa,催化床层高度为30 mm,催化剂粒径为4 mm,放电功率为25 W时,放电性能较优且较稳定。本研究中对于两反应器采用相同条件以保持一致性。而对于生物质热解,当热解温度为474℃,升温速率为20℃/min,体系压力为5 kPa时,生物油产率较高[21]。本研究也采用相同的热解条件。当催化反应器达到目标温度,加载电源进行放电;生物质热解开始,热解气经催化提质后被迅速抽出,经充分冷却(-10℃)后冷凝得到液相产物。实验完毕,停止放电,关闭真空泵和调压阀,打开氮气瓶通入一定量的氮气,确保产物、催化剂等不与空气发生接触反应。待系统冷却至室温后,停止通入氮气,移除收集器进行称量。液相产物上层为油相,下层为水相。利用二氯甲烷(CH2Cl2)萃取分离油相产物及水相中的多数有机物;并清洗萃取收集装置及管路中黏附的油相,40℃水浴蒸发去除CH2Cl2,即得精制生物油。采用HZSM-5、HZSM-5(PSC)、Ti/HZSM-5(PSC)和Ti/HZSM-5(PEC)催化所得的精制生物油分别标记为RB-Ⅰ、RB-Ⅱ、RB-Ⅲ和RB-Ⅳ。以原料质量为基准,计算固相、液相及生物油产率,并由质量平衡,得到气相产率。
1.4 生物油及催化剂分析方法
采用EA3000型元素分析仪测定精制生物油的元素组成;采用比重管法测定其密度(参照GB/T 2540—1981);采用PHS-3型数字pH计测定其酸性(参照GB/T 11165—2005);采用毛细管黏度计法测定其运动黏度(参照GB/T 265—1988);采用ZDHW-5G型氧弹式量热仪测定其高位热值(参照GB/T 213—2003)。
采用Agilent 7890A/5975型气质联用分析仪测定精制生物油的化学组成。气相条件:采用HP-5型毛细管柱,载气为He,流量为1 mL/min,进样口温度为250℃,分流比10∶1,进样量1 μL。质谱条件:离子源温度为250℃,传输线温度为250℃,电离方式为EI,轰击能量为70 eV,扫描范围为30~500(质荷比),扫描时间为1 s。升温程序:40℃保持2 min,以15℃/min升至100℃,然后以8℃/min升至280℃保持2 min,设置溶剂延迟时间为3 min。
采用TGA/DSC 1型同步热分析仪对使用相同时间的催化剂进行结焦率测量分析。试样质量为10 mg,载气为空气,流量为50 mL/min,以10℃/min将试样从40℃加热到800℃,对实验过程进行热重(Thermo-gravimetric, TG)和热重微分(Differential thermo-gravimetric, DTG)测量。
2 结果与分析
2.1 催化剂表征结果
利用SEM(EDS)检测Ti/HZSM-5表面微区,其SEM扫描照片及表面元素能谱如图3a、3b所示。由图3b可见,在Ti/HZSM-5上分别检测到了Ti元素的特征X射线(L层电子跃迁至K层产生的射线能量Kα=4.513 keV,M层电子跃迁至K层产生的射线能量Kβ=4.931 keV,M层电子跃迁至L层的射线能量Lα=0.534 keV),表明金属元素的负载改性效果较为理想。经测定,HZSM-5原粉比表面积为240.12 m2/g,孔容为0.23 cm3/g;经Ti改性后,由于改性成分对孔道及表面的修饰作用,催化剂的比表面积和孔容均有不同程度的降低,其中比表面积下降较明显,为220.40 m2/g,孔容稍有下降,为0.21 cm3/g。HZSM-5及Ti/HZSM-5的吡啶红外谱图如图3c所示,波数在1 450 cm-1附近的吸收峰表示L酸中心,1 545 cm-1附近的吸收峰表示B酸中心,1 490 cm-1附近的吸收峰代表B酸+L酸中心;半定量计算结果表明,Ti改性使分子筛上B酸质量摩尔浓度由0.141 8 mmol/g升高至0.154 1 mmol/g,L酸质量摩尔浓度由0.033 6 mmol/g降低至0.024 0 mmol/g,L酸与B酸的物质的量比由0.24降低至0.16。
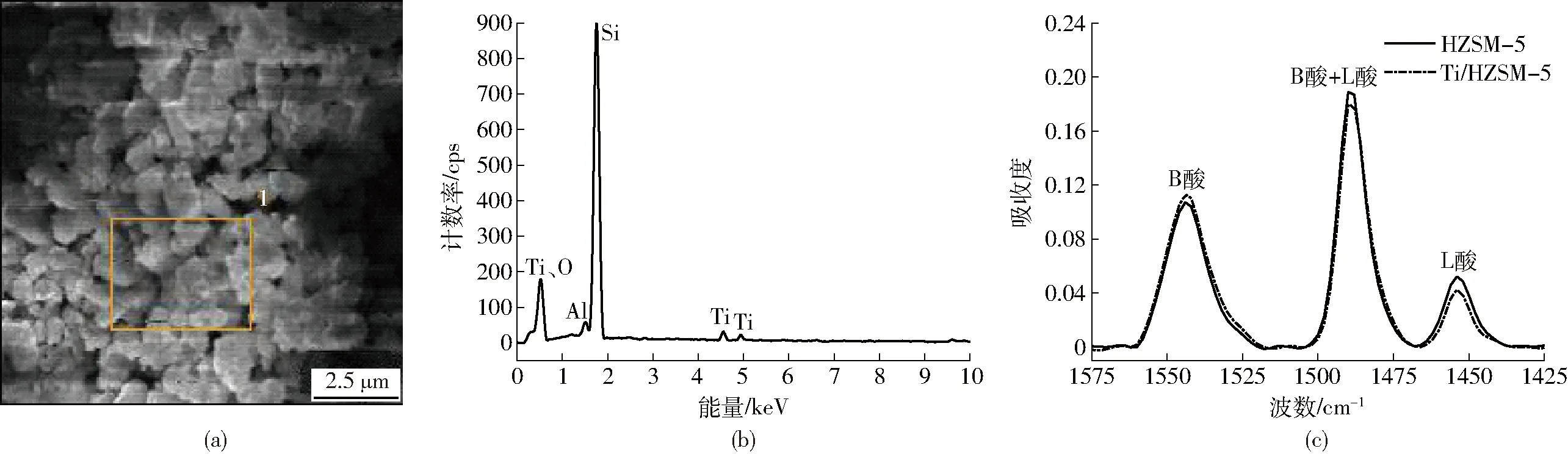
图3 催化剂表征分析结果Fig.3 Results of catalyst characterizations
2.2 产物产率分析
不同催化方法对产物产率的影响如表2所示,其中气相质量分数采用差减法测量。由表2可见,随着PSC方法及Ti元素的引入,催化过程对生物质热解气的裂解作用明显加强,液相及生物油产率下降,气相产率显著升高。HZSM-5、HZSM-5(PSC)、Ti/HZSM-5(PSC)催化所得精制生物油占液相产物质量分数分别为53.88%、52.41%和48.64%,呈逐渐降低趋势,尽管有萃取不完全的因素,但生物油的占比降低确是一种趋势,表明裂解作用加深使更多的有机物参与催化反应,部分氧元素以水的形式脱除,虽然氢元素也随之被剔除了一部分,但同时又有部分氧元素被以碳氧化物的形式脱除,因此,精制生物油中氧含量应明显降低,燃料品位得到进一步提升。当采用Ti/HZSM-5(PEC)方法后,所得液相及生物油产率进一步降低,气相产率升高,因为随着放电区与催化层的分离,反应物先被放电活化,而该过程也在一定程度上起着裂解作用,被活化的反应物再经过Ti/HZSM-5的择形催化,催化提质的反应路径变长,有更多的有机蒸气发生二次裂解,造成了可冷凝的有机蒸气减少,使液相及生物油产率降低,气相产率升高。

表2 不同催化方法对产物产率的影响Tab.2 Effects of different methods on product yields %
2.3 理化特性分析
不同催化方法所得精制生物油的理化特性如表3所示,其中O质量分数采用差减法测量。由表3可见,当采用HZSM-5(PSC)方法时,所得精制生物油RB-Ⅱ的含氧量较RB-Ⅰ进一步降低,但理化性质却有所恶化,如运动黏度稍有升高,其它理化性质的提升或改善幅度较为有限,这与产物含氢量的明显降低有关,尽管RB-Ⅱ中烃类含量得到明显提升,但从元素组成角度推测,其中低氢碳比的烃类明显增加。当采用Ti/HZSM-5(PSC)方法时,精制生物油含氧量降幅有限,但有效氢碳比(以H2O的形式去除全部氧元素后,剩余氢与碳的物质的量比)[22]有明显升高,理化性质的改善也较明显,表明此时催化过程对生物油具有较好的重整和选择性,多环芳香烃(Polycyclic aromatic hydrocarbons, PAHs)等减少。当采用Ti/HZSM-5(PEC)方法时,精制生物油含氧量稍有降低,有效氢碳比较RB-Ⅲ又有所下降,PAHs等低氢碳比产物增加,使运动黏度升高、高位热值下降,表明随着放电解离作用与择形催化作用的分离,在部分提升裂解脱氧能力的同时,降低了催化剂的活性,同时使更多的反应物或反应产物发生了二次裂解,而相对稳定的含苯环化合物,则被相对多地保留,包括单环芳香烃(Monocyclic aromatic hydrocarbons, MAHs)、PAHs、酚类等,在冷凝过程中,低有效氢碳比会使反应产物发生缩聚形成更多的PAHs,导致BF-Ⅳ理化性能恶化。

表3 不同催化方法所得精制生物油的理化特性Tab.3 Physiochemical properties of refined bio-oils by different methods
2.4 化学组成分析
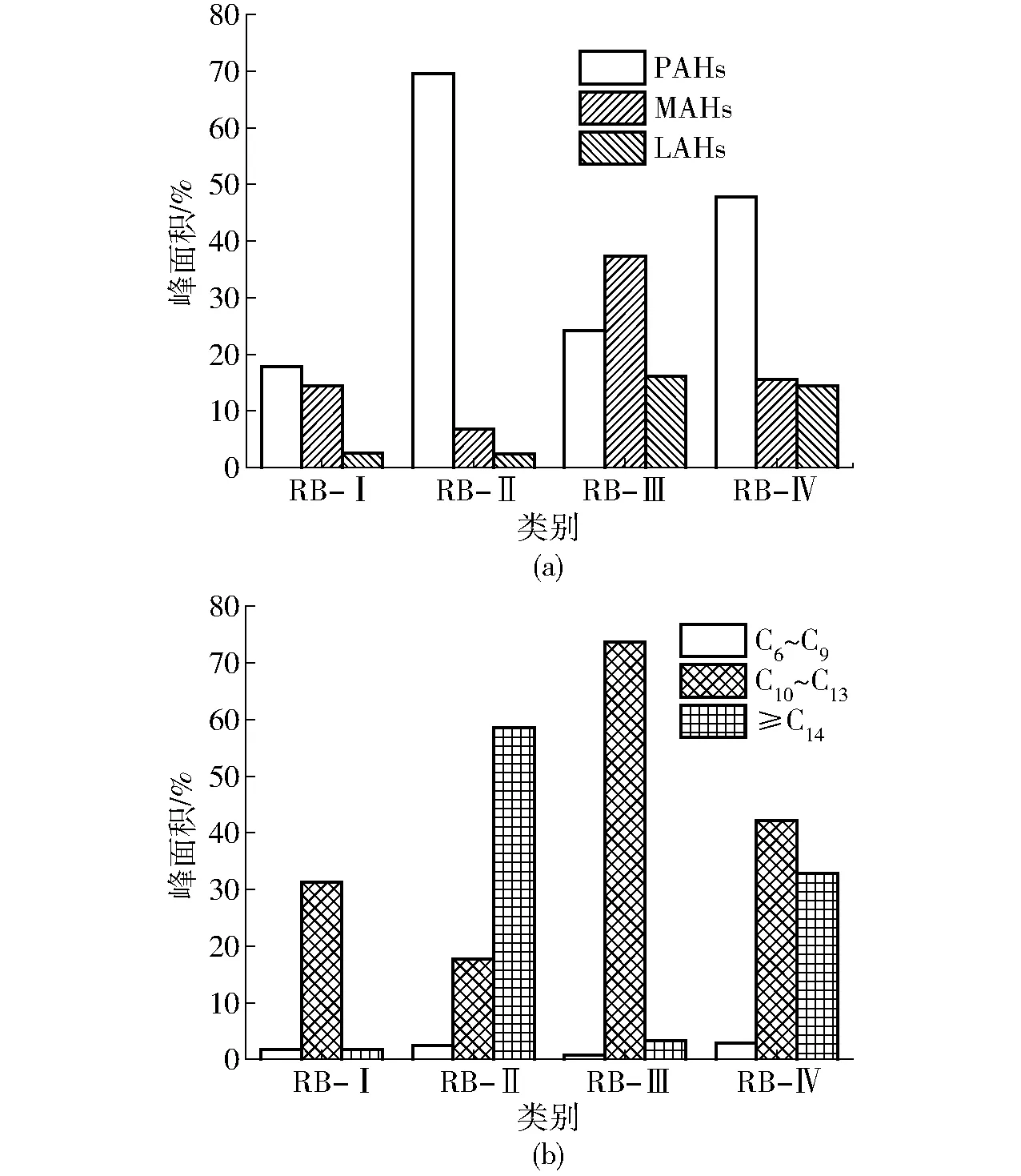
图4 不同催化方法对精制生物油中烃类含量 及其碳原子分布的影响Fig.4 Effects of different methods on hydrocarbon contents and carbon atom distribution in refined bio-oils
不同催化方法对精制生物油中烃类含量及其碳原子分布的影响如图4所示。由图4a可见,与RB-Ⅰ相比,RB-Ⅱ中烃类含量大幅升高,但PAHs占比较高,这解释了RF-Ⅱ理化性质有所恶化的原因。当采用HZSM-5(PSC)方法时,芳构化过程中氢转移反应的瓶颈效应得到缓解,高能放电可高效解离反应物,为芳构化过程提供更多的碳正离子;同时,放电区与催化剂层重叠,放电方式将由单一的气相放电转变为在催化剂上的表面放电和气相放电两种方式,等离子体与催化剂之间通过表面放电而产生协同作用,有利于提高催化剂位点反应活性,使芳构化性能增强。当采用Ti/HZSM-5(PSC)方法时,所得RB-Ⅲ的烃类总量稍有降低,但组成明显改善,PAHs占比降低,MAHs和轻质脂肪烃(Light aliphatic hydrocarbons, LAHs)相对含量明显升高,两者约占烃类组成的68.89%。Ti改性使B酸与L酸的物质的量比升高,同时,Ti离子较高的价态和较小的半径使其具有较强的极化能力,可显著提高催化剂对轻质烃类的选择性。Ti在催化过程中会发生价态变化,该过程的电子迁移有利于促进碳正离子反应的进行[23-24]。而放电作用有利于加速该过程。当采用Ti/HZSM-5(PEC)方法时,所得RB-Ⅳ的烃类总量与RB-Ⅲ相比变化较小,但期望产物的比例明显降低。当高能放电区与催化剂层分离时,放电产生的等离子体对催化剂表面的冲击作用减弱,降低了反应物/产物在催化剂上的吸附/解吸速率,提高了缩聚的可能性。
从烃类的碳原子分布角度进行分析,结果如图4b所示。根据精制生物油烃类的实际组成及PAHs的最少碳原子数,将烃类的碳数组成归为3类,以C10和C14为分界点。由图4b可见,尽管RB-Ⅰ中PAHs占烃类的相对含量超过50%,但C14以上的烃类化合物含量较少,表明BF-Ⅰ中的PAHs分子量并不高,以两环为主,且支链较少。而当采用HZSM-5(PSC)方法时,C14以上的烃类随着PAHs的增加而增加,芳构化程度较高,而低氢碳比的PAHs更易缩聚形成更大分子量的PAHs,这体现出在PSC方法中催化剂定向选择的重要性。因此,当采用Ti/HZSM-5时,烃类的碳数组成相对均一,约75%烃类的碳原子数分布在C10~C13范围内,尽管RB-Ⅲ中PAHs占比仍有24%,但以支链较少的两环PAHs为主。因此,从烃类的碳数组成角度而言,RB-Ⅲ已接近汽柴油的烃类组成,但较低的氢碳比使其燃料品位较低。当采用Ti/HZSM-5(PEC)方法时,随着等离子体放电区的分离,反应产物在催化剂层的缩聚现象有所加剧,使BF-Ⅳ中C14以上的烃类化合物明显增加。
不同催化方法对精制生物油中含氧有机物含量及氧原子分布的影响如图5所示。由图5a可见,当采用等离子体放电技术后,尽管对烃类产物的选择性不尽相同,但对含氧化合物的裂解剔除作用均较明显,尤其是对酚类和醇类等在常规催化过程中较难剔除的含氧有机物,RB-Ⅱ、RB-Ⅲ和RB-Ⅳ中酚类和醇类化合物均明显降低。同时,由于催化过程不可避免地会发生少量副反应或不完全反应,使精制生物油中仍含有少量酮类和呋喃类化合物。在精制生物油中未检测到酸类物质,同时由于醇类和酚类的大幅降低,pH值明显提升,腐蚀性改善。由图5b可见,等离子体技术的引入使酚类和醇类物质大幅减少,与之对应,RB-Ⅱ、RB-Ⅲ和RB-Ⅳ中含氧有机物基本只含有一个氧原子,且含量明显降低,同时还有少量含两个氧原子的化合物,含有3个及以上氧原子的化合物均未检测到。总之,PSC方法和PEC方法对氧原子的裂解脱除效率均较高,若综合考虑产率及烃类组成,则PSC技术具有较明显的优势。
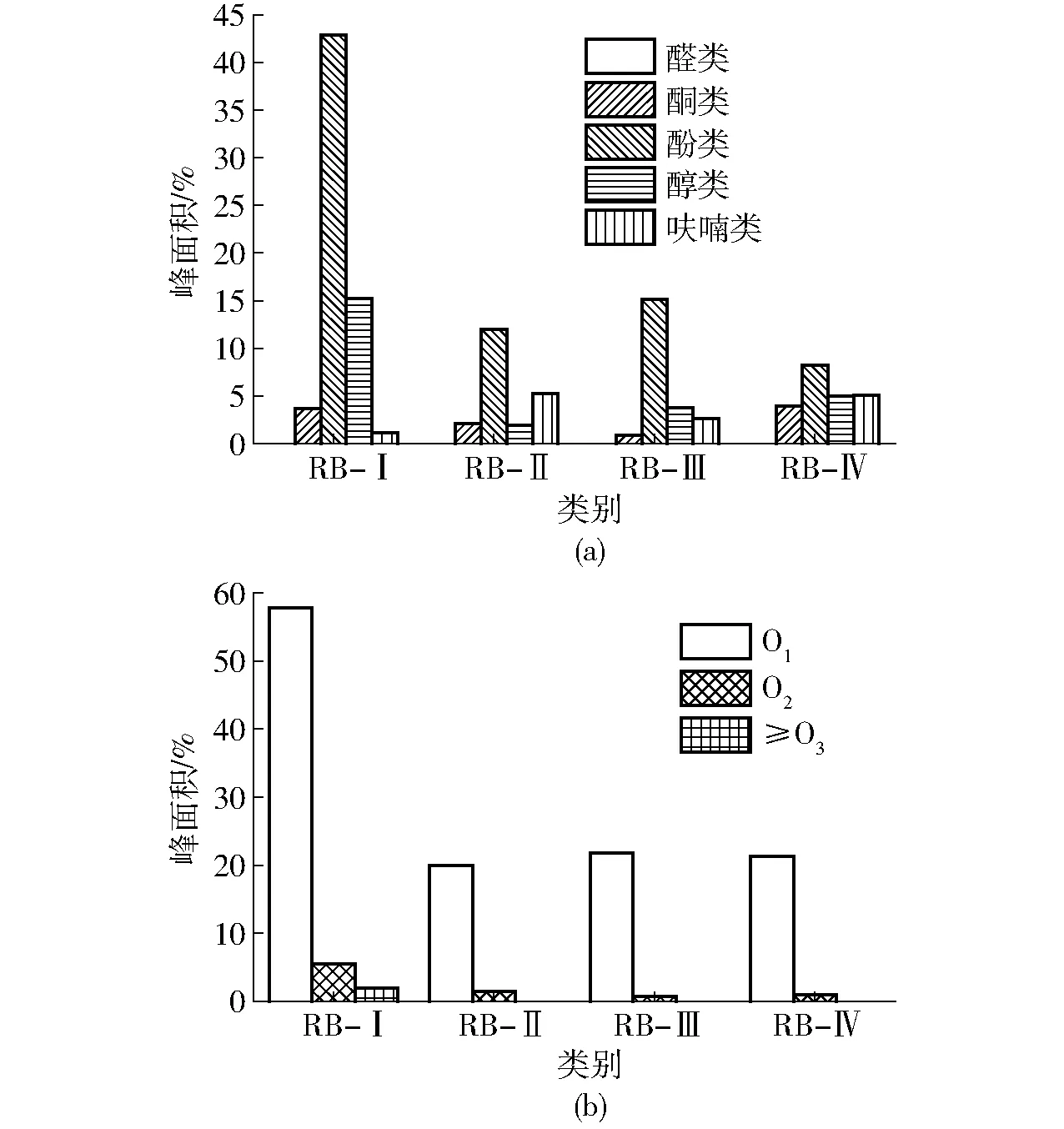
图5 不同催化方法对精制生物油中含氧有机物 含量及其氧原子分布的影响Fig.5 Effects of different methods on oxygenate contents and oxygen atom distribution in refined bio-oils
2.5 催化剂结焦分析
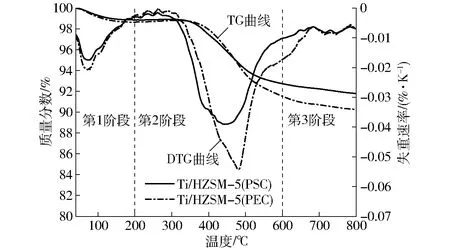
图6 不同方法使用相同时间后Ti/HZSM-5的TG和 DTG曲线Fig.6 TG and DTG curves of Ti/HZSM-5 by different methods after being used with the same time
基于对生物油化学组成的分析,进一步分析Ti/HZSM-5在不同方法下的催化稳定性,在不同方法中使用相同时间后的Ti/HZSM-5的TG和DTG曲线如图6所示。由图6可见,催化剂的失重过程可分为3个阶段,包括200℃以前的第1阶段,该阶段的失重主要由水及低沸点物质挥发引起;200~600℃的第2阶段,失重主要由焦炭的氧化分解造成;600℃以后的第3阶段,失重量较小,主要由少量重质物质缓慢分解引起。Ti/HZSM-5(PSC)的总失重量较低,并且位于第2阶段DTG曲线的主失重区呈现单峰结构,高温侧的肩峰无法区分。在分子筛催化裂解生物油的过程中,既可能形成结构较疏松的无定型含氧焦炭,又可能形成致密结构的石墨型焦炭,无定型含氧焦炭易去除,而石墨型焦炭则相反[25]。为了更加清晰地分析催化剂结焦的差异性,采用Guassian法对DTG曲线的主失重区间进行拟合计算,对Ti/HZSM-5(PSC)的DTG曲线仅能采用单峰拟合,而对Ti/HZSM-5(PEC)的DTG曲线则进行双峰拟合,具体的拟合参数列于表4中。由表4可见,当采用PSC时,Ti/HZSM-5的总结焦量较低,且Ⅰ类和Ⅱ类焦炭的结构区分度明显降低,这与等离子体、Ti离子及催化剂之间较强的交互作用密切相关[16,26];而当采用PEC方法后,Ti/HZSM-5的结焦量又有所升高,因为高能放电区的前置分离,反应产物在催化剂层的缩聚现象有所加剧,Ti/HZSM-5的催化转化性能也受到限制,Ⅰ类无定型焦炭量升高较为明显。
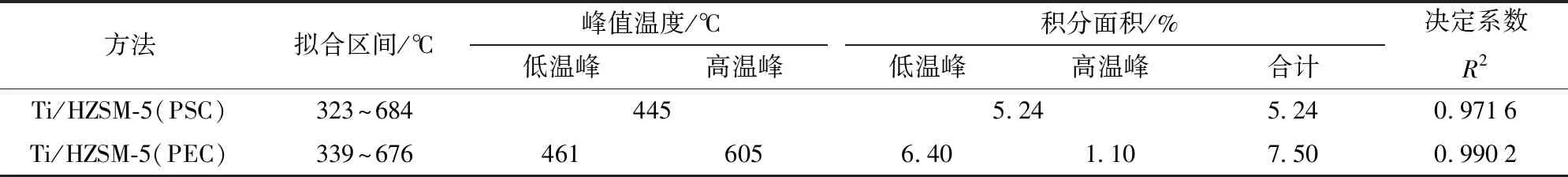
表4 不同方法中Ti/HZSM-5的结焦量Tab.4 Coke contents on Ti/HZSM-5 by different methods
3 结论
(1)与HZSM-5(PSC)相比,Ti/HZSM-5(PSC)方法所得精制生物油RB-Ⅲ产率(生物油质量分数15.05%)降低,但高于Ti/HZSM-5(PEC)方法所得生物油产率(生物油质量分数13.84%);尽管所得精制生物油含氧量不是最低的,但理化性质相对较高,高位热值达36.52 MJ/kg。
(2)Ti/HZSM-5(PEC)方法中催化路径延长,使精制生物油的产率和含氧量均较低,但含氢量也同步降低。同时,催化剂层的产物缩聚现象加剧,部分理化性质不升反降;而Ti/HZSM-5(PEC)方法中等离子体放电活化与Ti/HZSM-5定向选择的联合作用,使精制生物油中高氢碳比产物相对含量达68.89%,且烃类碳数主要分布在C10~C13范围内。
(3)PSC方法中等离子体、Ti离子及催化剂之间较强的交互作用使Ti/HZSM-5的催化稳定性相对较高,总结焦量相对较低,积分面积仅为5.24%;PEC方法中反应产物缩聚的加剧以及催化剂转化性能的限制,使Ti/HZSM-5总结焦量有所升高。
(4)综合精制生物油产率、理化特性、化学组成及催化剂结焦量的分析,Ti/HZSM-5(PSC)方法较适合生物油提质转化,但反应物较低的有效氢碳比仍限制着提质效率的提升。

