响应面法优化插田泡花色苷超声辅助提取工艺
蒋华梅,王向前
(1.贵阳学院化学与材料工程学院,贵州贵阳550005;2.贵阳学院图书馆,贵州贵阳550005)
插田泡是蔷薇科(Rosaceae)悬钩子属(Rubus)植物,果实6月~8月成熟,富含VC、蛋白质、超氧化物歧化酶、花色苷等成分,营养十分丰富[1-2]。花色苷属黄酮多酚类物质,具有抗炎、抗氧化、抗突变、抗肿瘤、改善胰岛素抵抗、调节血脂及预防心肌缺损等生物活性和多种保键功能[3-5],还可作为食用色素和功能食品原料使用,具有较高的经济价值。近年来,国内外研究人员对悬钩子属类植物,如黑莓、树莓、红树莓果实中花色苷的提取纯化及鉴定、抗氧化活性、抑菌、抗肿瘤方面进行了大量的研究[6-19]。悬钩子属植物插田泡(Rubus coreanusMaq.)果实花色苷的研究仅涉及酸化乙醇溶剂振荡提取及粗提物抗氧化活性方面的报道[1]。关于插田泡果实花色苷提取方法及工艺的优化研究还不够系统和全面。
植物花色苷的提取方法有溶剂法、微波辅助法、超声波辅助法、酶法、超临界流体萃取法[3,19-21]等。溶剂浸提法,设备简单、投资少、耗时费事。超声辅助提取法是利用超声波辐射压强产生的机械效应、空化效应和热效应来加速物质的扩散溶解,有效地提高化合物提取的得率和含量,具有成本低、提取效率高、提取量大、时间短等优点。响应面分析法(response surface methodology,RSM),是一种优化工艺参数的有效方法,通过对回归方程的分析来寻求最优工艺参数,解决多变量及因素交互影响的问题。因此,本试验采用超声辅助提取技术对贵州野生插田泡果实花色苷进行提取,并在单因素试验的基础上,利用响应曲面法优化超声提取工艺,以期为插田泡果实花色苷资源的全面高效利用提供借鉴。
1 材料与方法
1.1 材料与试剂
野生插田泡果实2018 年6 月采自贵州省安顺市西秀区,挑选完全成熟的紫黑色果实去离子水洗净后置于-40 ℃冰箱内冷冻储存,试验前室温、避光条件下解冻。无水乙醇、醋酸钠、氢氧化钠、氯化钾(均为分析纯):重庆川东化工集团有限公司。
1.2 仪器与设备
FA1104 电子天平:上海舜禹恒平科学仪器有限公司;PHS-3C 精密酸度计:上海雷磁·创益仪器仪表有限公司;KQ-300DE 数显温超声波清洗器:昆山市超声仪器有限公司;BluStar-A 扫描型紫外可见分光光度计:北京莱伯泰科仪器股份有限公司;SHB-Ⅲ循环水多用真空泵:北京市泰和格润仪器有限公司。
1.3 方法
1.3.1 最大吸收波长的测定
准确称取1.0 g 插田泡成熟果实于研钵中研磨5 min,多次少量加入体积分数75%乙醇溶液(pH3)(共用30 mL)洗涤研钵,溶液及果实均转移至具塞锥形瓶中,超声振荡提取20 min,抽滤,滤液于200 nm~600 nm 范围内扫描,以确定插田泡果实花色苷的最大吸收波长。
1.3.2 花色苷含量的检测
1.3.2.1 超声辅助提取流程
称取室温解冻果实1 g→研磨5 min→加入75%乙醇溶液→超声辅助提取→抽滤→收集滤液→定容至100 mL→花色苷粗提液
1.3.2.2 花色苷含量的测定及计算
准确移取氯化钾缓冲液(pH1.0)3 mL 与1 mL 插田泡果实花色苷粗提液混合,摇匀;另准确移取醋酸钠缓冲溶液(pH4.5)3 mL 与1 mL 插田泡果实花色苷粗提液与混合,摇匀。空白对照为各对应的缓冲溶液,于插田泡果实花色苷最大吸收波长538 nm 处测吸光度,按照以下公式(1)计算花色苷含量[1]:

式中:X为插田泡果实花色苷得率,mg/100 g;ΔT为ApH1和ApH4.5的吸光度差值;V为插田泡果实花色苷提取液的总体积,mL;F为稀释倍数;M为矢车菊素-3-葡萄糖苷的摩尔质量,449 g/mol;ε 为矢车菊素-3-葡萄糖苷的摩尔消光系数,29 600 L/(mol·cm);m为样品质量,g;b为比色皿厚度,1 cm。
1.3.3 单因素试验
按1.3.2节方法,提取插田泡果实花色苷,提取条件为:固定反应条件为溶剂75 %乙醇(pH3)、料液比1 ∶20(g/mL)、温度50 ℃、提取时间30 min,考察不同超声功率(120、150、180、210、240 W)对花色苷得率的影响;固定反应条件为超声功率150 W、溶剂75%乙醇(pH3)、料液比1 ∶20(g/mL)、温度50 ℃,考察不同超声提取时间(20、30、40、50、60 min)对花色苷得率的影响;固定反应条件为超声功率150 W、溶剂75 %乙醇(pH3)、料液比1 ∶20(g/mL)、提取时间30 min,考察不同提取温度(水温16、20、30、40、50 ℃)对花色苷得率的影响;固定反应条件为超声功率150 W、料液比1 ∶20(g/mL)、温度50 ℃、提取时间30 min,考察不同乙醇体积分数(55%、65%、75%、85%、95%)(pH3)对花色苷得率的影响;固定反应条件为溶剂75%乙醇(pH3)、超声功率150 W、温度50 ℃、提取时间30 min,考察不同料液比[1 ∶10、1 ∶20、1 ∶30、1 ∶40(g/mL)]对花色苷得率的影响;固定反应条件为溶剂75%乙醇、超声功率150 W、温度50 ℃、料液比1 ∶20(g/mL),考察不同乙醇pH 值(1、2、3、4、5)对花色苷得率的影响。进行单因素试验,考察各因素变量对插田泡果实花色苷得率的影响。
1.3.4 响应面试验设计
根据单因素试验结果,选择超声功率(A)、提取时间(B)、乙醇体积分数(C)、料液比(D)4 个因素,利用Design-Expert 8.6 软件,根据Box-Behnken 试验设计原理,响应值为插田泡果实花色苷得率(Y),进行四因素三水平响应面优化试验设计,以确定插田泡果实花色苷的最佳超声提取条件,因素水平编码见表1。

表1 响应面试验因素水平表Table 1 Factors and levels in response surface design
2 结果与分析
2.1 最大吸收波长的测定
插田泡花色苷紫外-可见光谱图见图1。

图1 插田泡花色苷紫外-可见光谱图Fig.1 UV-visible spectrum of Rubus coreanus Maq.anthocyanin
文献报道,花色苷类物质的紫外及可见分光光谱图中有两个特征吸收峰:一个在270 nm~290 nm 附近,与苯甲酰基有关;另一个在500 nm~540 nm,与肉桂酰基有关[4,22]。如图1所示,插田泡果实花色苷在292 nm和538 nm 波长处有两个特征吸收峰。因此,插田泡果实花色苷乙醇溶液中的最大吸收波长为538 nm,作为本试验的测定波长。
2.2 单因素试验结果
2.2.1 超声功率对花色苷得率的影响
超声功率对花色苷得率的影响见图2。
如图2所示,插田泡果实花色苷的得率随着超声功率的升高先呈上升趋势。超声功率的升高使花色苷更易溶出,花色苷得率升高。功率为150 W 时,花色苷得率最大,随后得率呈下降趋势。原因是超声功率的增大加快了插田泡果实外皮细胞壁破裂速度[11],花色苷加速溶出,但功率过高,造成溶液体系温度太高,插田泡花色苷的糖苷分离[23],从而导致花色苷分解,得率下降。所以,选择超声功率120、150、180 W 3 个水平条件设计响应面试验。
2.2.2 超声提取时间对花色苷得率的影响
超声提取时间对花色苷得率的影响见图3。

图2 超声功率对花色苷得率的影响Fig.2 Effect of ultrasonic power on anthocyanins yield

图3 超声提取时间对花色苷得率的影响Fig.3 Effect of extraction time on anthocyanins yield
如图3所示,插田泡果实花色苷得率随超声提取时间先快速增大,随后缓慢下降。说明超声提取30 min时,插田泡样品与乙醇溶剂充分接触,达到传质饱和,此时插田泡果实花色苷已经充分溶出,得率最高;继续增加超声提取时间,会破坏花色苷分子结构,导致部分花色苷分解[11,24],降低得率。所以,选择超声提取时间20、30、40 min 3 个水平条件设计响应面试验。
2.2.3 超声提取温度对花色苷得率的影响
提取温度对花色苷得率的影响见图4。

图4 提取温度对花色苷得率的影响Fig.4 Effect of extraction temperature on anthocyanins yield
如图4所示,在不加热的情况下,溶液室温16 ℃超声提取时,插田泡花色苷的得率最高。其后随着超声提取温度的升高,会导致插田泡果实花色苷得率下降。40 ℃前花色苷得率下降较缓慢,40 ℃后花色苷得率下降较为显著。这是由于插田泡花色苷对热十分敏感,超声提取溶液温度高于16 ℃即会破坏插田泡花色苷结构的稳定性[11],造成花色苷的降解。因此,本试验超声提取时不加热,溶液室温即为最佳提取条件。
2.2.4 乙醇体积分数(pH3)对花色苷得率的影响
乙醇体积分数对花色苷得率的影响见图5。
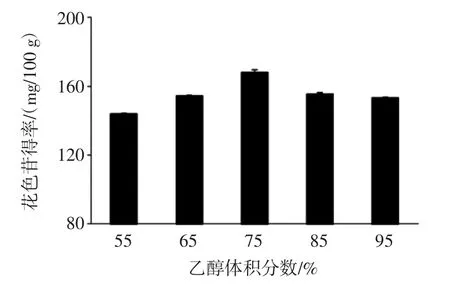
图5 乙醇体积分数对花色苷得率的影响Fig.5 Effect of ethanol concentration on anthocyanins yield
如图5所示,插田泡果实花色苷的得率先随着乙醇体积分数的增加逐渐增大,当乙醇体积分数超过75%时,花色苷得率减少。这是由于溶液中适当增加乙醇等有机溶剂能促使植物花色苷中氢键断裂,小分子的花青素溶出,使溶液中的色素含量提高;但随着乙醇体积分数超过75%,溶液的极性降低,偏离了插田泡花色苷的极性,亲水性花色苷的析出减少,导致总花色苷得率降低[25-27]。所以,选择乙醇体积分数65%、75%、85%3 个水平条件设计响应面试验。
2.2.5 料液比对花色苷得率的影响
料液比对花色苷得率的影响见图6。

图6 料液比对花色苷得率的影响Fig.6 Effect of solid-to-liquid ratio on anthocyanins yield
如图6所示,随着料液比液体量增大,插田泡果实花色苷得率先逐渐增大后减小。可能原因是料液比较小,插田泡果实浸泡不完全,造成花色苷浸提不完全。当料液比达到1∶30(g/mL)时,样品花色苷提取完全。料液比继续增大,此时乙醇体积增加,花色苷结构遭到有机溶剂的破坏,导致其提取量下降,得率降低[25]。所以,选择料液比1∶20、1∶30、1∶40(g/mL)3 个水平条件设计响应面试验。
2.2.6 乙醇pH 值对花色苷得率的影响
乙醇pH 值对花色苷得率的影响见图7。

图7 乙醇pH值对花色苷得率的影响Fig.7 Effect of different acidity ethanol on anthocyanins yield
如图7所示,插田泡果实花色苷得率随酸化乙醇pH 值的增加先增大后减少。溶液酸度较高时,花色苷分子大多以非离子化形式存在,造成样品花色苷得率较低;当pH 值为2 时,样品花色苷结构稳定,以红色黄烊盐阳离子形式存在,得率最大;当pH 值逐渐增大,溶液酸度逐渐降低,花色苷分子结构逐渐由红色黄烊盐阳离子形式向无色查尔酮转变,溶液颜色变浅[25],花色苷得率逐渐减少。说明花色苷类物质的提取应在适宜酸度范围内进行,否则酸度过高(如pH1)或过低将导致花色苷的水解及降解,稳定性降低。因此,本试验酸化乙醇的pH 值为2 较为合适。
2.3 响应面试验结果
2.3.1 响应面试验设计及结果分析
基于单因素试验结果,选择对插田泡果实花色苷含量影响较显著的4 个因素超声功率(A)、超声提取时间(B)、乙醇体积分数(C)、料液比(D),以花色苷得率(Y)为响应值,进行响应面优化试验。设计了四因素三水平响应面试验,共有29 个试验,以确定插田泡果实花色苷最佳超声提取工艺参数,方案设计及结果见表2。

表2 响应面试验设计与结果Table 2 Expertmental design and results for response surface analysts

续表2 响应面试验设计与结果Continue table 2 Expertmental design and results for response surface analysts
用Design-Expert 8.0.6 软件对表2的试验数据进行回归拟合分析,得到插田泡果实花色苷得率(Y)的二次多项回归方程预测模型为Y= 248.578 00-7.175 00A-5.160 00B-2.738 33C+5.853 33D+5.370 00AB+21.447 50-15.237 50AD+0.042 500BC-24.427 50BD+6.120 00CD-47.256 50A2-20.931 50B2-27.599 00C2-7.734 00D2。
2.3.2 响应面试验方差分析结果
采用Design Expert 8.0.6 软件对数据进行处理,得到回归方程方差分析表3。
由表3可知,回归模型F 值较高为25.72,P<0.000 1,说明此回归模型极显著,具有统计学意义;方程的失拟项P值为0.985 3 >0.05,不显著,表明该回归模型拟合程度较好,无失拟因素存在,误差小,该方法的拟合效果较好。由校正绝对系数R2(0.962 6 >0.80)和变异系数CV 为4.01%,说明该模型只有3.74%的变异,进一步说明模型拟合程度较好,回归模型方程代表性较好,响应值的变化有96.26%来自于所选的变量;模型调整系数R2Adj为0.925 1 说明模型的预测性较好,实际值与预测值是较接近;模型精密度为18.139,大于4,说明此模型是可行的[26]。因此,可用该回归模型方程代替试验真实点对试验结果进行预测分析,该模型可用来对超声提取插田泡果实花色苷的工艺条件优化。

表3 回归模型的方差分析Table 3 Analysis of variance of regression equation
回归模型方程中的一次项超声功率(A)、超声提取时间(B)、料液比(D)影响显著(P<0.05);二次项超声功率与乙醇体积分数交互项(AC)、超声功率与料液比交互项(AD)、料液比二次项(D2)影响显著(P<0.05);二次项超声提取时间与料液比交互项(BD)、超声功率二次项(A2)、超声提取时间二次项(B2)、乙醇体积分数二次项(C2)对花色苷得率的影响极显著(P<0.000 1)。由各因素F 值的大小可知,4 个因素对花色苷得率的影响程度次序为超声功率(FA=9.09)>料液比(FD=6.05)>超声提取时间(FB=4.70)>乙醇体积分数(FC=1.32)。
2.3.3 交互作用对花色苷得率的影响
根据回归方程绘出响应面图及等高线图,分析超声功率、超声提取时间、乙醇体积分数、料液比4 个因素对插田泡果实花色苷得率的交互影响。
各因素交互作用对插田泡果实花色苷得率的影响,可根据图8响应曲面图及等高线图直观地进行判断。图中曲面越陡峭,说明两因素的交互作用越显著,对花色苷得率的影响越大;等高线图中形状为圆形说明两因素交互作用不显著,为椭圆形说明两因素交互作用显著[28]。从图8中可以看出,超声功率和超声提取时间之间交互作用较弱,超声功率对插田泡花色苷得率的影响大于超声提取时间;超声功率和乙醇体积分数之间具有显著的交互作用,超声功率对花色苷得率的影响大于乙醇体积分数;超声功率和料液比的交互作用也较显著,超声功率对花色苷得率的影响略大于料液比;超声提取时间和乙醇体积分数交互作用不显著,超声提取时间对花色苷得率的影响略大于乙醇体积分数;超声提取时间和料液比之间具有极为显著的交互作用,响应曲面中曲线较陡和等高线中形状为明显的椭圆形,其中料液比对花色苷得率的影响略大于超声提取时间;乙醇体积分数和料液比之间交互作用不显著,但料液比的曲面较陡,其对花色苷得率的影响大于乙醇体积分数。以上分析结果与表3方差分析结果相吻合。


图8 两因素交互作用对花色苷得率影响的响应面图和等高线图Fig.8 Response surface and contour plots showing the interactions of two factors on anthocyanin yield
2.3.4 最优工艺条件的确定及验证试验
通过Design-Expert 8.0.6 软件分析得到插田泡果实花色苷的最佳超声提取条件为超声功率141.30 W、超声提取时间22.60 min、乙醇体积分数74.52%(pH2)、料液比1∶40(g/mL),此条件下插田泡果实花色苷的得率为260.883 mg/100 g。考虑实际操作,将以上条件调整为超声功率141 W、超声提取时间22.60 min、乙醇体积分数74.50%(pH2)、料液比1∶40(g/mL)进行3 次平行试验,测得插田泡果实花色苷得率为263.15 mg/100 g,与模拟计算机值基本接近,表明预测值与真实值之间有很好的拟合性,进一步验证了模型的可靠性。
3 结论
根据单因素试验结果,采用响应曲面法优化超声提取插田泡果实花色苷的工艺参数,建立了回归模型方程,根据模型确定了插田泡花色苷的最佳提取工艺参数为超声功率141 W、超声提取时间22.60 min、乙醇体积分数74.50%(pH2)、料液比1∶40(g/mL),该条件下插田泡花色苷的实际得率可达263.15 mg/100 g,与预测值接近,高于采用振荡提取的花色苷得率211.05 mg/100 g[1]。说明超声辅助萃取技术比溶剂振荡提取方法更有利于花色苷组分的浸出,耗时短,萃取效率更高,可为插田泡果实花色苷提取新工艺提供依据。

