拉曼光谱分析牛肉贮藏过程中肌红蛋白结构的变化
张同刚,罗瑞明,李亚蕾*,马梦斌,周亚玲
(宁夏大学农学院,宁夏 银川 750021)
肉色是肉品外观评定的重要指标,直接影响市场上消费者的购买欲望[1]。屠宰后肉的颜色与肌红蛋白的氧化状态有关[2-3]。在贮藏过程中,受低温、低氧、结合水脱离及细胞液浓缩、次级键新生和断裂等因素影响,蛋白质分子发生聚集和氨基酸多肽链逐渐展开,从而导致蛋白质逐渐丧失生物活性[3-8]。随着牛肉贮藏时间的延长,肌红蛋白化学与物理性质均发生一定的变化,如表面疏水能力、二硫键构型含量呈现上升趋势。现阶段对于肌红蛋白的研究,主要集中在物理化学性质变化方面,较少涉及到微观分子结构水平。为了进一步探索肉色变化规律,有必要了解贮藏过程中肌红蛋白二级结构变化。
拉曼光谱提供样品分子的转动或振动信息[9-12]。与其他光谱技术相比,拉曼光谱技术样品不需要预处理,具有快速、无损检测、样品量少等特点[13],该技术通过反射氨基酸或者肽链的不同种振动模式得到响应信号,能提供包含蛋白质分子二级结构和三级结构信息的光谱信息图。作为一种新兴的研究手段,拉曼光谱技术已经被运用到监控肉类蛋白(如肌球蛋白)结构变化[14-17]。本实验采用拉曼光谱技术,研究牛肉肌红蛋白特征峰区带图谱,对肌红蛋白氧化还原状态进行归属指认,解析肌红蛋白结构变化信息,从蛋白质二级结构层面揭示牛肉贮藏过程中色泽变化的微观机理。
1 材料与方法
1.1 材料与试剂
选用宁夏本地1.5~2 岁龄左右肉牛(秦川牛)的牛背最长肌为实验对象,样品购自宁夏回族自治区银川市西夏区新百超市。
硫酸铵、三羟甲基氨基甲烷、盐酸、氯化钠(均为分析纯) 银川昕泰生物试剂公司。
1.2 仪器与设备
Inspector 300拉曼光谱仪 美国赛普斯公司;HH.SY21-Ni6-C高速组织捣碎机 江苏金坛市亿通电子有限公司;UV-1200紫外-可见分光光度计 上海美谱达仪器有限公司。
1.3 方法
1.3.1 样品处理
取牛背最长肌后,立即真空包装,在4 ℃左右避光贮藏,在贮藏的21 d过程中,每3 d取一次样进行测定,以胴体修整作为第0天。
1.3.2 肌红蛋白的提取及含量测定
参考Thiansilakul等[18]的方法,并稍作修改,取牛背最长肌,去除表面筋膜及结缔组织,切碎。准确称取10 g肉样,加入1 000 mL提取缓冲剂(0.01 mol/L Tris-HCl,pH 6.4,4 ℃),10 000 r/min匀浆1 min,离心(9 600×g、10 min,4 ℃),滤纸过滤,得滤液。滤液中加入固体硫酸铵,一边加一边搅拌,至饱和度达到50%。在4 ℃下静置3 h,10 000×g离心15 min(4 ℃),去除沉淀,上清液中继续加入硫酸铵(选用硫酸铵沉淀是因为与其他中性盐相比,硫酸铵温度系数小但溶解度大,不会破坏蛋白结构以引起蛋白变性,且分级沉淀效果佳),边加边搅拌,至不再溶解,在4 ℃下静置3 h,10 000×g下离心15 min(4 ℃)。将沉淀溶解于5×10-3mol/L Tris-HCl起始液中,装入透析袋(10 000 COMW),于4 ℃上述提取缓冲剂中透析,每6 h换一次透析液,共换5 次。
选用DEAE-Sepharose FF层析柱,梯度洗脱液为0.01 mol/L pH 8.6的Tris-HCl缓冲液与200 mmol/L NaCl的混合溶液,每4 min收集一管洗脱液(粗肌红蛋白),采用紫外-可见分光光度计测定洗脱液分别在542 nm与700 nm波长处的吸光度。样品中肌红蛋白含量按下式进行计算。
肌红蛋白含量/(mg/g)=(A542nm-A700nm)×2.303
1.3.3 拉曼光谱测定
将待测样品置于拉曼光谱仪50 倍镜头下,调整好镜头与样品间的距离后,开始扫描,激光固定波长为785 nm,功率为10 mW,扫描范围为200~2 500 cm-1,聚焦深度为200 µm。每个样品5 个平行样,每个样重复3 次。拉曼光谱数据选取SGS平滑滤波方法为光谱预处理法。
1.4 数据处理
实验数据使用Excel软件进行处理,采用SPSS 18.0软件对数据进行Pearson相关性分析,采用Duncan’s多重比较进行差异显著性检验,其中P<0.05表示差异显著。通过PeakFit 4.0软件对蛋白质二级结构进行峰分离和曲线拟合,数据采用Origin 8.0软件进行绘图。
2 结果与分析
2.1 牛肉贮藏期间肌红蛋白拉曼光谱
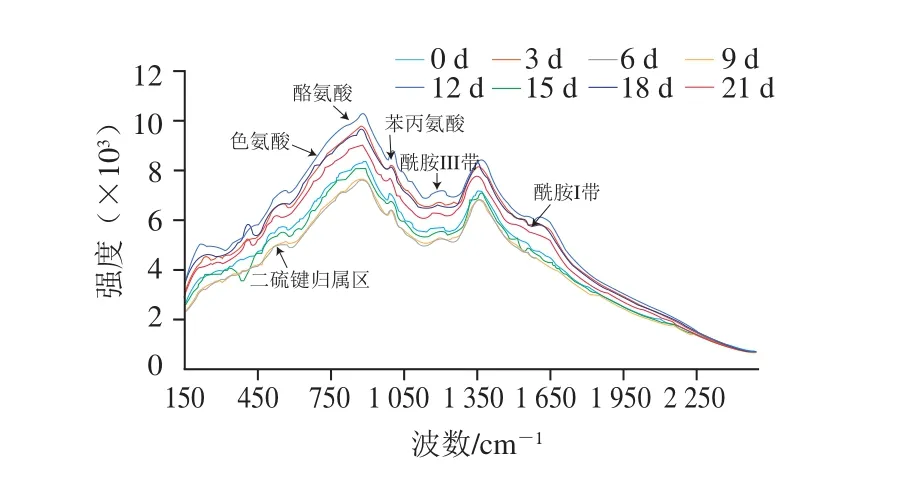
图1 牛肉贮藏期间的拉曼光谱Fig. 1 Original Raman spectra of beef samples under different storage time
图1为不同贮藏时间的牛肉样品的拉曼光谱曲线。1996年,Li-Chan等已初步指认特定波数的肌红蛋白拉曼光谱的特征峰[19]。肌红蛋白的主要结构是由拉曼光谱中酰胺Ⅰ、Ⅲ带的特征峰强度与位移所表现出来的,其中酰胺Ⅰ带来自于C—N与C=O键的振动,酰胺III带来自于N—H在平面上的转折和C—N键的振动[20-24]。采用Labspec 4.0软件对牛肉样品中肌红蛋白的酰胺I带峰强进行分析,可得:1 645~1 660 cm-1处峰表示α-螺旋结构;1 665~1 680 cm-1处峰表示β-折叠结构;1 680~1 690 cm-1处峰表示β-转角结构;1 660~1 670 cm-1处峰表示无规卷曲结构。
通常拉曼光谱峰强度与样品的化学键或基团数目具有一定的对应关系。峰强度可以直接反映样品化学键或基团变化程度,当样品的拉曼光谱曲线发生位移时,表明样品受内外部因素影响,导致其所对应的化学键或基团发生了变化。
2.2 贮藏时间对牛肉样品肌红蛋白二级结构的影响
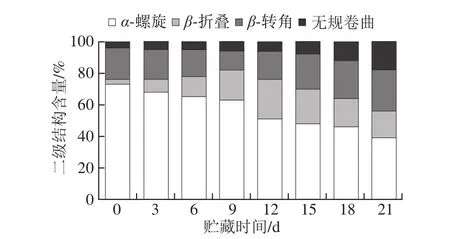
图2 牛肉样品贮藏过程中肌红蛋白二级结构组成Fig. 2 Secondary structure composition of myoglobin in beef
由图2可知,随着贮藏时间的延长,肌红蛋白二级结构中的α-螺旋含量呈现降低的趋势,β-折叠含量则呈现先升高后下降的趋势,β-转角结构含量呈现先降低后升高的趋势,无规卷曲含量呈现逐渐增大的趋势。高瑞昌等[25]采用拉曼光谱技术测定了冻藏过程中对虾肌动球蛋白的变化,得出南美白对虾肌肉蛋白二、三级结构侧链构象在冻藏过程中的变化,主要由组成肌动球蛋白的氨基酸相互间的分子作用造成的。李可等[26]研究了NaCl对猪肉蛋白质二级结构变化的影响,得出NaCl会使猪肉蛋白质二级结构中的β-折叠含量变化显著。说明随所处微环境的变化,蛋白质二级结构含量也随之变化。
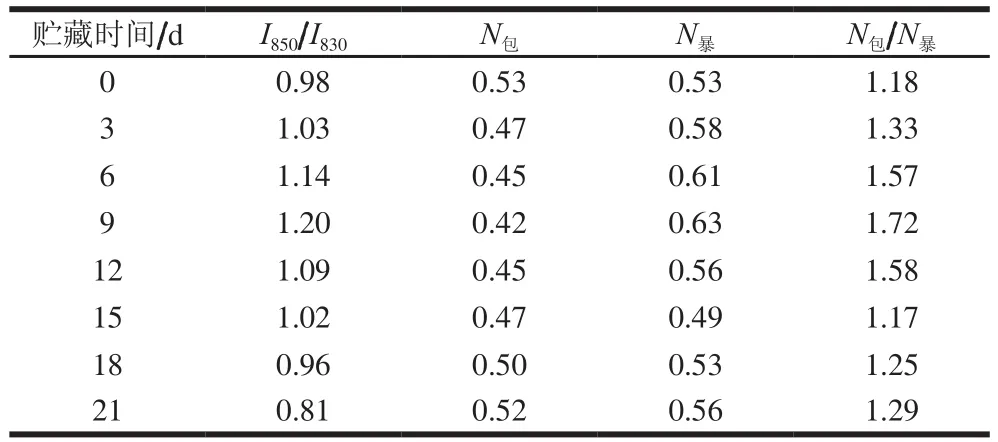
表1 酪氨酸的费米共振I850/I830以及残基暴露/包埋分子数Table 1 Tyr I850/I830 Fermi doublet intensity ratio and number of exposed/buried amino acid residues
850 cm-1与830 cm-1附近的拉曼光谱特征峰(酪氨酸的费米共振)随微环境变化而改变,当强度比I850/I830≥1(I850、I830分别表示850、830 cm-1处峰的归一化强度)时,该酪氨酸是“暴露的”;I850/I830<1时,该酪氨酸就是“埋藏的”[27]。本研究中I850/I830在0.81~1.20之间,包埋和暴露的两种氨酸残基的分子数(N包、N暴)随贮藏时间的变化见表1。
酪氨酸残基通常存在于蛋白分子的表面,呈暴露状态,以氢键受体或供体的形式与H2O结合。由表1可知,随着贮藏时间的延长,N包/N暴和酪氨酸I850/I830均呈现先升高后下降的趋势。
2.3 二硫键分析
500~550 cm-1附近的拉曼光谱属于二硫键特征谱带。在此范围的波段内振动模式与波数的对应关系为:500~510 cm-1处为gauche-gauche-gauche(g-g-g)模式,515~525 cm-1处为gauche-gauche-trans(g-g-t)模式,535~545 cm-1处为trans-gauche-trans(t-g-t)模式[28-32]。采用Peak Analyzer 4.0软件对肌红蛋白进行多峰值Guassina拟合,分析贮藏时间对肌红蛋白中二硫键构型与含量变化的影响。肌红蛋白的二硫键构型主要为t-g-t模式,样品中二硫键构型组成与含量变化见表2。
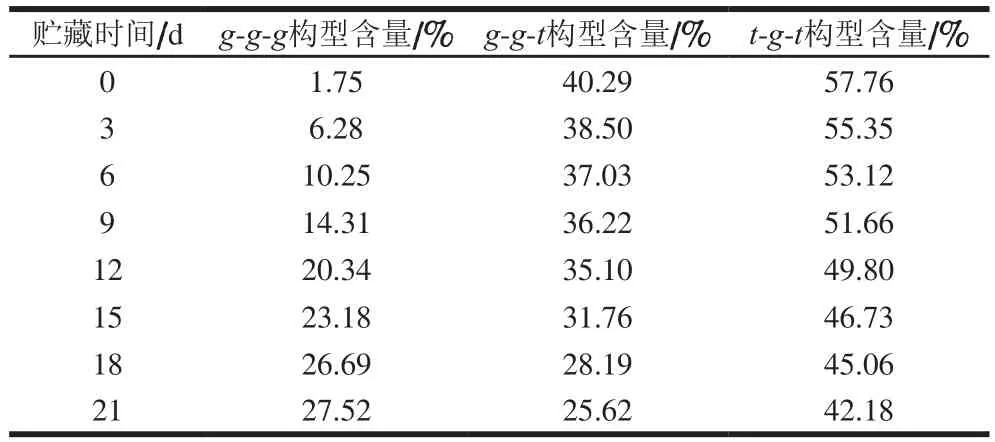
表2 二硫键构型组成及含量Table 2 Configurational composition of disulfide bonds in myoglobin
肌红蛋白氧化状态与蛋白质的二级结构、酪氨酸与色氨酸残基暴露出的数量有很强的相关性,贮藏过程中肌红蛋白的结构逐渐疏散无序,氨基酸残基微环境发生改变。其中t-g-t与g-g-g构型分别属于分子间、内的二硫键构型。由表2可得,随着贮藏时间的延长,肌红蛋白二硫键t-g-t构型含量逐渐降低,说明肌红蛋白分子间的部分二硫键受到破坏,从而导致其分子间的作用力降低,肌红蛋白结构的稳定性与功能下降。
2.4 贮藏过程中肌红蛋白氧化状态与拉曼光谱相关数据的相关关系
由表3可知,氧合肌红蛋白与高铁肌红蛋白含量、I760分别呈极显著、显著负相关,r分别为-0.95、-0.73,与α-螺旋含量呈极显著正相关(r=0.88)。高铁肌红蛋白含量与I760(r=0.89)、I850/830(r=0.85)、α-螺旋含量(r=0.83)、β-转角含量(r=0.86)呈现极显著正相关,与β-折叠含量呈现显著相关(r=0.71)。I760与I850/830(r=0.91)、β-折叠含量(r=0.86)呈现极显著正相关,与α-螺旋含量呈现显著负相关(r=-0.74)。I850/830与α-螺旋含量呈现显著负相关(r=-0.93)。α-螺旋含量与β-折叠含量(r=-0.87)、β-转角含量(r=-0.79)、无规卷曲含量(r=-0.81)呈现极显著负相关。β-折叠含量与β-转角含量(r=0.82)、无规卷曲含量(r=0.90)呈现极显著正相关。β-转角含量与无规卷曲含量呈现极显著正相关(r=0.76)。因此可以看出,肌红蛋白氧化状态与蛋白质二级结构、酪氨酸与色氨酸残基暴露数量有很强的相关性,并由此对肉色及其稳定性产生影响。

表3 贮藏过程中肌红蛋白氧化状态与拉曼光谱相关数据的相关关系Table 3 Correlation between myoglobin oxidation states and Raman spectral data during beef storage
3 结 论
通过对贮藏期间牛肉肌红蛋白拉曼光谱分析可知,随着贮藏时间的延长,肌红蛋白二级结构中的α-螺旋含量逐渐降低,无规卷曲含量则逐渐上升,β-折叠含量先升高后下降,β-转角含量先下降后上升;肌红蛋白中的二硫键主要以t-g-t构型为主,二硫键变化的同时,会使肌红蛋白中的血红素辅基八面体结构发生变化,从而影响氧与肌红蛋白的结合能力,使氧合肌红蛋白氧化成为高铁肌红蛋白;蛋白质二级结构中的α-螺旋转化成β-折叠或无规卷曲结构时,蛋白分子的构象发生分子重排,新产生的分子构象相对于原始具有活性的蛋白分子以“错误”方式存在,造成肌红蛋白二级结构原始构象发生改变,最终导致肌红蛋白作为色素蛋白的特有功能下降乃至丧失。因此,在牛肉贮藏过程中,由于肌红蛋白结构的改变,肉色稳定性下降并发生劣变。本实验从蛋白质二级结构层面,揭示了贮藏期间牛肉色泽变化的微观机理。

