卵巢癌患者组织中miR-135b的表达及临床意义*
刘 青,邓慧敏,周林涛,周义文,黄 荣
(南方医科大学深圳医院检验医学中心,广东深圳 518100)
卵巢癌在女性生殖器恶性肿瘤中的发生率占第3位,但其死亡率却居第1位[1],卵巢癌转移是卵巢癌高复发与高死亡率的主要原因。miR-135b在不同癌症中发挥癌基因功能,与宫颈癌、前列腺癌[2]、子宫内膜癌[3]等多种恶性肿瘤发生及进展有关。LI等[4]人构建过表达miR-135b的肝癌细胞株,通过尾静脉注入小鼠,观察肿瘤转移。与对照组相比,过表达miR-135b的肿瘤细胞的侵袭能力显著增加,表明miR-135b不仅可以促进肿瘤细胞的生长,还能促进肿瘤细胞的侵袭转移。然而miR-135b在卵巢癌中的作用未见报道,在此研究中,采用RT-PCR法检测miR-135b在卵巢癌组织和卵巢良性肿瘤组织中的表达,并分析其与卵巢癌患者年龄、组织学类型、分化程度、临床分期及淋巴结转移的关系。
1材料和方法
1.1 研究对象 收集2015年1月~2017年12月在解放军第一七四医院和南方医科大学深圳医院接受手术的卵巢病变患者的卵巢组织,包括28例卵巢癌组织(20例浆液性囊腺癌,8例黏液性腺癌),所有组织均通过病理确认并储存在-80℃以备后用。所有患者手术前均未经激素和放化疗治疗,且未并发其它肿瘤。年龄38~67岁,平均年龄55.6±5.1,≥50岁19例,<50岁9例。FIGO临床分期:Ⅰ期4例,Ⅱ期7例,Ⅲ期11例,Ⅳ期6例;15例有淋巴结转移,13例无淋巴结转移;高分化8例,中低分化20例。同期收集10例卵巢良性肿瘤组织(浆液性囊腺瘤,黏液性囊腺瘤,畸胎瘤,卵巢纤维瘤,卵泡膜细胞瘤)作为对照组,所有组织均经病理证实为良性,-80℃中保存备用。年龄30~65岁,平均年龄50.2±5.8。
1.2 试剂和仪器 CFX96荧光定量PCR仪购自美国Bio-rad公司,ARKTIK96 PCR仪购自Thermo公司;RNA提取试剂盒,miRNA逆转录试剂盒和荧光定量PCR试剂盒均购自杭州博日公司。RT-PCR的引物设计:使用Primer Premier 5.0引物设计软件设计U6和has-mir-135b的引物序列:U6:5’-GCTTCGGCAGCACATATACTAAA-3’,has-mir-135b-5p:5’-CCTGGCTTTTCATTCCTATGTGA-3’。引物由华大公司合成,干粉离心后用DEPC配成水溶液,浓度为20 μmol/L,放入-20℃冰箱备用。
1.3 方法
1.3.1 总RNA的提取和纯度检测:依据RNA提取试剂盒说明书从卵巢良性肿瘤组织和卵巢癌组织中提取总RNA。纯度检测:紫外分光光度计检测总RNA纯度,A260/A280的比值1.80∶2.20,说明制备的RNA较纯,无蛋白质污染。
1.3.2 miRNA逆转录和RT-PCR检测miR-135b:按miRNA逆转录扩增(RT-PCR)试剂盒说明书(一步法)对样本总RNA进行逆转录扩增。以2-ΔΔCt表示基因的相对表达水平,实时PCR总体系为25 μl。2.5 μl 10 ×RT-PCR Buffer(含30 mmol/L的Mg2+),4.0 μl dNTPMixture(2.5 mmol/L),1 μl RNase inhibitor(40 U/μl),1 μl上游特异性引物(5 μmol/L),1 μl下游特异性引物(5 μmol/L),0.5 μl AMV reverse transciptase,0.5 μl Taq DNA polymerase,RNase free H2O。反应条件:95℃ 30s,95℃ 5 min,60℃ 30s,总共40个循环,检测各模板的Ct值。
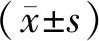
2结果
2.1 卵巢癌组织和卵巢良性肿瘤组织中miR-135b的表达分析 运用RT-PCR检测28例卵巢癌组织中miR-135b的表达量(1.90±0.53),与10例卵巢良性肿瘤组织中miR-135b的表达量(1.45±0.45)比较,差异具有统计学意义(t=2.03,P=0.021)。
2.2 卵巢癌患者不同临床病理特征间miR-135b表达的差异分析 见表1。


临床特征nmiR-135b表达量t值P值年龄(岁) ≥50 <50组织学类型 浆液性囊腺癌 黏液性腺癌分化程度 高分化 中低分化临床分期 <Ⅲ ≥Ⅲ淋巴结转移 无 有199208820111713151.97±0.511.77±0.571.96±0.501.77±0.611.55±0.252.05±0.541.60± 0.492.10± 0.461.68±0.442.10±0.530.846 0.743 6.104 7.517 5.0360.366 0.396 0.020 0.011 0.034
不同年龄、不同组织学类型miR-135b的表达量比较,差异均无统计学意义(t=0.743~0.846,均P>0.05);不同的分化程度、临床分期和是否有淋巴结转移miR-135b的表达量比较差异均有统计学意义(t=5.036~7.517,均P<0.05)。
3讨论近几年,对于非编码RNA在各种生理过程和病理过程中的作用研究持续增加,短链非编码RNA(如siRNAs,microRNAs)的研究不断深入,他们在生命活动中的重要意义逐渐被揭示。成熟的microRNA通过与mRNA的3’-UTR互补结合而参与基因翻译及以后的调控,导致转录抑制,阻碍蛋白翻译或降解靶mRNA。最新研究报道小囊泡及外泌体(exosomes)可通过胞膜融合产生内吞作用,其内可能含有mRNA和miRNA,被传送到其他细胞并发挥功能,这种miRNAs的细胞间转移方式,可作为一种新的基因交流机制。miRNA-mRNA间可产生类siRNA作用裂解靶mRNAs,通常miRNA只能调控其1.5~4倍量的靶mRNA表达,因此只有表达量充裕的miRNA,才拥有充足的与靶基因结合的位点,充当调控机制中“闸门”的作用[5]。miRNA与mRNA间的调控机制参与肿瘤细胞的增殖、分化、凋亡和转移等多方面生物学过程[6-7]。
已经发现多种miRNA在卵巢癌的发生发展中扮演着重要的角色。例如,miR-182在卵巢癌组织中高表达,且体外通过靶向作用于FOXO3,MTTS1等肿瘤抑制因子促进卵巢癌细胞的侵袭和转化[8],同时体内促进卵巢癌细胞在小鼠体内进行转移[9]。CHENG等[10]人发现miR-199通过抑制CD44的表达抑制卵巢癌细胞的侵袭与转移,同时减轻癌细胞的耐药性。这些结果说明miRNA在卵巢癌的发生发展过程中发挥重要作用。
miRNA-135分子簇在识别靶mRNA关键区域时可共享其类似序列,尤其是在种子序列区,miRNA-135a与miRNA-135b作为一个家族共同参与调控靶mRNA[11]。miR-135b基因位于染色体1号长臂的3区2号带的第1个亚带(1q32.1),它在各种肿瘤中升高,例如骨肉瘤、淋巴瘤、结肠癌和前列腺癌等。miR-135b在非小细胞肺癌中,通过激活Hippo信号通路和靶向LZTS促进肿瘤转移。我们的初步研究发现miR-135b在卵巢癌组织中高表达,与卵巢良性肿瘤组织比较结果有差异(P<0.05),并且其与卵巢癌分化程度、临床分期和淋巴结转移有关。这些研究结果提示miR-135b在卵巢癌中高表达,可能发挥癌基因功能。
了解卵巢癌转移的分子机制对卵巢癌的防治至关重要,但目前与其相关的机制尚未阐明。上皮细胞间质转化(EMT)是一种上皮细胞失去上皮细胞表型进入间质细胞的过程,继而使细胞运动性增加[12]。EMT是上皮肿瘤细胞获得迁移和侵袭的重要生物学过程,在癌症耐药中起着相当重要的作用[13-14],是原位癌发生转移的一种重要机制。因此,能否通过内源性的控制EMT过程进行精细地、多靶点的调节抑制卵巢癌细胞的转移,是我们希望达到的目标。本课题下一步的研究计划是通过靶基因预测软件寻找miR-135b下游的靶点,特别是与EMT调控相关的基因,分析卵巢癌患者血清中miR-135b与肿瘤标志物CA125之间的关系,并在细胞水平、动物水平加以验证,开展作用机制方面的研究,为确定miR-135b成为肿瘤诊断和治疗的重要生物学指标提供实验基础。

