豫北地区猪源大肠杆菌耐药性及基因多态性分析
张明亮,周玲玲,连凯琪*,周孝蕊,宋玉伟,王双山
(1.安阳工学院生物与食品工程学院,河南安阳 455000;2.河南省动物疫病防控与营养免疫院士工作站,河南安阳 455000; 3.河南省兽用生物制品研发与应用国际联合实验室,河南安阳 455000)
猪大肠杆菌病是猪群常见传染病,其病原为致病性大肠杆菌,主要引发猪败血症、仔猪黄痢、仔猪白痢等症状[1-2]。大肠杆菌血清型种类复杂,给疫苗的研制和制备带来了很多的困难,目前治疗大肠杆菌病仍然以抗菌药物为主。但近年来随着各种抗生素的滥用,细菌的耐药率持续上升,多重耐药问题更加严重,给大肠杆菌的治疗带来困难,在增加治疗成本的同时也给人类食品安全留下隐患。对猪源大肠杆菌基本耐药情况的研究,有助于预防和治疗此菌引起的疾病,同时对维护公共卫生安全也有着重要的意义[3]。本研究得到了21株猪源大肠杆菌,分析菌株的耐药情况,检测其耐药基因分布,同时对病原菌进行了RAPD分析,以期为该地区猪源大肠杆菌病的防治提供科学的理论依据。
1 材 料
1.1 实验菌株 从河南安阳、新乡、焦作等地区的规模化猪场采集21株(菌株1、3、6、7、8、10、11、21分离自安阳滑县、内黄、安阳县规模化养殖场;菌株9、14、15、16、20分离自新乡辉县市、卫辉市、长垣县规模化养殖场;菌株2、4、5、12、13、17、18、19分离自焦作市马村区、修武县、孟州市规模化养殖场)疑似大肠杆菌病死猪的肝脏、分泌物等。采用细菌学、PCR试验等方法鉴定为猪源致病性大肠杆菌。大肠杆菌标准菌株ATCC25922购自中国兽医药品监察所。
1.2 试剂 LB琼脂、麦康凯琼脂、LB液体培养基购自青岛海博生物技术有限公司;药敏纸片购自杭州滨河微生物试剂有限公司。Premix Taq,DL2000 DNA Marker 购自宝日医生物技术(北京)有限公司。
1.3 引物设计与合成 参照相关文献[4-5]及GeneBank设计出9种扩增常见抗生素基因和RAPD多态性分析所用的引物(表1)。
2 方 法
2.1 药敏试验 本实验采用纸片扩散法(K-B法)[6]。测定大肠杆菌对四环素、红霉素、头孢拉定、麦迪霉素、阿莫西林、磺胺异恶唑、环丙沙星、新生霉素、复方新诺明、恩诺沙星、甲氧苄啶、庆大霉素、洛美沙星、阿米卡星、头孢氨苄、头孢曲松钠等16种常用抗生素的敏感性。采用标准质控大肠杆菌ATCC25922菌株作为对照组。结果参考美国临床和实验室标准协会(CLSI2017版)肠杆菌科细菌抑菌圈直径标准,来判定分离株对各种抗生素的敏感情况[7-8]。
挑取分离培养的单个典型菌落在MH肉汤培养基中37 ℃培养,取适量菌液均匀地涂布在MH琼脂培养基表面,用无菌镊子夹取常用抗生素的药敏纸片,分别贴到琼脂平板表面,先将平板中央放一张药敏片,周围分布均匀放四张,37 ℃培养。用毫米刻度尺测量抑菌圈的大小,结果与标准结果进行对比。参考标准见表2。
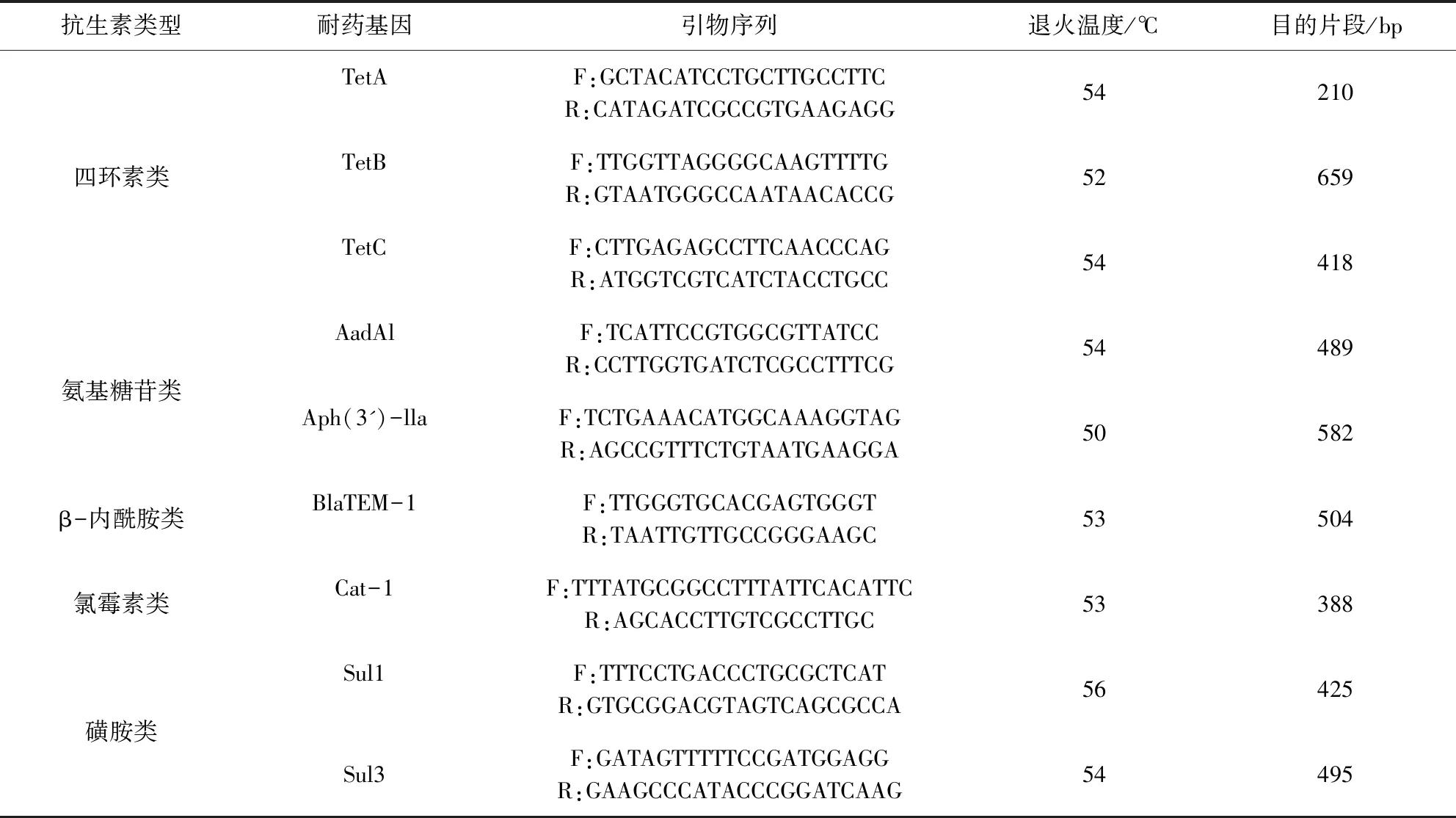
表1 PCR扩增耐药基因引物的序列Tab 1 primer sequence for PCR amplification of drug-resistant gene
RAPD多态性分析所用的引物序列为:AGCGGGCCAA;以上引物均由北京六合华大基因科技有限公司合成。
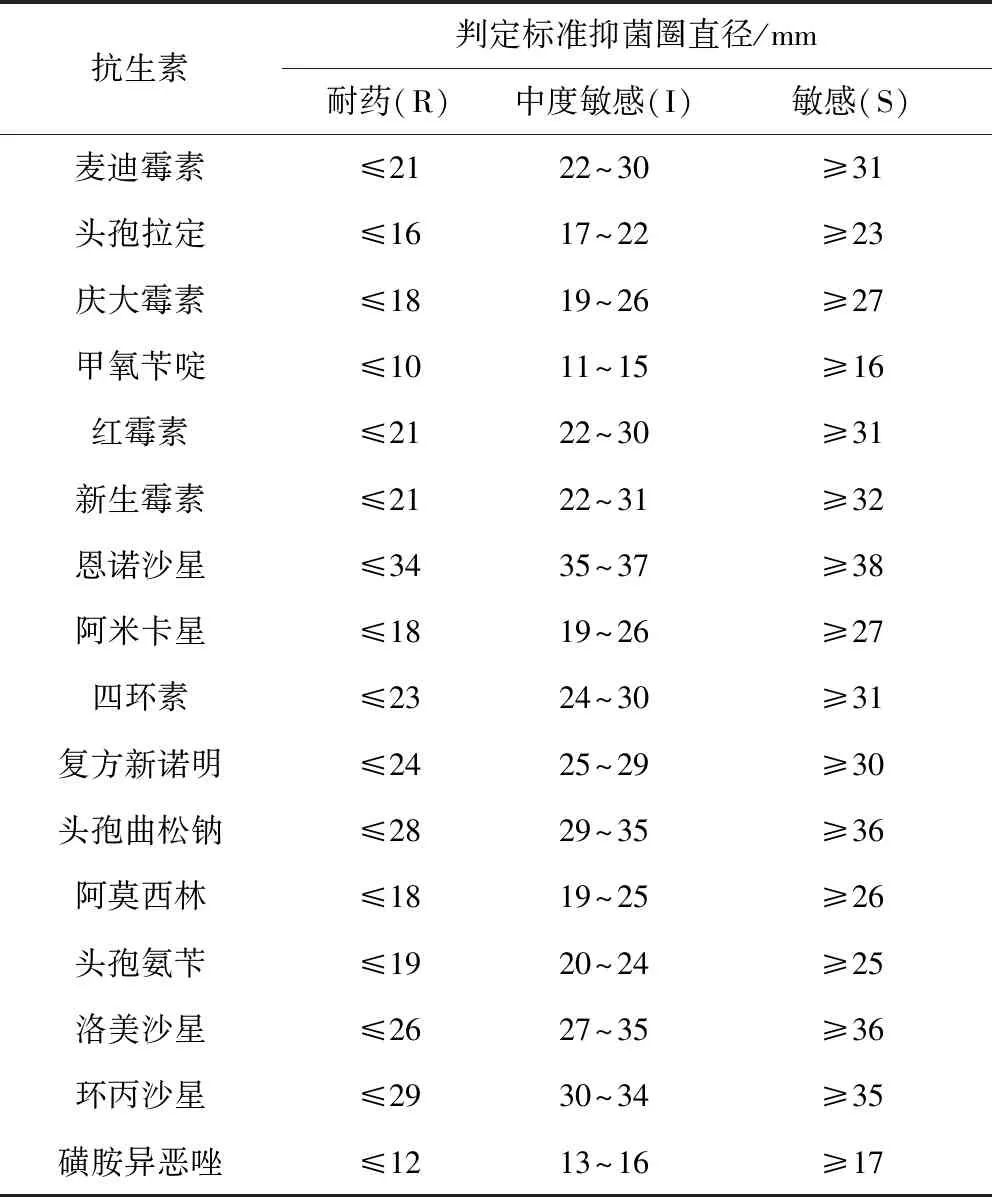
表2 抗生素的抑菌圈直径与敏感度参考标准Tab 2 Antibiotic Bacteriostasis Circle Diameter and Sensitivity reference standard
2.2 模板DNA的制备 利用煮沸法提取细菌的基因组DNA。取过夜培养的大肠杆菌菌液600 μL,10000 r/min离心2min,弃上清,加300 μL ddH2O,以相同的转速离心后弃上清,再加150 μL ddH2O,沸水煮10 min,离心取上清,置于-20 ℃备用。
2.3 大肠杆菌基因PCR的扩增 耐药基因扩增体系20 μL:Premix Taq 10 μL,上下游引物各0.5 μL,模板DNA 1 μL,用ddH2O补平至20 μL。PCR反应程序:预变性95 ℃ 5 min,95 ℃ 40 s,不同退火温度(温度见表1),72 ℃ 45 s,34个循环;终末延伸72 ℃ 10 min。对PCR产物进行1%琼脂糖凝胶电泳。
2.4 基因多态性分析的PCR扩增 随机引物扩增体系25 μL:Premix Taq 12.5 μL,引物1 μL,模板DNA 1 μL,用ddH2O补平至25 μL。PCR反应程序:预变性95 ℃ 5 min,95 ℃ 1 min,36 ℃ 5 min,72 ℃ 5 min,4个循环;95 ℃ 1 min,36 ℃ 1 min,72 ℃ 2 min,30个循环,终末延伸72 ℃ 10 min。对PCR产物进行1%琼脂糖凝胶电泳。
3 结果与分析
3.1 分离株药敏试验 对分离的阴性致病性大肠杆菌菌株进行药敏试验,结果表明21株大肠杆菌对四环素、红霉素、麦迪霉素、阿莫西林、磺胺异恶唑、复方新诺明、环丙沙星、恩诺沙星、新生霉素、甲氧苄啶耐药率为100%;对庆大霉素、洛美沙星耐药率为80%以上;阿米卡星、头孢氨苄、头孢曲松钠、头孢拉定在40%~70%。其中,对氨基糖苷类敏感的菌株为菌株1、6、8、9、11、16、20;对β-内酰胺类敏感的菌株为菌株1、2、5、12、13、15、18、19;对喹诺酮类敏感的菌株为菌株10、19(表3)。

表3 大肠杆菌菌株对抗生素的敏感性试验Tab 3 Antimicrobial susceptibility test of Escherichia coli against antimicrobial drugs
3.2 分离株耐药基因的PCR扩增 对分离鉴定的21株猪源致病性大肠杆菌进行了四环素类、氨基糖苷类、β-内酰胺类、氯霉素类、磺胺类9种耐药基因的扩增。其中TetA、TetB、BlaTEM-1耐药基因的菌株数检出率为100%;Sul3耐药基因的菌株检出率为85.71%;Aph(3’)-Ⅱa耐药基因的菌株检出率为76.19%;AadA1耐药基因的菌株检出率为57.14%;Sul1耐药基因的菌株检出率为38.09%;Cat1耐药基因的菌株检出率为19.04%;而TetC耐药基因未被检测到(表4)。
3.3 多态性分析的PCR扩增 对分离鉴定的21株大肠杆菌(图1)进行限制性片段多态性分析。根据指纹图谱的条带数目和位置,可以将21株分离株分为7个基因型。2、7、9命名为Ⅰ型,占14.3%;3、21命名为Ⅱ型,占9.5%;4、5命名为Ⅲ型占9.5%;6、11、12命名为Ⅳ型,占14.3%,占9.5%;8、22命名为V型,占9.5%;10、13、18、19、20命名为VI型,占23.8%;14、15、16、17命名为VII型,占19%。

表4 分离株耐药基因检测结果Tab 4 Detection results of drug resistance genes in isolates

M:DL2000 Marker;1:水对照;2-22:分离株分析结果M: DNA Marker Ladder (DL 2000); 1: Water Control; 2-22: Analysis results of isolates图1 分离菌株RAPD多态性分析电泳图谱Fig 1 RAPD polymorphism analysis of isolated strains
4 讨论与结论
大肠杆菌是肠杆菌科的重要成员,能引起动物的大肠杆菌病。近些年,抗生素的滥用或不合理运用,使大肠杆菌耐药基因不断出现。从最初的单一耐药,耐药率低,传播速度缓慢,到如今变为耐药谱宽,耐药率高,耐药性传播速度快的局面[2]。本研究对豫北地区分离的大肠杆菌菌株进行了药敏实验,结果表明分离株对四环素、红霉素、麦迪霉素、阿莫西林、磺胺异恶唑、环丙沙星、新生霉素、复方新诺明、恩诺沙星、甲氧苄啶的耐药程度较高,耐药率均为100%,这一结果与艾伟昌等[3]报道的河南省猪源大肠杆菌对四环素、磺胺异恶唑、复方新诺明的耐药率分别为97.7%、97.7%、90.6%结果相近,提示该地区临床应禁用这些药物,加强这些药物在该地区的使用监管。同时,对于恩诺沙星的耐药率,本研究显著高于艾伟昌等[3]的报道,这表明大肠杆菌的耐药机制可能与同一地区的饲养管理条件及抗生素使用种类存在广泛的联系。同时发现分离自安阳各县的菌株对氨基糖苷类抗生素较为敏感,分离自焦作各区县的菌株对β-内酰胺类抗生素较为敏感,这为相应地区防治猪源大肠杆菌临床用药提供了参考。菌株的多重耐药也是近年来抗生素难以奏效的重要因素。有报道指出,河南省规模化猪场大肠杆菌耐药现象非常严重,耐药谱较广,并且呈现不同程度的多重耐药,每种菌株至少对3种抗生素耐药[9]。本研究结果与该报道一致。本研究表明多重耐药在分离株中普遍存在。这可能是由于细菌处于相同的药物选择压力下,导致相似耐药谱型的出现[10]。建议临床中合理用药,同时采取多种用药方式以减轻对大肠杆菌的选择性压力,降低细菌产生耐药性的概率[11]。
四环素类、氨基糖苷类、大环内酯类、β-内酰胺类等抗生素是临床防治大肠杆菌的首选药物。多年的滥用或不合理运用使大肠杆菌耐药基因不断出现。本研究对分离出的21株大肠杆菌进行了9种耐药基因的检测,结果表明四环素类TetA、TetB均为100%;氨基糖苷类AadA1、Aph(3’)-Ⅱa分别为57.14%、76.19%;β-内酰胺类BlaTEM-1为100%;氯霉素类Cat1为19.04%;磺胺类Sul1、Sul3分别为38.09%、85.71%。其中四环素类耐药基因TetB检测率高于张炳亮等[12]的报道;与王学君等[13]报道的四环素类耐药基因TetA检出率相当,这表明四环素耐药基因TetA可能成全国性分布,这与该类抗生素的不合理运用有关。同时,颜友荣[14]等的报道表明四环素类TetC耐药基因检出率为43.20%,而本研究并未检出该基因的存在,表明不同地区介导同一耐药性的耐药基因可能存在差异。氨基糖苷类耐药基因Aph(3’)-Ⅱa是常见的耐药基因之一,本研究检出率高于张炳亮等[12]的报道,低于晏云涛等[2]的报道,这可能与不同地区猪的年龄、性别和品种相关。
磺胺类药物具有与对氨苯甲酸相类似的分子结构,二者竞争性抑制二氢叶酸合成酶的活性,从而抑制细菌的生长与繁殖。Sul1基因在不同临床和环境分离菌株中存在,具有携带和传播磺胺抗性的作用[15-16]。Sul1和Sul3是已知的质粒编码的磺胺耐药基因,可产生二氢叶酸合成酶并诱导磺胺类药物的抗性[17], 二氢叶酸还原酶利用NADPH 还原二氢叶酸产生四氢叶酸,从而影响细菌核蛋白合成。细菌的耐药机制是十分复杂的。发现分离菌株对磺胺类完全不敏感,而磺胺类耐药基因Sul1和Sul3检出率分别为38.09%和85.71%,这可能是因为分离菌株含有其他耐药基因或存在其他耐药机制。本研究发现Sul3检出率较高,提示该基因可能是介导本地区猪源大肠埃希菌对磺胺类药物产生耐药性的主要基因型。氯霉素类药物是一种广谱抗生素,吸收快、体内分布广泛,在兽医临床上发挥着重要的作用,特别对大肠杆菌和沙门菌等革兰阴性菌有较强的抑菌作用[18]。氟苯尼考因其安全性和有效性在我国兽医临床上被广泛使用,是目前兽医临床主要应用的氯霉素类抗生素。本研究在分离株中检测到了氯霉素类耐药基因,表明该地区已出现耐药菌株,应做好该类抗生素的合理应用,避免耐药性跨种传播。耐药基因的检测有助于了解该地区流行株耐药基因存在的种类、数量及流行规律,从而丰富和完善猪源致病性大肠杆菌耐药性的分子流行病学资料,而目前国内外尚未见商品化的相关耐药基因检测试剂盒,这为研制PCR试剂盒奠定了基础。
随机扩增DNA多态性扩增(RAPD)技术曾被用于确定微生物感染的暴发流行、传染源及其遗传相差型等研究[19-20]。RAPD图谱具有较大相似性的菌株之间应该属于同一类群,反之则为不同的类群,因此,可以通过RAPD分型的方法来检测菌株之间同源性的高低。本研究的分型中,共得到7种不同的基因型,显示出该地区致病性大肠杆菌基因型的复杂性。同时,发现同一基因型的不同菌株对抗生素的敏感性存在较大差异,表明该地区大肠杆菌在抗生素选择压力下,其耐药性更加的复杂化。
本研究对豫北地区猪源致病性大肠杆菌的耐药性、耐药基因及分子分型做了研究,为全面了解豫北地区猪源致病性大肠杆菌的流行病学提供了参考数据,同时为该地区猪源大肠杆菌病临床针对性合理用药提供了实验依据。

