伊犁野生羊肚菌根际土壤微生物功能多样性分析
张相锋, 杨晓绒, 焦子伟
(伊犁师范学院 微生物资源保护与开发利用重点实验室,新疆 伊宁 835000)
羊肚菌隶属于子囊菌亚门(Ascomycotina),盘菌纲(Discomycetes),盘菌目(Pezizales),羊肚菌科(Morchellaceae),羊肚菌属 (Morchella)[1-2]。羊肚菌具有丰富的营养物质和较强的保健功能,具有增强肌体免疫力、抗疲劳、抗衰老、护胃、降血压和降血脂等作用,是一种珍贵、稀有的食药用真菌[3]。野生羊肚菌数量有限,过度采摘必然会导致数量急剧下降,为满足市场需求,人工栽培成为有效的解决途径。但在国内外羊肚菌人工栽培技术探索过程中,由于子实体发生受温度、湿度、土壤营养等环境因素的限制,其产量和品质的稳定性问题一直是无法攻克的难题[4]。 羊肚菌国内外人工栽培技术研究中都有一个共同的技术要点就是覆盖羊肚菌野外发生的土壤,否则不出菇。由此可见,羊肚菌的栽培不仅要求覆土,而且要求覆土中含有特定刺激其结实机制的有益因子[5]。土壤中除了营养物质外,对作物生长发育起主要影响的就是丰富的微生物。土壤微生物群落在维持营养方面起着至关重要的作用,土壤微生物多样性直接影响土壤酶活性进而影响土壤养分的代谢,决定土壤肥力[6-7]。国内羊肚菌专家朱斗锡于2001年最早提出人工栽培中的土壤伴生菌,他指出土壤伴生菌对羊肚菌人工栽培子实体起着非常重要的作用[8]。谢占玲等[9]于2008年采用平板培养法,对野生羊肚菌根际微生物进行了研究,发现克勒克酵母属是极为重要的微生物成员之一,并首次发现,毛霉是羊肚菌的伴生菌,该发现对羊肚菌子实体栽培有着极为重要的指导意义。土壤微生物多样性研究的方法很多,如变性梯度凝胶电泳(DGGE)[10]、末端限制性内切酶片段长度多态性(T-RFLP)[11]、磷脂脂肪酸法(PLFA )[12]、高通量测序(High-throughput sequencing)[13]、BIOLOG微平板技术[14]等。基于分子生物学的方法简便快捷,信息量大,无需分离培养就可以反映微生物的群落结构信息,但无法获得有关微生物群落总体活性与代谢功能的信息[14-21]。 BIOLOG-ECO方法从代谢的角度直观地反映微生物种群的总体活性,不可培养细胞对底物供应也有响应,可以明确环境微生物功能多样性的代谢特征,由于操作简单、获得数据量丰富,受到众多研究者的青睐[14,16-21]。BIOLOG-ECO在作物根际土壤微生物多样性研究方面得到广泛的应用[22-25]。而在野生羊肚菌根际土壤微生物多样性研究方面的应用鲜见报道。本研究用BIOLOG-ECO方法测定羊肚菌根际微生物群落结构,为促进羊肚菌人工栽培技术发展,提高产量和稳定性提供参考。
1 材料与方法
1.1 材料
1.1.1 取材区域概况 研究区域位于新疆伊犁昭苏县境内,选取羊肚菌多年高发区(81°24′39.06″E,43°05′52.65″N,海拔2 042 m),山坡雪松林下,黑色腐质土。
1.1.2 土壤样品采集 该区域野生羊肚菌采集后,根下分0~10 cm(土层1),10~20 cm(土层2),20~30 cm(土层3)三个土层采集土样,然后将相应土层土样混合放入自封袋于4 ℃冰箱保存备用。
1.2 方法
1.2.1 土壤处理 将不同土层土样在25 ℃条件下活化24 h,称取新鲜土样5 g置于无菌三角瓶中,加入45 mL无菌生理盐水,25 ℃、150 r/min恒温震荡30 min,静置30 min,取上清液稀释1 000倍为接种液[26]。
1.2.2 土壤微生物群落功能多样性测定 采用BIOLOGTM-ECO测试板(ECO MicroPlate,美国Matrix Technologies Corporation)分析微生物群落功能多样性。根据其化学特性将Biolog-ECO微平板31种碳源分为氨基酸类6种,羧酸类5种,糖类12种,聚合物类4种,胺类2种,酚类2种[27-28]。在超净工作台上,将1.2.1的接种液用八道排枪向ECO板各培养孔加入150 μL, 每张板每个样品3次重复。接种好的微孔板放入自制带透气孔的保鲜盒,底部铺6层湿纱布保湿。将保鲜盒置于25 ℃恒温培养箱中培养,分别于24、48、 72、96、120、144、168 h在Thermo ScientificTMMultiskanTMGO 全波长酶标仪读取OD590值。
孔的颜色平均变化率(Average well color development, AWCD):AWCD=∑(Ci-R)/n,式中Ci为第i个非对照孔的吸光值,R为对照孔的吸光值,n为培养基碳源种类数,本实验为31种碳源。
Shannon-Wiener多样性指数(H′):H′=-∑PilnP,式中Pi表示第i个非对照孔中的吸光值与所有非对照孔吸光值总和的比值。
丰富度指数(S)是指被利用的碳源的总数目,该研究中为每孔中(Ci-R)的值大于0.1的孔数。
Pielou均匀度指数(E):E=H′/lnS,式中S为被利用的碳源总数。
Simpson优势度指数(D):D=1-∑P2i。
McIntosh 指数(U)是基于群落物种多维空间上的 Euclidian 距离的多样性指数,U=∑ni2,式中,ni 是第 i 孔的相对吸光值(C-R)。
1.2.3 数据处理 数据处理采用SPSS 22.0软件和CANOCO 4.5进行分析,采用EXCEL2007软件作图。用方差分析不同采样土层土壤微生物AWCD之间差异。微生物AWCD值在0~96 h变化趋势相对稳定,参考郑丽萍等[20]的方法选取了72 h的数据进行分析,用主成分分析微生物群落利用碳源差异[29],统计分析概率为P<0.05。
2 结果与分析
2.1 土壤微生物碳源利用动力学分析
2.1.1 各土层土壤微生物AWCD变化特征 AWCD是衡量微生物利用单一碳源能力的重要指标,反映了土壤微生物代谢活性的强弱。由图1可以看出,随着培养时间的延长,各土层微生物利用碳源能力呈逐渐增加,在观测周期内的AWCD持续升高。3个土层AWCD变化趋势表现为土层1>土层2>土层3,其中土层1的变化趋势显著高于土层2和土层3,但土层2和土层3的总体变化趋势差异不显著。从图1还可以看出,在培养时间为72 h时3个土层AWCD值存在显著差异(P<0.05),仍然表现为土层1>土层2>土层3,因此后续一些特征数的计算均采用培养72 h的数据来进行。
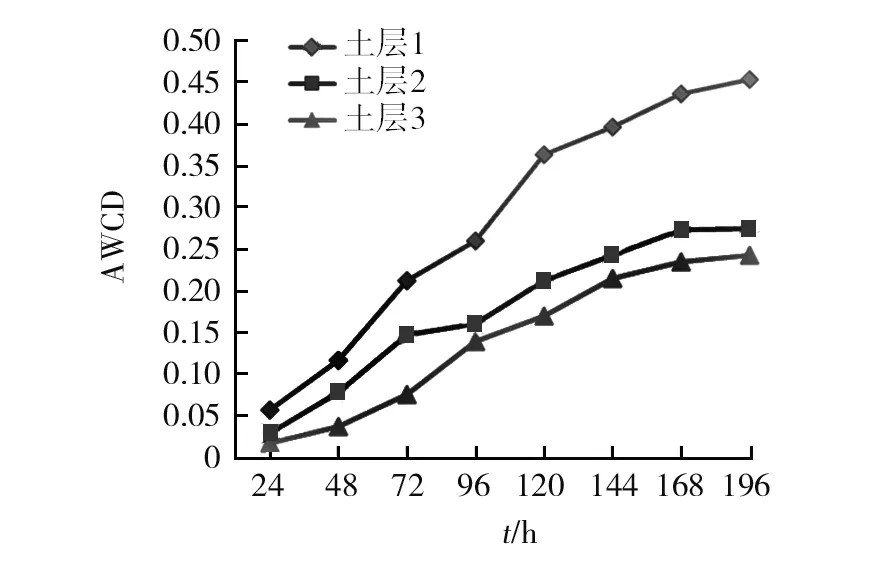
图1 羊肚菌根际土壤微生物群落AWCD变化Fig.1 AWCD changes of soil microflora in the rhizosphere of WildMorchella
2.1.2 各土层土壤微生物对各类碳源的利用特征 Biolog代谢指纹图谱是指微生物对ECO板上不同碳源的利用能力图,从图2可以看出随着培养时间的延长,各土层对六大类碳源的利用率逐渐增加,总体表现为利用6种碳源总能力为土层1>土层2>土层3,这与3个土层AWCD动态变化趋势一致,但是3个土层对糖类碳源的利用率均不高。
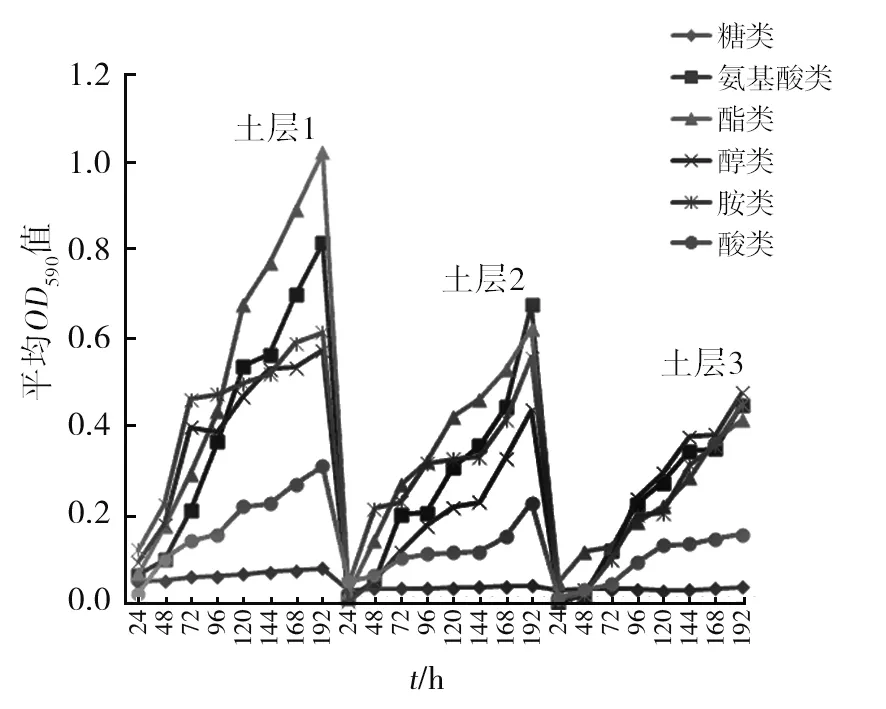
图2 不同土层根际微生物对Biolog-ECO板31种碳源利用动态Fig.2 Dynamics of utilization of 31 carbon sources in biolog-eco plates byMorchellarhizosphere soil microorganisms in different soil layers
图3所示为培养72 h、单一碳源利用情况。对于氨基酸类碳源,土层1对L-精氨酸、L-苯丙氨酸、L-丝氨酸、L-苏氨酸的利用能力远远大于土层2和土层3。土层3对L-天冬氨酸利用能力高于其他2个土层。土层2对甘氨酰-L-谷氨酸利用能力略高于土层1,差异不明显,但二者均显著高于土层3。综合评估3个碳源对氨基酸类碳源利用能力是土层1>土层2>土层3,这与前面的两个结果保持一致。
对于多聚物类碳源的利用情况,土层1对吐温-40、吐温-80级肝糖原利用能力均高于其他2个土层,仅有α-环式糊精的利用土层2高于其他2个土层。而且综合评估3个土层对聚合物类碳源利用能力仍然是土层1>土层2>土层3,这与前面的两个结果也保持一致。
对于羧酸类碳源的利用,3个土层差异不大,仅在γ-羟基丁酸和D-葡萄胺酸差异较明显。对于糖类碳源3个土层仅在D-甘露醇、N-乙酰基-D-葡萄胺和D,L-α-甘油三种糖类碳源利用上存在显著差异,表现为土层1>土层2>土层3,但是其他糖类碳源3个土层差异不明显。对于胺类碳源利用,土层1显著高于其他2个土层。对于酚酸类碳源的利用,土层3显著高于其他2个土层。
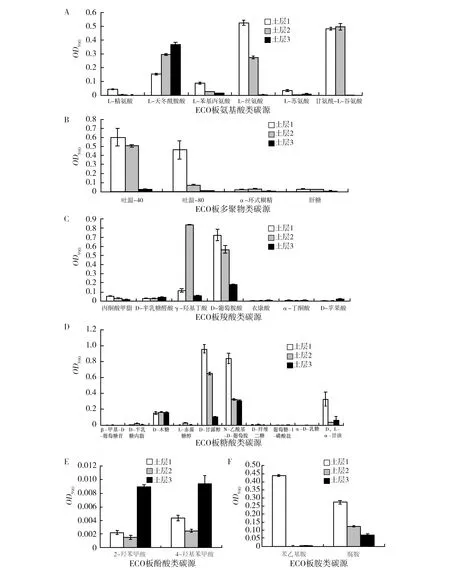
图3 羊肚菌不同土层根际土壤微生物对31种碳源的利用Fig.3 Utilization of 31 carbon sources by Morchellarhizosphere soil microorganisms in different soil layersA:羊肚菌根际不同土层微生物对氨基酸类碳源的利用;B:羊肚菌根际不同土层微生物对多聚物类碳源的利用;C:羊肚菌根际不同土层微生物对羧酸类碳源的利用;D:羊肚菌根际不同土层微生物对糖类碳源的利用;E:羊肚菌根际不同土层微生物对酚酸类碳源的利用;F:羊肚菌根际不同土层微生物对胺类碳源的利用A:Utilization of carbon source of amino acids byMorchellarhizosphere soil microorganisms in different soil layers;B:Utilization of carbon source of polymer byMorchellarhizosphere soil microorganisms in different soil layers;C:Utilization of carboxyl carbon source byMorchellarhizosphere soil microorganisms in different soil layers;D:Utilization of carbohydrate carbon source byMorchellarhizosphere soil microorganisms in different soil layers;E:Utilization of carbohydrate carbon source byMorchellarhizosphere soil microorganisms in different soil layers;F:Utilization of amine carbon source byMorchellarhizosphere soil microorganisms in different soil layers
2.1.3 羊肚菌根际土壤微生物群落利用碳源的主成分分析 根据主成分分析(图4),第1主成分为63.29%,第2主成分为34.78%,共占98.07%。不同土层间距离的大小表示土层间的相似程度,距离越近相似程度越高。土层1、土层2及土层3三土层间距离基本相当,说明其差异性相当。不同土层在不同碳源投影点的相对位置(箭头)代表该碳源在该类型的重要程度,即大小程度,顺着箭头的方向,表示重要程度越大,反之,表示重要程度越小。从图4中可以明显看出,与土层1相关的碳源类型远远高于土层2和土层3,土层2相关的碳源类型高于土层3。
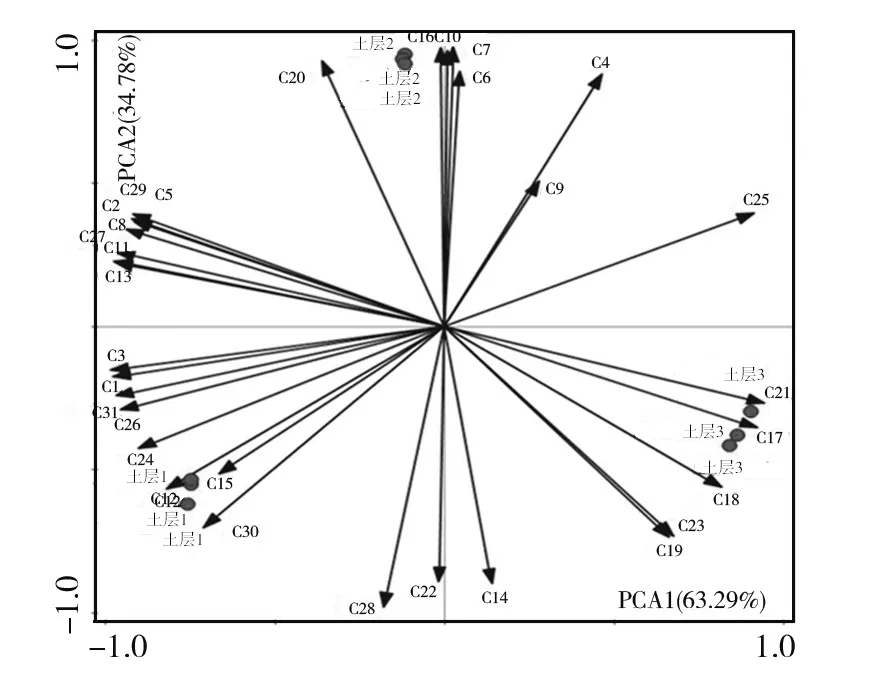
图4 野生羊肚菌根际土壤微生物碳源利用PCA分析Fig.4 PCA analysis of microbial carbon sources in rhizosphere soil of wildMorchella C1:丙酮酸甲脂;C2:吐温-40;C3:吐温-80;C4:α-环式糊精;C5:肝糖;C6:D-纤维二糖;C7:α-D-乳糖;C8:β-甲基D-葡萄糖苷;C9:D-木糖;C10:I-赤藻糖醇;C11:D-甘露醇;C12:N-乙酰基-D-葡萄胺;C13:D-葡萄胺酸;C14:葡萄糖-1-磷酸盐;C15:D,L-α-甘油;C16:D-半乳糖内酯;C17:D-半乳糖醛酸;C18:2-羟苯甲酸;C19:4-羟基苯甲酸;C20:γ-羟基丁酸;C21:衣康酸;C22:α-丁酮酸;C23:D-苹果酸;C24:L-精氨酸;C25:L-天冬酰胺酸;C26:L-苯基丙氨酸;C27:L-丝氨酸;C28:L-苏氨酸;C29:甘氨酰-L-谷氨酸;C30:苯乙基胺;C31:腐胺C1:Pyruvic Acid Methyl Ester;C2:Tween-40;C3:Tween-80;C4:α-Cyclodextrin;C5:Glycogen;C6:D-Cellobiose;C7:α-D-Lactose;C8:β-Methyl-D-Glucoside;C9:D-Xylose;C10:I-Erythritol;C11:D-Mannitol;C12:N-Acetyl-D-Glucosamine;C13:D-Glucosaminic Acid;C14:Glucose-1-Phosphate;C15:D,L-α-Glycerol;C16:D-Galactonic Acid y-Lactone;C17:D-Galacturonic Acid;C18:2-Hydroxy Benzoic Acid;C19:4-Hydroxy Benzoic Acid;C20:γ-Hydroxybutyric Acid;C21:Itaconic Acid;C22:α-Ketobutyric Acid;C23:D-Malic Acid;C24:L-Arginine;C25:L-Asparagine;C26:L-Phenylalanine;C27:L-Serine;C28:L-Threonine;C29:Glycyl-L-Glutamic Acid;C30:Phenylethyl-amine;C31: Putrescine
2.2 各土层土壤微生物多样性指数比较分析
由图5可以看出土层1在AWCD、多样性指数U、多样性指数H′、丰富度指数S、均匀度指数E及优势度指数D六项指标上与其他2个土层存在显著差异(P<0.05),其中AWCD、多样性指数U、多样性指数H′、丰富度指数S、优势度指数D均显著高于其他2个土层。均匀度指数E表现为土层3显著高于其他2个土层(P<0.05),土层1的均匀度指数最低,均匀度指数越高,菌落一致性越好,但是多样性越低,这从另外一个方面反映了土层1的微生物功能多样性是最丰富的。多样性指数结果表现为土层1>土层2>土层3,这与碳源利用的主成分分析结果是一致的。
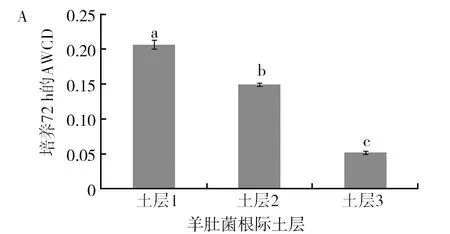
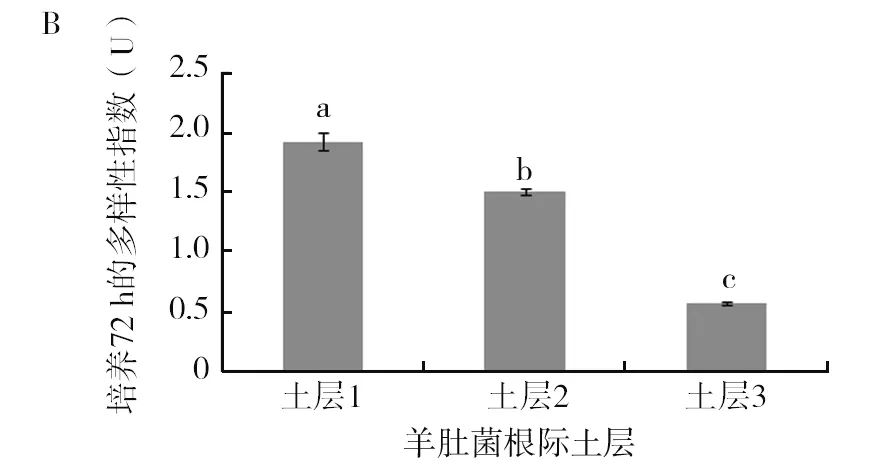
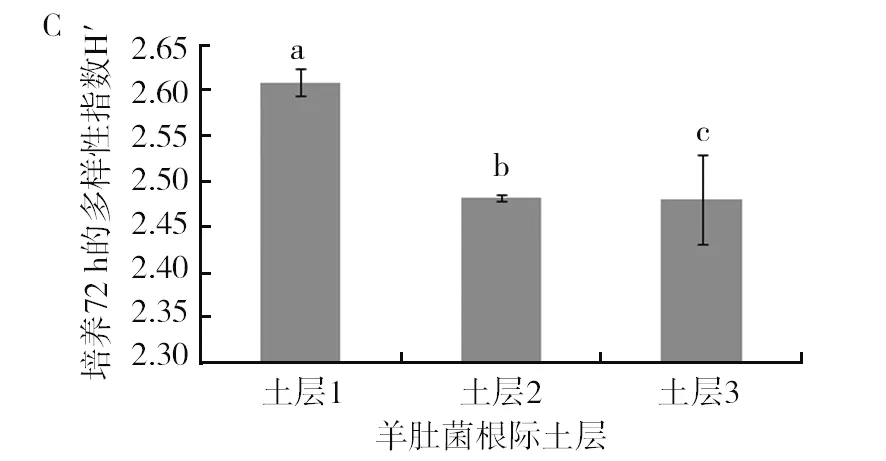
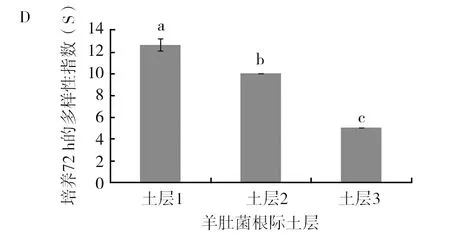
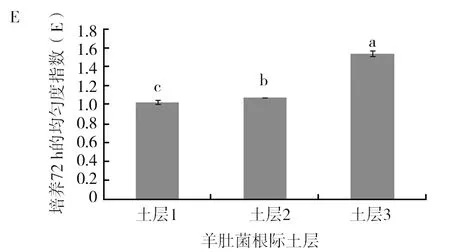
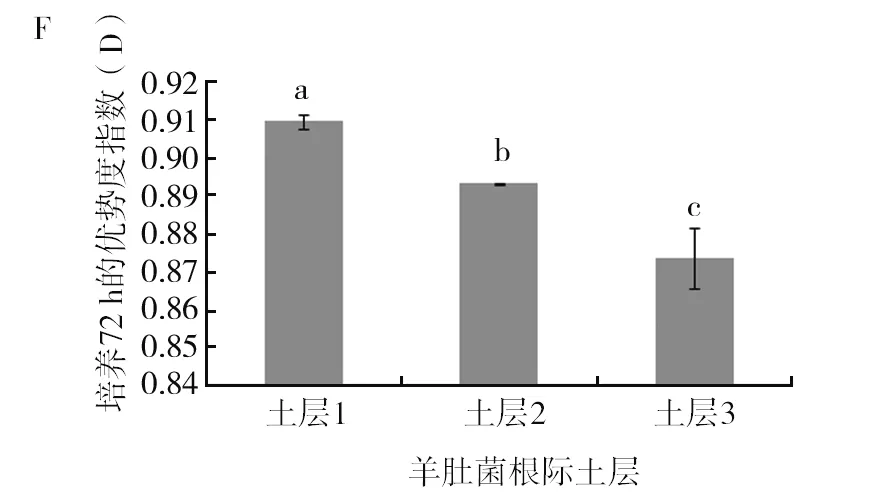
图5 羊肚菌不同土层根际土壤微生物培养72 h的各种指标比较Fig.5 Comparison of various indexes ofMorchellarhizosphere soil microorganisms in different soil layers after 72 h culture
3 讨 论
菌根土壤与非菌根土壤微生物多样性差别不大[30-31],但是在仿生栽培过程中覆盖羊肚菌发生地表层土壤确实有促进羊肚菌发生的现象。虽然羊肚菌的发生受多种因素的影响,其中包括温度、湿度、土壤等多个方面,土壤因素包括土壤理化因素和生物因素,而土壤理化因素和生物因素之间是相互影响的。生物因素主要是指土壤中的微生物。
在自然条件下,羊肚菌对环境条件具有特殊而又严格的要求,只有在特定环境条件下才能产生,而羊肚菌子实体发生的先导因素是土壤中是否存在能够产生菌核的因子,决定羊肚菌菌核产生的因素,除了温度和湿度外,就是土壤微生物因素所起的诱导作用。菌根土壤中一些微生物可能会对羊肚菌子实体的形成产生影响,但不是决定因素。在羊肚菌人工栽培过程中,通过环境条件的严格控制,虽然能够保证土壤中产生大量的菌核,但是菌核不一定都能形成子实体。而子实体能否形成的关键是找到刺激菌核萌发的土壤微生物因素[32]。因此,在人工栽培过程中,寻找土壤中的微生物诱导因素具有更重要的研究价值。我们借助于Biolog-ECO方法从微生物代谢的角度来解释羊肚菌根际土壤不同土层深度微生物功能多样性的差别,进一步缩小影响羊肚菌发生的影响因素范围。通过对羊肚菌根际不同土层AWCD动态变化、不同土层碳源利用特征及多样性指数分析均表明:①羊肚菌根际土壤微生物不同土层AWCD随培养时间的延长而呈增加趋势,符合微生物培养过程中的增长曲线。从3个土层AWCD总体变化曲线来看土层1>土层2>土层3,这表明土层1的微生物代谢活性最强;②从羊肚菌根际不同土层微生物对不同碳源利用特点来看,土层1能够利用的碳源类型最多,利用碳源能力最强,总体表现为土层1>土层2>土层3;③从羊肚菌根际不同土层微生物多样性指数分析结果来看,土层1的AWCD、多样性指数U、多样性指数H′、丰富度指数S、优势度指数D均显著高于其他2个土层。均匀度指数E表现为土层2显著高于其他2个土层。均匀度指数越高,菌落一致性越好,但是多样性越低,从另外一个方面反映了土层1的微生物功能多样性是最丰富的。由此我们可以得出羊肚菌根际土壤微生物功能多样性表现为土层1>土层2>土层3。在野生羊肚菌采集过程中,我们观察了羊肚菌菌根分布范围,菌根分布深度一般不超过土壤深度的30 cm,而且绝大部分菌根分布于土层的表层即10 cm左右。因此将羊肚菌根际土层分为0~10 cm、10~20 cm、20~30 cm三个土层进行采样,然后进行对比研究。 而研究的结果也表明了这3个土层在微生物功能多样性方面的确存在显著差异,并且表层土壤(土层1)的微生物功能多样性最强,这与熊川等[32]2015年的研究结果一致。羊肚菌根际不同土层土壤在理化性质方面可能存在较大差异,从而导致其微生物多样性产生不同,进一步影响了羊肚菌菌根的土层分布,而表层土壤中特殊的微生物菌落又影响了羊肚菌子实体的发生。
Biolog-ECO方法只能从代谢特性角度反映微生物功能多样性,不能反映具体种属多样性。而利用土壤微生物培养研究微生物多样性虽然能够在一定程度上反映土壤微生物种属多样性,但是对于不可培养的微生物无法通过培养获取。因此要想全面、准确的反映土壤微生物多样性,找到土壤中对羊肚菌子实体发生起诱导作用的微生物因素,还需借助于高通量测序技术进行进一步的研究。

