小鼠鸡卵巢颗粒细胞分离培养方法的比较与优化
扆妍妍,侯雅鑫,张宇瞳,孙 娜,孙耀贵,李宏全
(山西农业大学动物科技学院,山西 太谷 030801)
卵巢颗粒细胞是组成卵泡的重要体细胞,主要参与调控卵泡生长发育、类固醇激素生成等重要生理过程[1-4]。在动物一生中,卵巢不同发育阶段的超过99%的卵泡将在排卵前发生退化或卵泡闭锁,只有大约1%的卵泡能成功排卵[5]。而颗粒细胞凋亡被认为是卵巢卵泡闭锁的主要机制,在卵泡命运中起关键作用[6]。同时颗粒细胞的异常会引起不同生殖疾病,对于畜禽繁殖造成极大的影响[7-8]。因此颗粒细胞的体外培养对于研究畜禽生殖疾病等至关重要。本试验通过体外培养小鼠、鸡不同等级卵泡颗粒细胞,分析不同种属动物体外分离、培养颗粒细胞的方法差异,并进行适当优化,为培养不同畜禽卵巢颗粒细胞提供参考。
1 材料与方法
1.1 实验动物 3周龄雌性昆明系小鼠,SPF级,由北京市昌扬西山养殖场提供。200日龄海蓝褐蛋鸡,由太谷县北洸规范化商品蛋鸡养殖场提供。
1.2 试验试剂与仪器 孕马血清促性腺激素,购自宁波三生药业有限公司;DME/F-12 1∶1(1X)培养基和M199培养基,购自Hyclone公司;Ⅱ型胶原酶、鼠尾胶原、青链霉素混合液、细胞组织固定液、正常山羊血清、Triton-100,购自北京索莱宝科技有限公司;胎牛血清,购自以色列Biological Industries公司;激光共聚焦35皿,购自NEST公司;Mouse Anti-rabbit IgG/FITC antibody、FSHR Antibody Rabbit Polyclonal,购自武汉 Proteintech公司;DAPI染色液,购自Beyotime公司;主要仪器有离心机(德国Sigma公司);倒置荧光显微镜(日本Olympus公司);CO2培养箱(中国 Heal force 公司)。
1.3 主要试剂配制 小鼠卵巢颗粒细胞培养-完全培养基:DME/F-12 1∶1(1X)+10% 胎牛血清+1%青链霉素混合液;操作液;DME/F-12 1∶1(1X)+3%胎牛血清+1%青链霉素混合液;鸡卵泡颗粒细胞培养;完全培养基:M199+10% 胎牛血清+1%青链霉素混合液。
1.4 小鼠卵巢颗粒细胞的分离及原代培养 选取发情前期的3周龄雌性昆明系小鼠,腹腔注射8 IU孕马血清促性腺激素(PMSG),46~48 h后颈椎脱臼处死,75%酒精棉球腹部消毒;无菌条件下将小鼠沿腹中线处剪开,充分暴露腹部,切开腹膜,将内脏向上翻,暴露两侧卵巢和输卵管;用眼科镊夹住子宫与输卵管连接部位,将包裹卵巢的膜撕开,眼科镊夹住,即可取出双侧卵巢,迅速放入含有PBS(37℃预热)的35 mm培养皿中,用PBS清洗3次,转入含有操作液的35 mm培养皿中,若所需卵巢数量较多,采集应分批进行并将已采集卵巢组织置于37℃培养箱中保存;用1 mL的注射器针头刺破卵巢上卵泡,使得颗粒细胞释放出来;200目过滤操作液,1 000 r/min离心5 min,弃上清,PBS清洗3次,1000 r/min离心5 min,加入完全培养基DMEM/F12重悬;吸取台盼蓝溶液按1∶9比例加入细胞悬液中染色,血球计数板计活细胞数,调整细胞数量,按照5×105/mL细胞接种到6孔细胞培养板中,混匀,放置在5%CO2、37℃培养箱中培养。24 h后观察细胞贴壁及生长情况。
1.5 鸡等级卵泡颗粒细胞的分离及原代培养 产蛋高峰期蛋鸡,禁食禁水12 h,颈静脉放血致死,取出卵巢组织,生理盐水清洗3遍,置于盛有预冷PBS的灭菌烧杯中;将大于9 mm的卵泡分离到含有预冷PBS的玻璃皿中,剥离卵泡外膜、结缔组织及血管网,在卵泡上剪开一个1 cm左右的小口,将大部分卵黄倒出,用眼科镊从开口处将卵泡外翻,可见一层透明膜,即为颗粒层;PBS冲洗分离的颗粒层,尽量将卵黄漂洗干净,转移至安瓿瓶中;将颗粒层剪碎至1 mm3以下,加入适量Ⅱ型胶原酶,放入37℃培养箱中消化5 min,每隔1 min晃动安瓿瓶使消化均匀,消化完毕后加入与等体积预冷M199培养基终止消化;200目滤网过滤至10 mL EP管中,1 000 r/min离心8 min,弃上清,加入M199培养基重悬,再次离心,重复两次,以除去残余酶液及杂质;台盼蓝染色后计活细胞数,按8×105个/mL接种于6孔板内,24 h后观察细胞生长状况。
1.6 鸡小黄卵泡颗粒细胞的分离及原代培养 蛋鸡选取参考1.5,在无菌的条件下,取8~10枚小黄卵泡,PBS清洗干净,除去周围结缔组织;用剪刀将小黄卵泡剪开一个小口,轻轻按压卵泡,释放卵黄,PBS清洗两次,尽可能地去除卵黄颗粒;将清洗后的卵泡转移至安瓿瓶中,剪成1 mm3左右大小的组织块;加入适量的12.5 μg/mLⅡ型胶原酶,37℃消化8~10 min,之后加入等量的M199基础培养基终止消化;200目滤网过滤,1 000 r/min离心8 min,弃上清;M199基础培养基重悬颗粒细胞,1 000 r/min离心8 min,弃上清,基础培养基洗两次,除去残存的胶原酶;使用M199完全培养基重悬细胞;台盼蓝染色计活细胞数,细胞存活率在90%以上,按5×105个/mL接种于用鼠尾胶原预铺的6孔板内,24 h后观察细胞生长状况。
1.7 颗粒细胞的鉴定
1.7.1 H.E.染色 取生长旺盛第5天的小鼠卵巢颗粒细胞、第3天的鸡等级卵泡颗粒细胞使用0.25%含EDTA的胰酶在37℃培养箱中消化30 s,弃去胰酶,使用培养基终止消化并重悬细胞,接种于细胞爬片上,继续培养48 h后PBS清洗3 min×3次;4%多聚甲醛4℃固定20 min,PBS清洗3 min×3次;H.E.染色:苏木精染色2 min,1%盐酸分化30 s,氨水返蓝2 min;梯度酒精脱水:70%乙醇2 min→80%乙醇2 min→90%乙醇2 min→95%Ⅰ乙醇4 min→95%Ⅱ乙醇4 min→100%Ⅰ乙醇5 min→100%Ⅱ乙醇5 min→二甲苯Ⅰ10 min→二甲苯Ⅱ10 min;中性树脂封片,显微镜下观察。
1.7.2 FSHR的表达鉴定 将胰酶消化后的细胞接种于细胞爬片上,培养48 h后取出爬片,PBS洗涤3 min×3次;冰无水乙醇4℃固定20 min,PBS清洗3 min×3次;0.2%Triton×-100细胞通透液,在室温条件下摇床上孵育通透15 min,PBS清洗3 min×3次;3%正常山羊血清37℃封闭30 min,PBS清洗3 min×3次;加入100 μL FSHR兔多克隆抗体(1∶50),37℃孵育2 h,PBS清洗5 min×3次;加入100 μL FITC标记的鼠抗兔抗体(1∶100),37℃孵育1 h,PBS清洗5 min×3次;使用抗荧光衰减封片剂(DAPI)封片,激光共聚焦拍照。
2 结果
2.1 不同种属卵巢颗粒细胞分离培养方法比较及优化

表1 鸡、小鼠卵巢颗粒细胞提取方法比较
由表1可知,小鼠与鸡不同等级卵巢颗粒细胞的提取方法不同,且操作过程中需要的培养基及操作液也不相同。采用合适的方法提取不同种属卵巢颗粒细胞对于体外培养颗粒细胞尤其重要。
同时在试验过程中对提取步骤进行优化,将取出的小鼠卵巢放置于含有胎牛血清的操作液中进行刺破以释放颗粒细胞,与在只含有PBS的操作液中刺破卵泡相比,24 h细胞贴壁增多,48 h生长良好,对比培养结果见图1。培养鸡小黄卵泡颗粒细胞时,将细胞分别接种于鼠尾胶原预铺板和普通细胞培养板,普通板细胞24 h也均贴壁完全,但贴壁状况与鼠尾胶原预铺板相比,贴壁较差,细胞较少,图2为培养48 h后细胞生长状态对比结果。鼠尾胶原预铺板细胞24 h时均已贴壁,生长状况良好;24~48 h期间,细胞迅速增长,48 h时,细胞铺满6孔板整个孔,见图3。
2.2 不同种属卵巢颗粒细胞形态学比较 由图3可知分离提取出的小鼠卵巢、鸡等级卵泡、鸡小黄卵泡颗粒细胞在24 h观察时均贴壁完全,且分离出的颗粒细胞所含杂质较少,48 h后细胞舒展,快速生长。表2为小鼠卵巢颗粒细胞、鸡等级卵泡颗粒细胞和鸡小黄卵泡颗粒细胞培养时细胞形态及生长特点的差异。可知不同种属或相同种属不同等级卵泡颗粒细胞生长状态均存在差异。
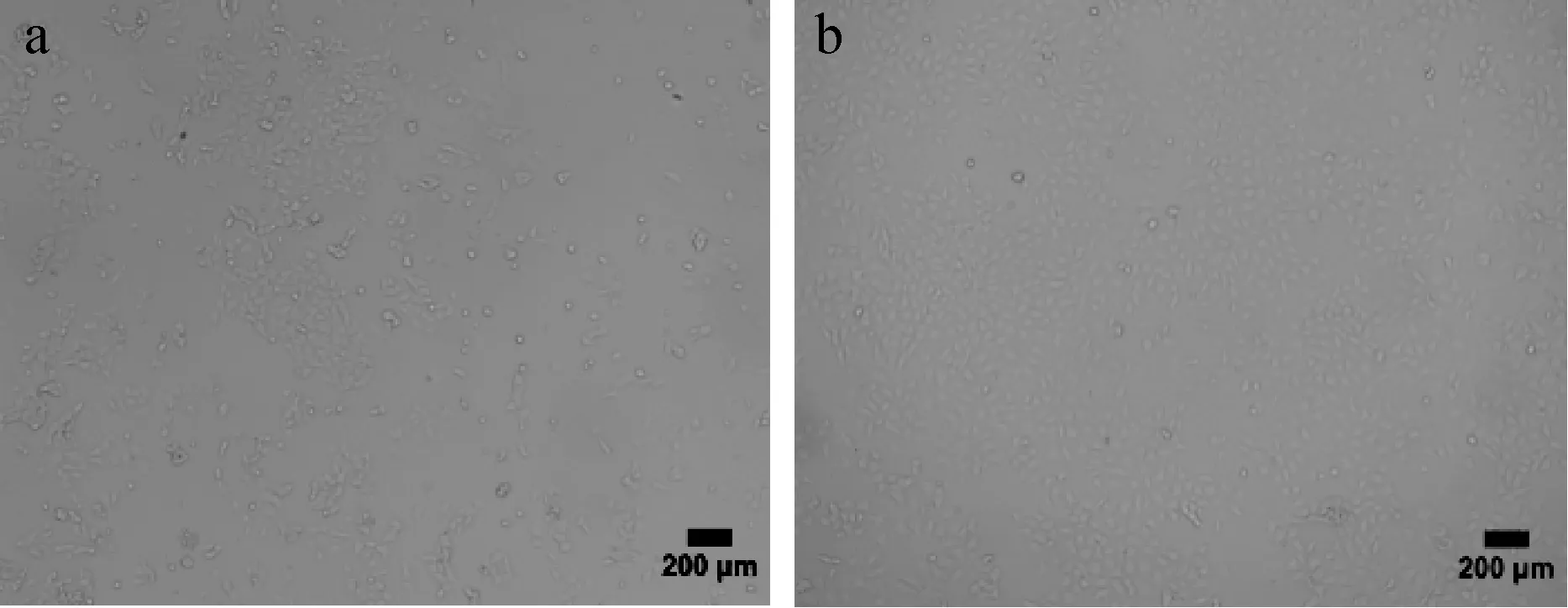
图1 小鼠卵巢颗粒细胞不同操作液培养48 h细胞生长状态
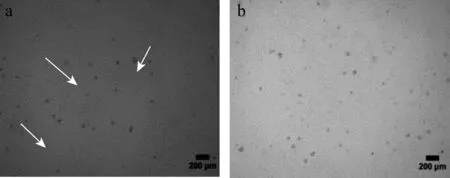
图2 不同条件下鸡小黄卵泡颗粒细胞生长48 h状态

图3 不同种属卵巢颗粒细胞原代培养的形态学观察

表2 鸡、小鼠卵巢颗粒细胞生长特点
2.3 颗粒细胞的鉴定 H.E.染色结果显示(见封二彩版图4),小鼠卵巢颗粒细胞贴壁后形态完整,大小均一,呈多角形或者梭形,细胞核深染呈椭圆形,胞浆染为淡红色。鸡等级卵泡和小黄卵泡颗粒细胞H.E.染色结果显示细胞形态完整,边缘清晰,呈短梭形或多角形,细胞核蓝色深染,胞浆淡染。
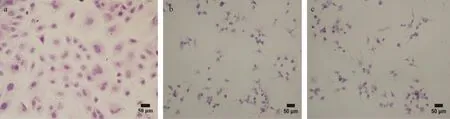
图4 不同种属卵巢颗粒细胞 (H.E.染色)
FSHR为卵巢颗粒细胞特异性表达蛋白,定位于胞浆,见封二彩版图5可知,绿色荧光均匀分布于胞浆中,细胞核染色清晰,结果显示大于95%的细胞被染上绿色荧光,为阳性结果。因此可鉴定所培养细胞均为卵巢颗粒细胞,且纯度达到95%以上。小鼠与鸡颗粒细胞的鉴定均以FSHR为标准。
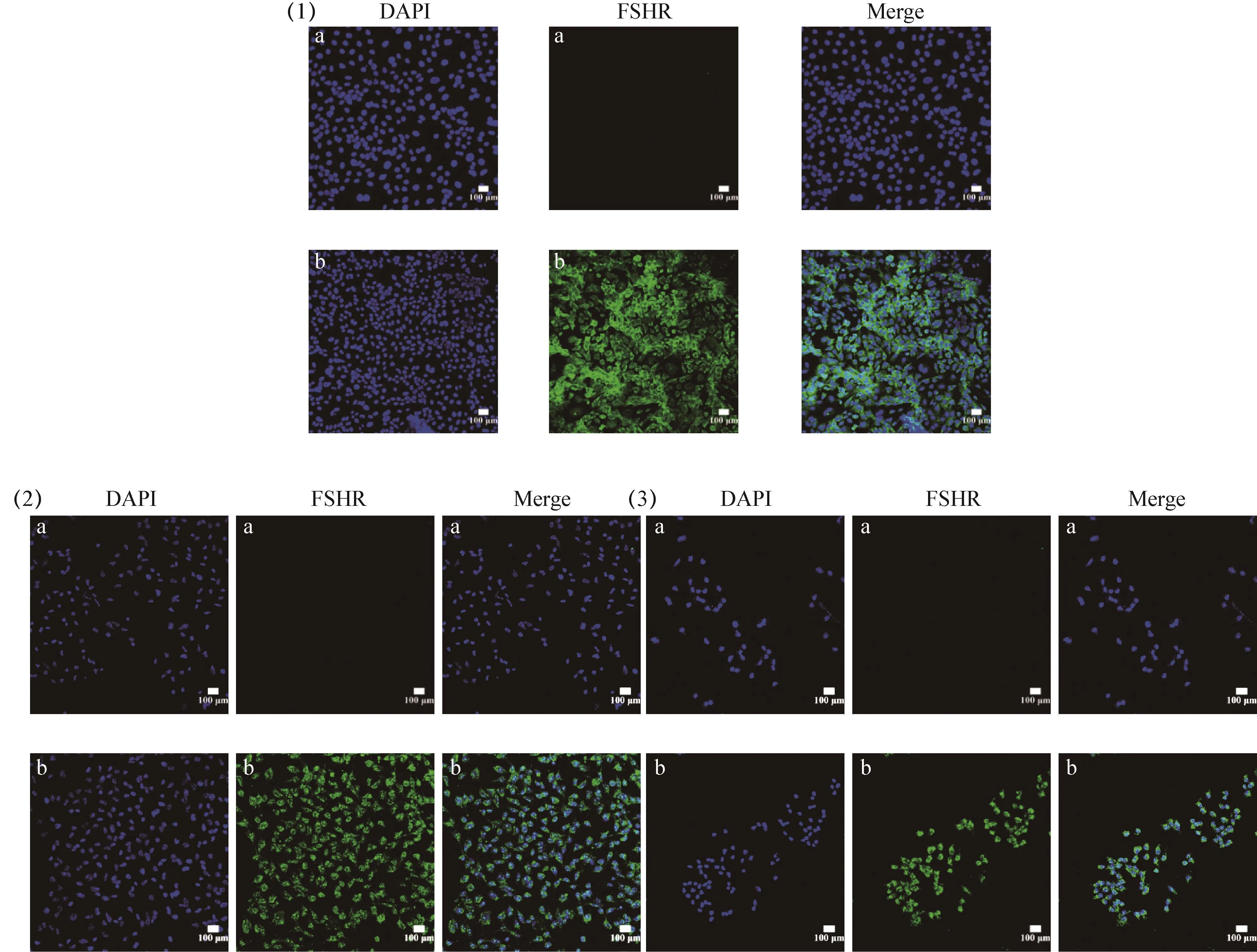
图5 卵巢颗粒细胞FSHR蛋白的表达与定位
3 讨论
卵巢颗粒细胞的体外培养为研究卵泡闭锁、生殖相关疾病提供了一个良好的体外研究体系。参照已有相关的文献,本实验采用机械法分离培养小鼠卵巢颗粒细胞[9-10]。张春燕等人报道[11],超排效果随着年龄的增长而下降,性未成熟时超排效果较好。试验选取3周龄性未成熟小鼠,卵巢上基本上是未充分发育的初级卵泡,此阶段注射PMSG,大量原始卵泡开始同步发育,可以尽可能获得多的生长发育相对一致颗粒细胞[12],确保后续实验的进行。朱娜等人[13]报道,不同发情周期超排效果不同,在发情期、后期与间期进行超排,均可出现数量不等的黄体,发情前期注射PMSG 48 h后,可见较多的有腔卵泡,卵泡体积较大,且突出于卵泡表面,少见黄体,发情前期是最适宜的小鼠超排时期。因此本试验选择发情前期的3周龄性未成熟小鼠,超排后获得的卵巢发育较好,卵泡较多,少见黄体等。有文献报道[14-16],适宜的超排剂量与时间对于卵泡发育数量有很大的影响。因此在选择超排剂量时,应注意根据参考文献及实际情况适当调节超排剂量与时间,避免因超排而导致小鼠卵巢卵泡发育问题或质量不佳等,从而导致提取出来的颗粒细胞量少,无法正常培养。体视显微镜下观察超排状态好的卵巢形态应该为干净、大量卵泡突出于卵巢皮质,较少或基本没有黄体、红体的存在。在刺破卵泡时,将卵巢置于含有血清的培养基中,分离出的颗粒细胞优于置于PBS中,可能原因是需要刺破的卵巢卵泡较多,其放置在操作液中的时间较长,如果直接选用PBS,细胞没有一个适合的生存环境,将造成更大量细胞的死亡。根据上述方法分离,培养小鼠卵巢颗粒细胞24 h后贴壁较多,48 h细胞舒展开,体积变大,4~5 d后铺满板底。
鸡等级卵泡颗粒细胞的提取使用酶消化法[17-18]。在机械分离等级卵泡颗粒层时极易因为将卵黄倾倒干净,而丢失颗粒层,因此操作过程中注意卵黄倒出程度。提取出的细胞培养24 h后完全贴壁,72 h铺满板底,生长状态良好。鸡小黄卵泡颗粒细胞使用酶消化法提取,在已报道的文献[19-20]基础上进行改进。本试验对直接剥离颗粒层与未剥离比较。采用直接剥离颗粒层的方法时,剥离出来的颗粒层易碎,无法完全收集,PBS清洗2~3次后,最终收集到的颗粒细胞较少。而只挤出卵泡中卵黄来提取颗粒细胞的方法,颗粒层并未脱离卵泡膜层,挤出卵黄后,直接夹取卵泡进行清洗,此方法所收集到的颗粒细胞数量远大于直接剥离颗粒层,且生长状况由于直接剥离的方法,可能是由于直接剥离的方法导致取出的颗粒层特别碎,无法很好的收集。而颗粒细胞呈聚集生长,细胞数量较少,导致细胞生长状态较差。同时需要注意在挤出卵黄时,先使卵黄自行流出,再轻轻按压卵泡即可,若力气过大,会使卵黄连同颗粒层一起挤压出来,不能充分分离提取颗粒细胞。
由于种属的不同导致小鼠与鸡的卵巢颗粒细胞提取方法不同,且小鼠卵巢颗粒细胞与鸡卵泡颗粒细胞形态上与生长特性也存在一定差异。伪足能够扩大细胞表面积,主要功能是运动和帮助进行营养物质交换,与细胞生长发育密切相关。鸡卵泡颗粒细胞伪足较多,可能是鸡为连续产蛋动物,每隔25 h左右排卵一次,颗粒细胞活力旺盛,对于周围营养物质的摄取较多。而小鼠发情周期为4~5 d,排卵周期较长,因此相对鸡卵泡颗粒细胞的伪足少。
FSHR是卵巢颗粒细胞特异性表达的受体[21],通过细胞间接免疫荧光的方法,可以鉴定出细胞的特异性并对其纯对进行检测。试验结果表明,根据上述分离、提取颗粒细胞的方法,可以有效提出颗粒细胞,且纯度高于95%,符合后续实验的要求。
综合分析小鼠卵巢颗粒细胞与鸡不同等级卵泡颗粒细胞的分离方法,可知不同种属因为个体差异、卵泡形态差异,所需的有效提取方法不一样。同一种属不同等级卵泡因为卵泡大小的差异,导致在分离颗粒层的操作上需有所改变。同时在提取过程中,需要注意不同提取方法的要点,以便得到质量更好的颗粒细胞。

