EBV与TLRs信号通路相互作用机制研究进展
张旭娟, 赵鹏翔*, YAO Mawulikplimi Adzavon, 李秦剑, 谢 飞
1.北京工业大学生命科学与生物工程学院, 北京 100124;2.陆军军医大学新桥医院, 全军血液病中心, 重庆 400037
EBV为人类疱疹病毒4型(human herpesvirus 4,HHV-4),属于γ疱疹病毒亚科,于1964年由Epstein与Barr研究非洲儿童伯基特(Burkitt)淋巴瘤时发现[1]。成熟的EBV病毒颗粒呈球形,直径约为180 nm,基因组为双链线性DNA,长度约为172 kb,编码基因约85个[2]。EBV在全球范围内的人群感染率超过了90%[3],且感染人群主要为青少年。大多数原发性感染起初并无症状,但若于青春期或成年期感染,则更容易引发传染性单核细胞增多症[4]。原发性感染后,EBV会在B细胞中建立潜伏感染,并通过一系列的调控来逃避宿主TLRs等免疫系统的识别与免疫作用,在特定条件下,EBV被激活进入裂解感染期,产生子代病毒颗粒从而引发疾病。此外,EBV作为第一个发现的与肿瘤相关的病毒,与众多肿瘤的发生有关,如Burkitt淋巴瘤、鼻咽癌、胃癌、宫颈癌和乳腺癌等[5]。然而,EBV也是溶瘤病毒。促癌和溶瘤这2种截然不同的作用主要是由EBV不同的侵染状态所决定的,而TLRs信号通路能够影响EBV侵染状态从而影响EBV的生物学作用。
TLRs作为固有免疫中模式识别受体之一,一方面能够识别EBV并控制病毒的感染,但TLRs的异常激活也会促进EBV的感染效率及其部分蛋白的表达;另一方面,不同感染状态的EBV对TLRs表达水平的调控作用也各不相同。本课题组在眼眶炎性假瘤(idiopathic orbital inflammatory pseudotumor,IOIP)的临床样品以及EBV+的B淋巴瘤细胞系中发现EBV与TLRs的活化存在潜在联系[6,7],提示深入研究TLRs与EBV的相互作用机理,将对临床治疗及实验研究有所助益。基于此,本文对EBV与TLRs信号通路之间相互作用的研究进展进行了综述,以期为开发新的EBV治疗靶点以及完善TLRs激动剂的临床方案提供一定的参考。
1 EBV生活周期
EBV的原发性感染一般发生在口咽的唾液交换过程,宿主为B淋巴细胞和特定上皮细胞等。EBV通过糖蛋白gp350和B细胞表面受体CD21促进EBV囊膜与细胞膜融合,使EBV外层基质及核衣壳进入细胞内。核衣壳转运到核膜后,EBV DNA进入细胞核内,激活γ干扰素诱导蛋白16(γ interferon inducible protein 16,IFI16)下游的炎性小体通路以及DNA损伤反应、ATM激酶信号通路。而EBV线性双链在其末端重复序列TR的介导下进行环化,进而被宿主组蛋白识别修饰,建立稳定的潜伏感染状态,外界刺激或机体免疫力低下等条件会诱导EBV由潜伏期向裂解期转化[8]。
1.1 潜伏感染
原发感染后的潜伏感染时期发生在记忆B细胞中,EBV通过一系列复杂的机制逃避宿主的免疫并在体内长期存在。该时期,EBV基因组通常是高度甲基化的,以环状染色质结构稳定存在于宿主细胞核内,能够利用宿主的DNA聚合酶随宿主细胞周期进行复制,并在细胞质基质中可检测到游离的双链环状病毒DNA[9]。潜伏感染主要分为4个阶段,共表达近100个EB病毒基因和8种蛋白质,这些潜伏基因包括6个EB病毒核衣壳抗原(EBV nuclear antigens,EBNAs)基因、2个潜伏膜蛋白(latent membrane proteins,LMPs)基因、EBV编码的2种小的非聚腺苷酰化RNA(EBV encoded RNAs,EBERs)和限制性内切酶BamHⅠ-A向右读码区的转录产物(BamHⅠ rightwards transcripts,BARTs),其中仅EBNA-1和LMP-1在裂解感染期也表达。潜伏期相关基因相应表达阶段及其功能如表1所示,其中,LMP-1在潜伏期与裂解期均有表达,且作为病毒癌基因,越来越多的研究表明其与细胞的运动、转移和肿瘤的侵袭相关。与EBV相关的恶性肿瘤主要由被潜伏感染的细胞组成,并有EBV编码的转化蛋白和非编码的RNA表达。
1.2 裂解感染
在某些情况下,如TGF-β的诱导、缺氧环境、DNA损伤或宿主记忆B细胞分化为浆细胞的过程中发生的B细胞受体交联等,EBV可能会重新活化进入裂解复制阶段产生大量感染性病毒颗粒,并经口咽唾液在个体间传播[28]。EBV在该阶段的基因表达具有时序性,依次表达即刻早期基因(immediate-early genes,IE)、早期基因(early genes,E)和晚期基因(late genes,L)。首先转录的是即刻早期基因BZLF1和BRLF1,分别编码转录因子Z(aka Z,ZTA,ZEBRA)和R蛋白(aka R,RTA),Z和R与EBV DNA裂解复制起始点结合,反式激活启动子Zp(Z promoter)和Rp(R promoter),触发早期基因的表达,编码病毒DNA复制所需的蛋白质;随着病毒基因组的复制,病毒晚期基因表达,并编码病毒基因组包装成感染性病毒颗粒所需的结构蛋白,即衣壳蛋白、基质蛋白、囊膜蛋白等。新包装成的感染性病毒颗粒可通过胞吐或者在细胞裂解后释放到细胞外。
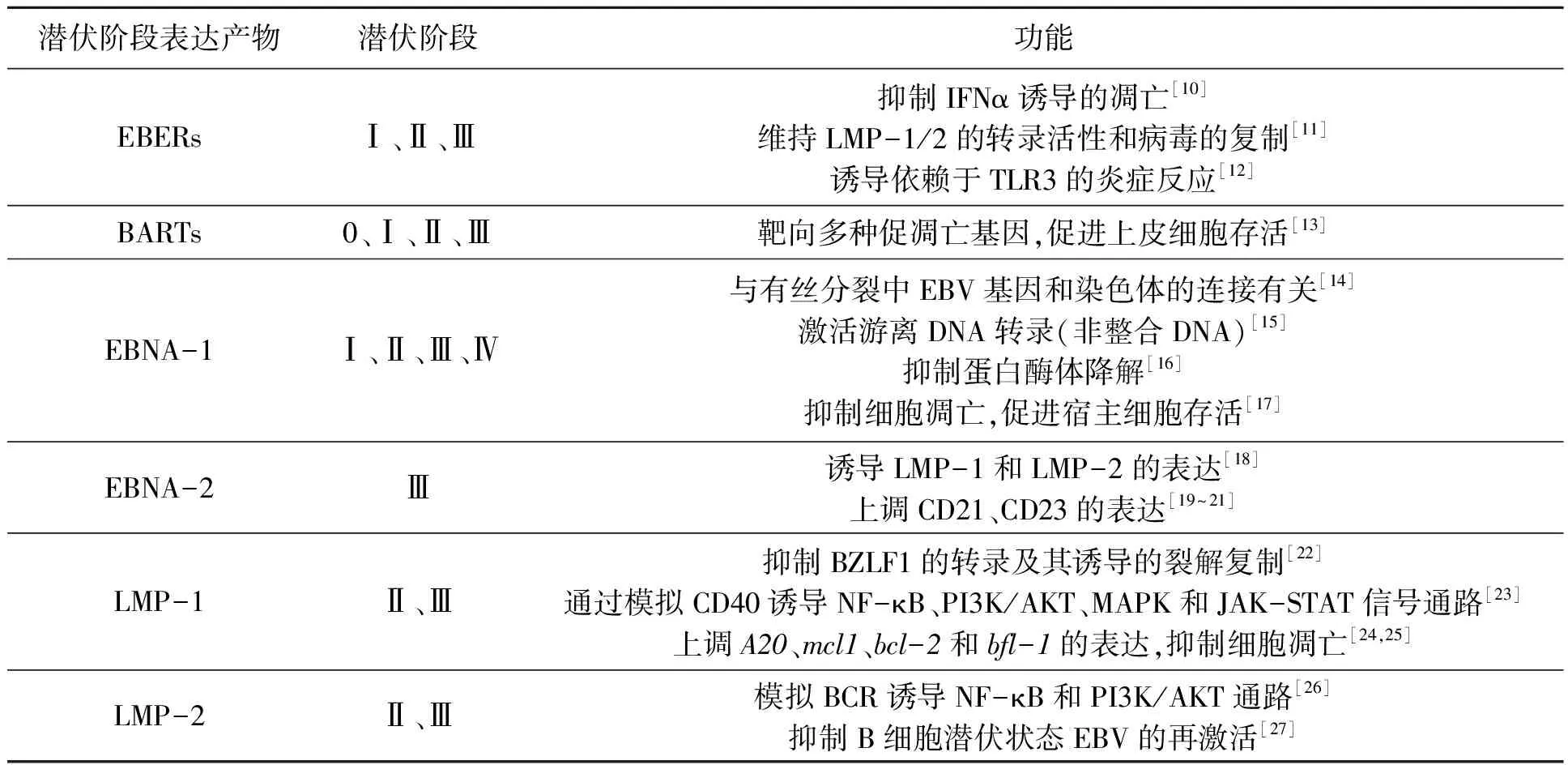
表1 EBV潜伏感染期相关部分基因及其产物Table1 Some related genes and their products of EBV at latent infection stage.

图1 已知能够调控Zp和Rp转录的因子Fig.1 Factors known to play roles in regulating transcription of Zp and Rp.注:顺式作用元件用灰色矩形表示,其对应的反作用因子直接显示在其上方,下方数字表示距离转录起始位点的碱基数目,其中转录起始位点为+1;YY1:转录因子Yin Yang-1;SP1/3:特异性蛋白1/3;SMADS:SMAD蛋白家族;MEF2D:肌细胞增强因子2D;CREB:环磷酸腺苷反应元件结合蛋白;ATFs:激活应激相关的转录因子;C/EBP:CCAAT增强子结合蛋白;c-Jun:翼式转录因子;ZEB1/2:锌指结构转录因子1/2;EGR-1:早期生长反应因子1。
在整个EBV裂解周期中,BZLF1和BRLF1之间存在着复杂又紧密的联系,它们的启动子序列中存在很多宿主转录因子调控区域,受到严格的转录水平调控,目前已知的转录因子有:YY1、E2-2、JDP2、MEF-2D以及ZEB1/2等抑制Zp的转录;Sp1/Sp3、c-JUN/c-FOS、CREB/ATF/AP-1、SMAD以及C/EBP等激活Zp的转录[29];YY1和ZEBs抑制Rp的转录;EBR1和Sp1/Sp3激活Rp的转录。上述转录因子及其作用元件如图1所示。
2 TLRs
在机体抵抗病毒的过程中,先天性免疫系统发挥着重要作用,可通过多种模式识别受体系统识别病毒,而TLRs作为先天性免疫系统的重要组成成分,是首个被定义的跨膜模式识别受体系统[30]。其存在于多种进化的生物中,能够识别由微生物和内源性组织产生的信号,即通过病原体相关分子模式(pathogen-associated molecular patterns,PAMPs)和损伤相关分子模式(damage-associated molecular patterns,DAMPs),在信号转导通路中发挥关键作用。不同类型的TLRs在识别先天性免疫病原体方面具有不同的功能,统称为TLR家族,在哺乳动物中发现11种TLRs,其中,在人类中存在10种。先天免疫效应细胞可表达这10种TLRs,每种都与特定的配体结合,其中,TLR2识别酰化脂蛋白,TLR3识别双链RNA,TLR4是脂多糖(lipopolysaccharides,LPS)的受体,TLR5识别细菌鞭毛蛋白,TLR7/8、TLR13识别单链RNA,TLR9识别双链DNA,TLR10、TLR11识别寄生虫抑制蛋白样分子[31]。
2.1 TLRs相关信号通路
TLRs介导的信号通路分为髓样分化因子88(myeloid differentiation factor 88,MyD88)依赖的信号通路和β-干扰素TIR结构域衔接蛋白(TIR-domain-containing adaptor inducing interferon-β,TRIF)依赖(或称为MyD88非依赖)的信号通路,如TLR7/8/9属于前者,TLR3属于后者。MyD88依赖的信号通路中衔接蛋白MyD88招募下游的白细胞介素-1受体相关激酶(interleukin-1 receptor-associated kinases,IRAKs),将信号传递至肿瘤坏死因子受体相关因子6(TNF receptor associated factor 6,TRAF6),随后募集并激活下游的转化生长因子激酶1(transforming growth factor activated kinase-1,TAK1)和NF-κB抑制蛋白激酶α/β/γ(inhibitor of nuclear factor kappa-B kinase α/β/γ,IKKα/β/γ),促进AP-1活化以及NF-κB介导的炎症因子(如TNF-α、IL-6、IL-8、IL-1α和IL-1β等)的表达[32,33]。TRIF依赖的信号通路中衔接蛋白TRIF招募下游的TRAF3,进而激活TBK1和IKKε,促进干扰素调节因子3/7(interferon regulatory factor 3/7,IRF3/7)所介导的Ⅰ型干扰素的产生[34]。而Ⅰ型干扰素能够使JAK-STAT等信号通路活化,表达大量抗病毒基因,从而抑制病毒的复制[35]。上述TLR信号通路如图2所示。
2.2 TLRs激动剂
TLRs激活介导产生的炎症因子对机体有保护作用,其中大量研究证明其介导的肿瘤坏死因子具有抗癌作用,干扰素具有抗病毒作用;另有研究发现,人类免疫相关疾病中的TLRs表达异常升高,如系统性红斑狼疮患者的pDC细胞中TLR7的表达水平较高[37]。因此,TLRs激动剂除了可用于治疗各种病原微生物引起的疾病,还可能成为自身免疫相关疾病的治疗药物。现阶段,TLRs激动剂,如TLR3激动剂poly(I∶C)[38],TLR7激动剂R-848[39]、GS-9620[40]、852A[41]等,TLR9的激动剂CpG[42]等,大多数可作为免疫佐剂应用于临床。TLRs除了能够作用于免疫系统,也可作用于中枢神经系统,如激活中枢小胶质细胞的TLRs释放IL-6等细胞因子,从而促进脑缺血的神经元存活,还能够减少脑梗塞缓解脑血管疾病对大脑的损害[43];TLRs的激活状态可影响小胶质细胞的吞噬能力,因此有望成为阿尔茨海默病免疫治疗的潜在治疗靶点[44]。
3 TLRs信号通路与EBV相互作用
TLRs作为模式识别受体中非常重要的一部分,可识别EBV并引发固有免疫,进而在一定程度上控制病毒的感染并促进在EBV潜伏感染状态下B细胞的增殖;另一方面,越来越多的研究证明,EBV可能通过干扰TLRs的表达和功能,从而影响宿主免疫反应,造成免疫逃逸与持续潜伏感染,但目前对于TLRs与EBV之间的具体相互作用机制仍不完全明确。
3.1 EBV对TLRs信号通路的调控
EBV可以通过一系列的途径降低TLRs的表达、逃避宿主固有免疫,从而建立并维持体内潜伏感染。人B细胞可表达高水平的TLR1、TLR6、TLR7、TLR9、TLR10,其中TLR7和TLR9的表达和功能与B细胞中EBV的关系较为密切。已有数据表明,EBV与TLR7、TLR9之间存在致病性串扰,EBV能够影响或依赖TLR7、TLR9的表达,促进宿主B细胞的存活[45];与此同时,EBV通过抑制TLRs下游抗病毒因子的表达及功能而逃避宿主的免疫杀伤作用,由此可能引发B细胞功能障碍和免疫功能异常,从而引起一系列相关疾病。
EBV在不同的细胞中显示出对TLRs具有不同的影响。研究表明,EBV能够在体外感染纤维细胞并增加TLR7/9的mRNA表达水平[46];EBV也能够诱导外周单个核细胞(peripheral blood mononuclear cell,PBMC)中TLR7/8的表达,但却抑制TLR7/8/9对PBMC的增殖作用,这一增殖抑制作用对于外周血富集B细胞更为明显,且呈EBV剂量依赖性[47,48];与此相悖,在幼稚B细胞中,EBV上调TLR7并下调TLR9的表达,使用TLR7激动剂R837与EBV共培养后,结果发现幼稚B细胞的增殖水平增加17倍[48],说明在幼稚B细胞中EBV并不能像在PBMC及外周血富集B细胞中一样发挥抑制TLR7及其促细胞增殖的能力。Wang等[49]在研究自免型疾病系统性红斑狼疮(systemic lupus erythematosus,SLE)时发现,LMP2A可通过增强对TLR配体的反应活性,促进BCR/TLR通路对B细胞的自反应激活。由此可见,在不同细胞中EBV对不同的TLRs组分表达水平的调控作用并不完全一样。此外,EBV对TLRs的细胞增殖作用的影响也不尽相同,这可能是由于不同细胞中基因选择性表达形成不同的免疫应答机制,从而使EBV对TLRs的影响效应也存在差异。
EBV除影响TLRs对细胞的增殖能力外,还可通过影响TLRs下游信号通路(如Ⅰ型干扰素、IRF-5/7以及NF-κB等)来干预宿主的免疫功能或抗病毒能力。EBV感染浆细胞样树突状细胞(plasmacytoid dendritic cells,pDCs)后能够激活不成熟的pDCs,释放受损性TNF-α,从而使机体无法启动完整的T细胞免疫[50];EBV通过刺激pDCs诱导TLRs产生Ⅰ型干扰素,从而促进自然杀伤细胞和CD3 T细胞的活化,而此作用部分是由TLR9介导的[51];EBV感染的B细胞中释放的EBER,主要负责EBV免疫激活,诱导TLRs下游Ⅰ型IFN和促炎细胞因子的释放,从而可能引发免疫病理性疾病[52];Martin等[53]发现EBV能够限制TLR7下游IRF-5对EBV建立持久感染的负作用;Dong等[54]的研究表明,在大多数EBV转化的细胞中,IRF-5启动子A区域存在高度甲基化,EBV编码的蛋白BGLF4[55]以及BPLF1[56]都会抑制B细胞内TLRs介导的NF-κB活化,从而使EBV通过抑制TLRs下游信号通路抗病毒的能力而逃脱宿主固有免疫;不仅如此,EBV还可介导T细胞抑制因子B7-H1和ICOS-L的表达上调[51]。以上研究均说明EBV能够通过TLRs及其下游信号通路间接或直接影响宿主或机体对EBV的免疫作用,进而维持自身的持续感染状态。
在潜伏、裂解等不同感染时期,EBV基因及其产物的表达水平和功能各不相同,在EBV不同感染时期的B细胞中,TLRs的表达水平也具有差异性。在潜伏感染期中,随着潜伏基因的表达,TLR6、TLR7、TLR9表达不变,TLR1和TLR10表达下降;但在被裂解感染的B细胞中,TLR1、TLR6、TLR7、TLR9、TLR10的mRNA表达水平均下降,尤其TLR9下降最为显著[57]。造成TLR9被抑制的原因,目前主要集中在以下3个方面:①EBV表达的LMP1可通过激活NF-κB下调TLR9的转录[58];②B细胞中EBV重新激活后,裂解期蛋白BGLF5随着病毒的再次活化下调TLR9的mRNA以及蛋白的表达[57];③然而也有研究者指出,EBV裂解感染后期表达的蛋白BPLF1能够发挥去泛素化酶的作用,从而抑制TLRs介导的NF-κB在TRAF6信号通路中的激活[56]。除B细胞外,EBV在体外感染硬皮病SSc纤维细胞时会上调TLR7/9及IRF5/7的mRNA表达水平,但在细胞内无EBV时使用TLR激动剂并没有引发TGF-β响应,由此推测,EBV在硬皮病SSc纤维细胞中可能作为一种弱诱导刺激产生了不完全的IFN信号[47]。可见,EBV潜伏期和裂解期对宿主固有免疫TLRs的调控作用并不一致。在EBV的活化过程中,对TLR9的影响格外显著,这可能是由于在宿主抵抗病毒时,TLR9识别进入内涵体中的病毒双链DNA,从而能够在病毒复制过程中发挥出更强大的抗病毒作用。
最新研究还发现,EBV病毒蛋白可通过TLRs介导的信号诱导人视网膜色素上皮细胞使IL-6、IL-8、MCP-1分泌增加而引发炎症,通过诱导NO合酶,合成NO以诱导视网膜细胞坏死和死亡[59],这一发现为了解EBV诱导炎症和细胞死亡的免疫机制提供了重要信息,并有助于设计新的免疫治疗方法来治疗由EBV引起的眼部感染。
在长期的进化中,EBV与宿主固有免疫系统的相互作用可能使EBV已经发展出一系列类似挟持宿主以逃脱宿主的固有免疫的机制,但仍有待于进一步探究与阐明。
3.2 TLRs信号通路对EBV的不同效应机制
TLRs除了参与固有免疫过程限制EBV裂解感染,其他具体作用机制尚不明确,不同的TLRs可能发挥了不同的作用。TLR7/8激动剂R848、TLR9的激动剂CpG在CD40L的共同刺激下会显著增加EBV对PBMC或者富集后B细胞的感染效率[60]。TLR7的异常激活可增加EBV LMP1的表达,TLR3、TLR 9激活产生的IRF7也参与了此过程[61]。TLR9的激活会抑制EBV裂解期基因BZLF1及其蛋白ZEBRA的表达,且这种抑制作用是不需要蛋白质从头合成介导的,但需要功能性IRAK4、TLR9和MyD88蛋白的参与[62];TLR9触发的BZLF1的组蛋白修饰也是抑制EBV裂解感染的重要因素,但NF-κB或其他已知的TLR9通路可能都不是TLR9介导抑制EBV的关键[63]。
TLRs下游信号通路中干扰素调节因子IRF-7与EBV介导的B淋巴细胞体外及体内转化密切相关。近期研究发现IRF-7的下调会导致EBV转化细胞生长受抑制,敲除IRF-7后细胞增殖水平降低,凋亡率上升,而当外源性表达IRF-7的质粒转入后即可恢复病毒转化细胞的生长;进一步研究发现IRF-7的下调会导致EBV的LMP1表达水平降低[64]。这表明IRF-7可能是EBV感染细胞转化的一个因素,并可能成为治疗EBV介导的瘤变的潜在靶点。
此外,还有研究证实TLR7/9在小鼠内皮细胞中参与识别了EBV DNA,但也因此触发IL-17A的释放引发炎症[65]。由此可见,TLRs在识别控制EBV感染的同时对自身可能会造成如自身性免疫疾病等负面影响。这对评估TLR7/9在EBV阳性的自身免疫疾病的患者中的作用具有一定的指导意义。
虽然,TLR9触发能够抑制B淋巴瘤细胞中EBV向裂解感染的转化,但也有研究发现在各种B淋巴瘤细胞中EBV的状态并不决定细胞对TLR9所触发的反应。使用TLR9的配体CpG2006激活TLR9后,能够引发EBV宿主B淋巴瘤细胞的死亡,这一过程的发生依赖于半胱天冬酶,但与EBV及细胞周期均无关[66]。这一结果提示,B淋巴瘤细胞中TLR9的激活虽然能控制EBV的裂解性感染,但也可能会对宿主细胞产生负面伤害。
目前,TLRs多态性与EBV易感性的相关性研究,主要集中在TLR1、TLR2、TLR4、TLR7、TLR9的多态性位点,但实验结果证明已报道的TLRs的多态性位点,如TLR1的rs5743551、rs5743611,TLR2的rs3804099、rs3804100[67],TLR4的rs1927911等,TLR6的rs3775073等,TLR7的rs2897827,TLR8的rs3764879、rs3764880,TLR9的rs187084、rs352140[68]等,与EBV易感性并无显著相关性[69~72]。由此可见,TLRs的基因多态性并不是造成EBV易感与否的主要原因,相关机理探究可考虑尝试TLRs多态性之外的其他因素。
本课题组对于眼眶炎性假瘤(idiopathic orbital inflammatory pseudotumor,IOIP)研究时发现,表达谱芯片测序与多组学分析结果均显示TLRs通路呈活化状态(数据未发表),同时在临床样品中检测到了EBV-DNA和EBV相关抗原,提示IOIP的发病机理可能与EBV感染有关[6],且IOIP患者可能成为EBV诱发相关疾病的高危人群,需密切关注其EBV的感染状态。
4 展望
作为全球范围内高感染率的病毒,对EBV的研究越来越深入,研究方向大致分为以下4个方面:①EBV各成分如基因、蛋白以及一些小RNA的功能研究;②EBV与宿主之间的相互调控关系;③EBV的免疫逃逸机制;④EBV在相关疾病的发生及发展中的作用。
目前,有关EBV大部分研究集中于对其生活周期的调控,但宿主固有免疫系统与EBV之间的相互作用关系尚不完全明确,尤其是TLRs信号通路与EBV之间的相互影响远比目前所了解到的更为复杂。TLR7/8/9具有交叉网络的下游通路,尽管大部分研究着重探索了TLR9(识别DNA),但TLR7/8很有可能与EBV也存在潜在的相互作用。部分B细胞抗原受体(B cell antigen receptor,BCR)激动剂已经证实能够激活潜伏状态的EBV病毒,而TLR7/8/9的配体作为常用的免疫激动剂和抗体佐剂,在激活天然免疫的同时,是否会对大量人群中所携带的潜伏状态的EBV的生活周期产生影响,可能是值得探讨的重要问题。目前,HIV治疗中已经应用shock-and-kill的新方法,有望彻底治愈HIV感染,该方法应用免疫激动剂,将T细胞中潜伏的HIV激活出来,从而再通过免疫系统将其清除。以这种方法为线索,对于正常人群中已经处于高概率潜伏状态的EBV和巨细胞病毒等,通过外源激活的方法,彻底清除潜伏病毒,是将来可能的治疗策略。而EBV等潜伏病毒,具有整合在宿主DNA,并且持续表达多种潜伏蛋白的特点,这些病毒组分通常也是造成细胞永生化和肿瘤生成的重要因素,因此,去除潜伏的EBV感染可能是未来治愈诸如伯基特淋巴瘤等恶性肿瘤的可能手段。EBV各时期基因、蛋白与TLRs相关通路的作用关系及关键分子的研究仅处于初步阶段;此外,宿主对EBV周期调控基因转录翻译的影响、EBV在宿主内维持感染以及在宿主间的转移的具体机制,均有待于进一步研究。深入了解TLRs与EBV之间的限制关系有助于进一步理解EBV的生活周期,对于阐明EBV相关疾病发病机理以及筛选针对EBV的新型抗病毒疫苗和治疗手段也具有重要意义,并且相关研究可能提示EBV参与的TLRs相关性自身性免疫疾病的新型治疗靶点。
综上所述,目前有关EBV与宿主之间相互作用的途径和调控机制及其致病机制的相关研究并不详尽,从而限制了抗EBV药物的研发及临床治疗EBV相关疾病的推进。因此,深入理解EBV与宿主细胞固有免疫TLRs信号通路之间错综复杂的关系,对于阐明EBV相关疾病的发病机理和EBV相关疾病的诊断、新型治疗方案的制定,具有重要的临床应用价值。

