山梨糖醇对兔皮明胶理化特性的影响
李晓艺,王宏艳,马良,3,戴宏杰,余永,张宇昊,3*
1(西南大学 食品科学学院,重庆,400715)2(河北金融学院,河北 保定,071051) 3(西南大学,国家食品科学与工程实验教学中心,重庆,400715)
明胶是胶原蛋白部分水解的产物[1],食品工业中常被大量应用于甜味食品,如软糖、糕点、酸奶、饮料等,因此甜味剂对明胶凝胶特性的研究受到了广泛关注。CHOI等[2]研究发现明胶-糖复合体系随着储存时间的延长,储能模量G′与胶凝速率常数K增幅的顺序为:木糖<葡萄糖<蔗糖,说明蔗糖对其周围水分子的结构有最大的稳定作用。KUAN等[3]对鸭足明胶和蔗糖、乳糖复合体系进行了结构及流变学研究,分析认为低糖浓度(50~100 g/L)下糖阻碍了明胶网络结构的形成,而在高浓度(400 g/L)时由于形成更小的连接区使凝胶结构更稳固。
随着人们对健康饮食的追求,糖类物质受高热量、易导致龋齿以及糖尿病等因素限制[4],需求量下降,糖替代品及甜味剂的应用开始流行。糖醇是羰基加氢生成的多元醇化合物,可改善蛋白质部分功能,如热稳定性、乳化性及胶凝性等[5-6]。山梨糖醇的甜度约为蔗糖的60%~70%,人体摄入后不会转化为葡萄糖,不受胰岛素影响,且不易与蛋白质产生美拉德反应[7],是理想的蔗糖替代物。目前,糖醇对明胶凝胶特性的影响有少量研究,GEKKO等[8]研究发现明胶凝胶的熔化温度随着多元醇和糖的浓度增加而增加,而明胶溶液的黏度随着多元醇的添加而降低。但该研究主要针对明胶在溶胶-凝胶转变过程中的变化,并未阐明复合体系中凝胶特性的变化及其分子机制。
本课题组研究表明[9-10],兔皮明胶具有良好的凝胶特性,且不受宗教和疫病的局限,具有良好的应用前景。因此,本研究系统探究了不同浓度的山梨糖醇对兔皮明胶功能特性的影响,以期为此复合凝胶体系在食品工业中的应用奠定理论基础。
1 材料与方法
1.1 材料与试剂
兔皮,重庆阿兴记食品有限公司,清洗后于-20 ℃冰箱中冻藏备用。Ca(OH)2、HCl、Na2S、NaCl、过硫酸铵、二甲基硅油、十二烷基硫酸钠、蔗糖,成都市科龙化工试剂厂;β-巯基乙醇(2-ME)、Tris、考马斯亮蓝R-250、四甲基乙二胺(TEMED),BIO BASIC公司;30%丙烯酰胺、山梨糖醇,北京索莱宝科技有限公司。其中Tris、考马斯亮蓝R-250、30%丙烯酰胺为优级纯,其他试剂均为分析纯。
1.2 仪器与设备
JA3003B型电子天平,上海精天电子仪器有限公司;PE20型实验室pH计,上海梅特勒-托利多仪器有限公司;HX-1005恒温循环器,郑州长城科工贸有限公司;TA.XT2i物性测定仪,英国Stable Micro System公司;DHR-1流变仪,美国TA公司;Spectrun100红外光谱仪,美国PerkinElmer公司;Pyris4000差示量热扫描仪,美国PerkinElmer公司;MOS-500圆二色谱仪,法国Bio-Logic公司。
1.3 方法
1.3.1 兔皮明胶的提取
兔皮明胶的提取参照杨晖等[11]的方法,具体工艺如下:
兔皮→去除皮下脂肪→脱毛→清洗、剪切→去除杂蛋白→清洗→稀酸处理→提胶→过滤→热风干燥→成品明胶
1.3.2 样品的配制
用蒸馏水配制质量浓度分别为0、30、50、100和200 g/L的山梨糖醇溶液各30 mL,分别加入2 g明胶,室温下溶胀30 min后于60 ℃溶解1 h,充分搅拌后,于60 ℃继续稳定30 min得到明胶质量浓度为66.7 g/L的共混溶液,室温下冷却成胶。
1.3.3 凝胶强度的测定
参照GB6783—2013[12]的测定方法,将1.3.2中制备的样品在恒温循环器中于(10±0.1)℃下凝冻16~18 h,采用TA.XT2i物性测定仪测定凝胶强度。用TA5圆柱型探头以1 mm/s的速度下压4 mm,得到凝胶强度数值。
1.3.4 流变性能的测定
采用DHR-1流变仪测定样品的流变学行为,测试夹具为直径40 mm的平板,板间距1 000 μm,动态温度扫描的参数设置主要参照陈丽清等[13]并做适当调整,取适量样品于加热板上,降下夹具,以2 ℃/min由40 ℃冷却到5 ℃,于5 ℃下保持2 min,然后由5 ℃ 升到40 ℃,测定储能模量G′和耗能模量G″随温度变化的变化;升温和降温过程中,G′和G″的交点对应的温度分别为明胶的熔化和胶凝温度。频率扫描参数设置如下:稳定时间5 min,测试温度20 ℃,0.1% 应力值,频率变化0~100 Hz,测定储能模量G′和耗能模量G″随频率变化的变化。
1.3.5 凝胶-溶胶转变温度和热焓值测定
称取1.3.2中的样品3~5 mg,置于铝坩埚中并密封,进行差示量热扫描。在氮气流中以2 ℃/min的速率将系统温度由-5 ℃升至50 ℃[14]。记录吸热峰峰值对应的凝胶-溶胶转变温度Tm和热焓值ΔH。
1.3.6 傅里叶变换红外光谱扫描
分别取一定量的各样品,冷冻干燥后剪碎。称取1 mg样品与100 mg溴化钾混合后于玛瑙研钵中研磨,40 ℃烘干后压片,用红外光谱仪扫描400~4 000 cm-1的吸收光谱,扫描次数为32次,分辨率4 cm-1[15],采用Peak Fit v 4.0软件对图谱进行基线校正和分析。
1.3.7 圆二色谱扫描
用蒸馏水将1.3.2中的明胶样品稀释至1 mg/mL的溶液,进行圆二色谱扫描。扫描的波长范围为190~240 nm,温度25 ℃,比色皿光程1 mm,扫描速率50 nm/min[16]。
1.3.8 数据分析
采用Origin 8.6和SPSS 17.0软件进行数据分析,每个试验设置3次平行实验,最终结果以平均值±标准偏差表示。
2 结果与分析
2.1 凝胶强度
如图1所示,添加山梨糖醇后,明胶凝胶强度显著增大(P<0.05),当山梨糖醇质量浓度增加至50 g/L时,凝胶强度达到最大值540 g。
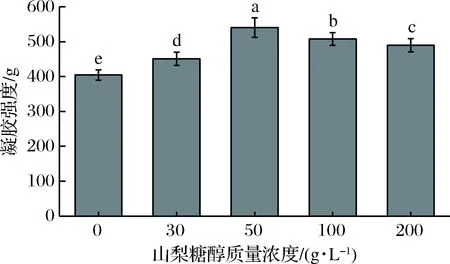
图1 含有不同浓度山梨糖醇明胶的凝胶强度Fig.1 Gel strength of gelatin containing sorbitol at different concentrations注:不同小写字母表示显著性差异(P<0.05)。
继续增大山梨糖醇的浓度,凝胶强度有所下降,但均高于对照组。研究认为[17],多元醇分子上的—OH基团增强了水分子的氢键结构,明胶与相邻水分子的三维氢键结构互相连结,形成了明胶-水-多元醇三元复合稳定体系,从而增大明胶的凝胶强度。随着山梨糖醇浓度持续增大,凝胶强度与最大值相比显著下降(P<0.05)。这是由于过高浓度的糖醇存在时,它们与水强力结合,抢夺了部分复合体系中的水分子[18],导致体系凝胶强度下降。CAI等[19]将不同浓度的木糖醇加入鱼皮明胶中,凝胶强度均显著提高,并于木糖醇质量浓度为30 g/L时达到最大值,与本研究结果一致。
2.2 流变性能
2.2.1 温度扫描
升温过程中,明胶发生凝胶-溶胶转变,其网络结构受热不稳定,逐渐由有序的螺旋结构变为无规则卷曲,明胶由弹性主导过渡到黏性主导;在溶胶-凝胶转变过程中,随着温度的不断下降,无规则明胶的蛋白分子链开始聚集,由粘性主导向弹性主导转变[20-21]。由图2-a和图2-b可知,随着山梨糖醇质量浓度的升高,明胶的储能模量G′呈现先上升后下降的趋势,在糖醇添加量为50 g/L时达到最大,且均高于对照组。说明糖醇的加入促使明胶-水-多元醇三元复合体系形成,明胶网络间的缠结点增多,结构更稳固[10],因此储能模量增大。而过高浓度的糖醇“占用”了更多的水,一定程度上破坏了三元体系的平衡,降低了体系的弹性,故而模量有所下降。
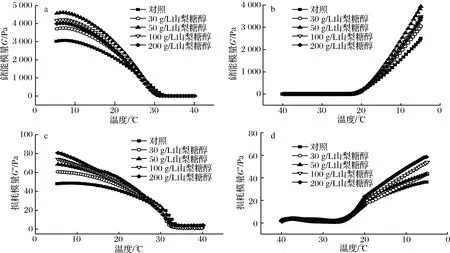
图2 温度对含有不同浓度山梨糖醇的明胶G′和G″的影响Fig.2 The effect of temperature on G′ and G″ of gelatin containing sorbitol at different concentrations
损耗模量G″的变化趋势与G′不同,随着山梨糖醇浓度升高,G″持续增大,说明随着山梨糖醇的加入体系黏度增加。这可能是因为山梨糖醇分子含有多个氢键,在体系中山梨糖醇-明胶-水复合体系充分形成后,过量的山梨糖醇中的羟基依旧可以与体系中的山梨糖醇分子的羟基通过氢键结合,增加了体系中的分子链的长度,造成体系中黏度的进一步上升[22]。
由表1可知,随着山梨糖醇质量浓度的增加,明胶体系在较高温度下胶凝能力显著提升(P<0.05)。

表1 含有不同质量浓度山梨糖醇明胶的熔化/胶凝温度Table 1 Melting and gelation temperature of gelatin containing sorbitol at different concentrations
注:不同小写字母表示显著性差异(P<0.05)。
这可能说明明胶-山梨糖醇-水三维体系的形成有利于增加凝胶的热稳定性,因此在夏季环境中,山梨糖醇的添加更有利于明胶食品体系凝胶状态的保持。KUAN等[4]在66.7 g/L的鸭足明胶中加入质量浓度0、50、100、200、400 g/L的蔗糖和乳糖,结果表明明胶的胶凝和熔化温度随着多糖质量浓度的增大而持续升高,与本研究相一致。
2.2.2 频率扫描
频率扫描主要研究物质对高频或低频的响应性,将其应用于食品领域中,可为反应食品口感提供理论数据。图3反映了各样品的储能模量和损耗模量随频率变化的规律。
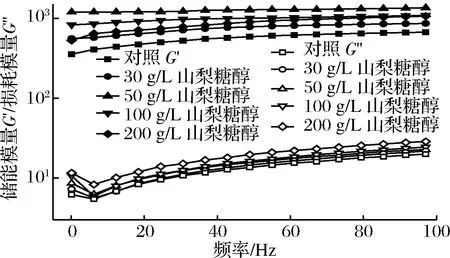
图3 频率对含有不同浓度山梨糖醇明胶G′和G″的影响Fig.3 The effect of frequency on G′ and G″ of gelatin containing sorbitol at different concentrations
各样品的储能模量G′随频率升高变化不大,弹性在0~100 Hz基本不受频率影响,均形成了稳定的凝胶体。损耗模量G″随着频率的增大呈上升趋势,说明黏性受频率影响变化较大。50 g/L山梨糖醇组有最高的储能模量,损耗模量则随着山梨糖醇浓度升高而增大,与温度扫描的规律相同。
2.3 差示扫描量热分析
表2中的数据显示,山梨糖醇添加量达50 g/L,凝胶-溶胶转变温度显著提高(P<0.05),较高的转变温度说明凝胶体系的热稳定性更强。更高的热焓值表明更稳定的凝胶结构,氢键相互作用加强,无规则卷曲减少,凝胶强度增大[23],添加山梨糖醇后,热焓值ΔH显著增大(P<0.05),并于添加量为50 g/L时达到最大,与凝胶强度的变化规律相符。

表2 含有不同质量浓度山梨糖醇明胶的 凝胶-溶胶转变温度和热焓值Table 2 Gel-sol temperature and ΔH of gelatin containing sorbitol at different concentrations
注:不同小写字母表示显著性差异(P<0.05)。
2.4 红外光谱
由表3和图4可知,位于3 454 cm-1附近的特征峰表示为N—H振动,当N—H基团参与形成氢键时,其峰位向低波数移动,当糖醇添加量小于50 g/L时,其峰位移向低波数,表明体系中更多的N—H基团参与氢键的形成[24],这主要是因为山梨糖醇中带有大量羟基,可与明胶中肽键的N—H基团形成氢键。但当山梨糖醇浓度大于50 g/L时,随着其质量浓度继续增加峰位变化不明显,这可能是因为暴露的N—H基团已经被占据,无法再形成更多的氢键。位于3 658 cm-1附近的酰胺A带表示成氢键的—OH振动,随着山梨糖醇的添加,其没有明显的位移,说明体系中与—OH有关的氢键没有明显变化,这可能是因为山梨糖醇添加后,尽管其羟基与明胶中的氨基形成了氢键,但体系中原本明胶分子内部羟基与其他基团所形成的的氢键可能被破坏,使体系中参与氢键形成的羟基数量总体平衡。也就是说山梨糖醇的加入可能致使明胶分子之间形成的氢键被破坏。
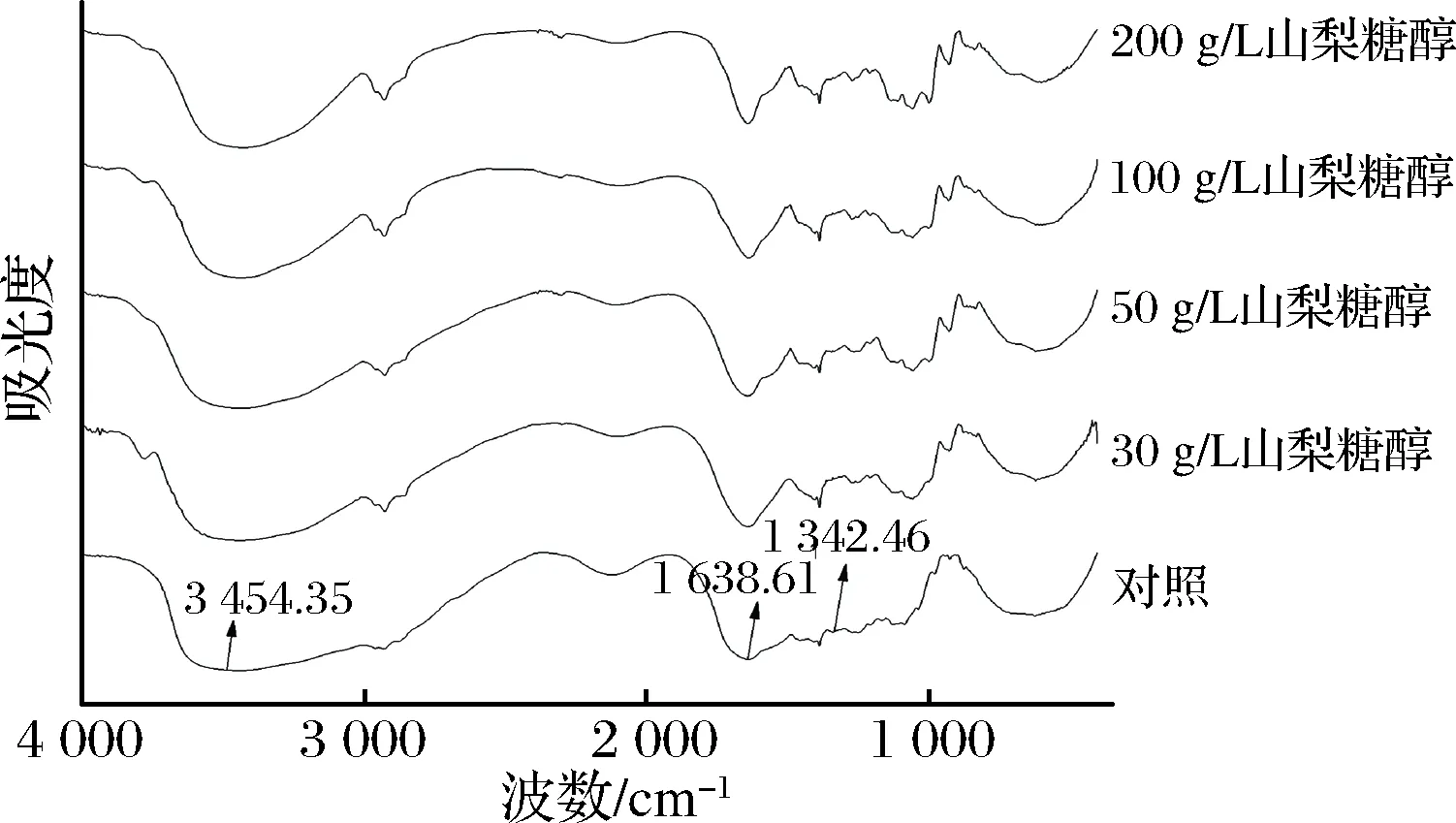
图4 含有不同质量浓度山梨糖醇明胶的红外光谱图Fig.4 FTIR spectra of gelatin containing sorbitol at different concentrations

表3 含有不同浓度山梨糖醇明胶的酰胺带吸收峰位置Table 3 The absorbance positions of gelatin containing sorbitol at different concentrations
注:“-”表示未检出。
2.5 圆二色谱分析
研究表明[27-28],明胶通常在197 nm附近有明显的负峰,225 nm附近有明显的正峰,这2个峰均与α-螺旋和三螺旋构象的存在有关。由图5和表4可知,所有的样品均在203 nm和223 nm处分别有明显的负峰和正峰,山梨糖醇的加入并未使明胶的出峰位置发生偏移,说明蛋白的天然构象未发生改变。223 nm处正峰表示明胶在稀溶液中具有恢复三螺旋结构的能力,糖醇添加量为50 g/L时达到最大,表明适当浓度的山梨糖醇使明胶分子链间交联点增加,恢复三螺旋结构的能力增强。随着山梨糖醇质量浓度继续增加,溶液中明胶恢复三螺旋结构的能力明显减弱,原因可能在于高浓度山梨糖醇“抢夺”明胶分子表面水分所致。

小写字母a-e从上到下依次代表山梨糖醇质量浓度50、100、30、200、0 g/L图5 含有不同质量浓度山梨糖醇明胶的圆二色谱图(A)和局部放大图(B)Fig.5 CD spectra of gelatin containing sorbitol at different concentrations
表4 含有不同质量浓度山梨糖醇明胶的圆二色谱数据Table 4 CD data of gelatin containing sorbitol at different concentrations
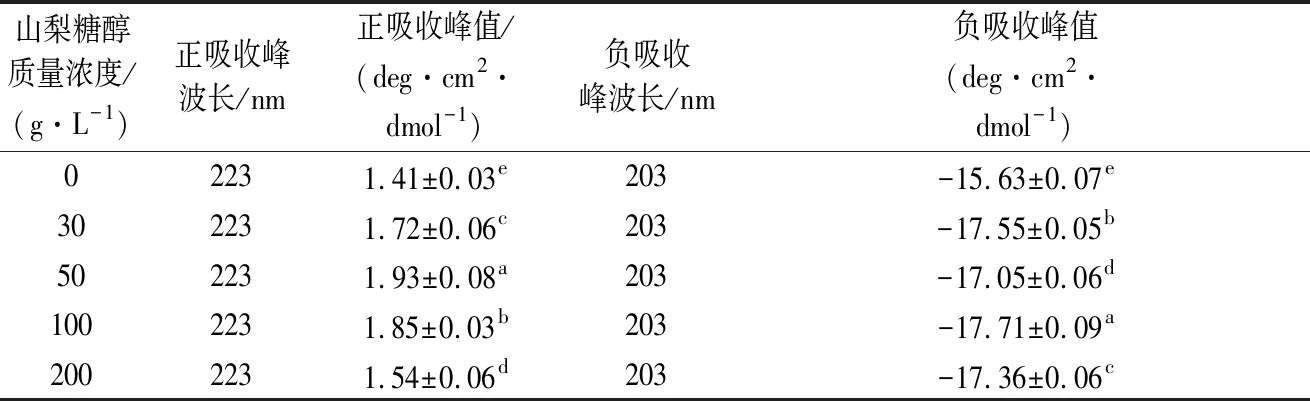
山梨糖醇质量浓度/(g·L-1)正吸收峰波长/nm正吸收峰值/(deg·cm2·dmol-1)负吸收峰波长/nm负吸收峰值(deg·cm2·dmol-1)02231.41±0.03e203-15.63±0.07e302231.72±0.06c203-17.55±0.05b502231.93±0.08a203-17.05±0.06d1002231.85±0.03b203-17.71±0.09a2002231.54±0.06d203-17.36±0.06c
注:不同小写字母表示显著性差异(P<0.05)。
3 结论
本实验测定了不同质量浓度山梨糖醇对兔皮明胶理化特性的影响,研究结果表明:
(1)添加山梨糖醇能使凝胶强度显著增大,并于添加量为50 g/L时达到最大值,继续增大山梨糖醇的质量浓度强度有所下降,但均高于对照组。
(2)流变学结果显示,山梨糖醇的添加可以增加体系的储能模量,添加量为50 g/L时储能模量达到最大值,与凝胶强度变化规律相同;而损耗模量随山梨糖醇质量浓度的升高而增大,表明山梨糖醇的添加增大了体系的黏性。流变学和差式扫描量热分析结果均显示添加山梨糖醇使明胶的凝胶-溶胶转变温度升高,使凝胶具有更好的热稳定性。
(3)结构分析表明,山梨糖醇主要通过氢键产生相互作用,山梨糖醇的增加会导致原有的明胶分子间或分子内氢键被破坏;当山梨糖醇质量浓度小于50 g/L时,其添加有利于明胶在溶液中三螺旋结构的恢复,但添加质量浓度超过50 g/L时,三螺旋结构恢复能力明显减弱,原因可能在于高浓度山梨糖醇“抢夺”明胶分子表面水分所致。
——以高中化学“氢键”的教学为例

