细胞外基质金属蛋白酶诱导因子单克隆抗体抑制ApoE(-/-)小鼠动脉粥样硬化形成的实验研究
姚益群 吴勇 申松波 杨浩
动脉粥样硬化(atherosclerosis,As)是动脉硬化血管病中最常见、最重要的一种,是冠心病、脑梗死、外周血管病的主要原因[1-2]。As的特点是其所受累动脉的病变开始于内膜,先后合并有多种病变,包括局部脂质及复合糖类积聚、纤维组织增生以及钙质沉着而导致斑块形成,并渐发生动脉中层退变,其继发性病变尚有斑块内出血、斑块破裂以及局部血栓形成。病变常常累及大、中肌性动脉,一旦发展到其体积足以阻塞动脉管腔,则会导致该所受累动脉所供应的组织或者器官的缺血或坏死[3-4]。在As发生及发展过程中,有着多种危险因素的参与,然而在这诸多危险因素中,高脂血症占首要地位。血脂中的TG,LDL-C水平是判断As的最佳标志[5]。目前针对As所导致的心脑血管疾病的抑制与治疗尚未找到有效预防及治疗手段,现急需寻找一种安全有效,无不良反应并具有良好的社会学效益,且能有效缓解As患者体内血脂代谢紊乱,降低As等血管并发症发病率的新型药物,具有重要的临床意义。
细胞外基质金属蛋白酶诱导因子(extracellular matrix metalloproteinase inducer EMMPRIN),属于免疫球蛋白超家族成员之一,多见于肿瘤细胞表面,可使肿瘤细胞迁移、浸润[6]。有研究表明,EMMPRIN在As斑块内表达较高,并参与了As病变的发展[7]。进来的研究表明,EMMPRIN参与As斑块的破裂[8]。本研究构建ApoE(-/-)小鼠动脉粥样硬化模型,探究EMMPRIN对ApoE(-/-)小鼠动脉粥样硬化的作用,为临床上动脉粥样硬化治疗提供思路与方法。
材料与方法
1.实验动物 6~8周龄,ApoE基因缺失(ApoE(-/-))雄性,小鼠30只(体质量25~33 g),由北京华阜康生物科技股份有限公司提供。6~8周龄雄性,C57BL/6 J小鼠10只(体质量46~59 g),由北京华阜康生物科技股份有限公司提供。
2.方法 (1)建立AS模型:本实验采用8周龄,SPF级雄性,C57BL/6 J小鼠10只和ApoE(-/-)小鼠30只,体质量(25±3)g,购于北京华阜康生物科技服份有限公司,批号11401300014365。置于室温为(22±2)℃,湿度为(60±5)%,自然光照条件下,自由取食饮水。饲以高脂饲料(含21%脂肪和0.15%胆固醇),诱导构建As动物模型,模型成功率80%。
(2)实验分组及给药方法:将小鼠置于实验动物标准条件下饲养,随机分为四组,每笼4~5只小鼠,具体分组情况如下:Ⓐ:空白对照组:雄性C57BL/6 J小鼠10只,普通饲料喂养。Ⓑ:ApoE(-/-)阴性对照组:ApoE(-/-)小鼠10只,普通饲料喂养。Ⓒ:ApoE(-/-)阴性AS组:ApoE(-/-)小鼠10只,高脂饲料喂养。Ⓓ:EMMPRIN单克隆抗体干预组:ApoE(-/-)小鼠10只,高脂饲料喂养,在高脂喂养12周成功诱导出小鼠As后给予100ug EMMPRIN单克隆抗体腹腔注射。所有小鼠适应性喂养1周后,每周2次于08:00~10:00时按上述浓度给药处理,连续给药8周。
(3)标本采集:一般指标:给药期间观察并记录各组小鼠的体质量、摄食量、外观体征、行为活动、毛发状态,精神状态和死亡情况。
(4)血液标本采集:治疗结束第2天,10%水合氯醛腹腔注射麻醉小鼠,经心脏取血1~2 mL,生化采血管收集。静置3 h,4 000rpm离心取血清,4℃保存。
(5)组织标本采集:取血后,每组取10只,摘取小鼠主动脉组织,液氮速冻后,-80℃保存,留待后续实验备用。其余小鼠,摘取主动脉后置于4℃预冷的4%多聚甲醛溶液中固定保存。
(6)冷冻切片的制备:取4%多聚甲醛固定的组织,依次置于20%蔗糖溶液、30%蔗糖溶液,4℃静置梯度脱水。脱水完全的组织,采用OCT包埋剂包埋,置于液氮快速冷冻,冷冻切片机连续切片,厚度为10μm,自然晾干后4℃保存。
3.检测指标和实验方法 (1)血清生化指标检测:采用全自动生化分析仪(CX-7,Beckman)分析下列血液生化指标:TC、TG、氧化低密度脂蛋白、LDIC、HDL-C,载脂蛋白A、B和E,并计算血脂As指数和体脂含量。
(2)实时荧光定量PCR检测:摘取小鼠主动脉组织加入1 mL的Trizol RNA iso(Takara,日本),经研磨棒充分研磨后,提取总RNA,检测总RNA的纯度,在1.9~2.0的范围,利用逆转录试剂盒进行反转录cDNA,4℃保存,采用20μL反应体系进行荧光定量PCR检测。采用FS 2000系统进行分析,反应条件为:95℃30 s。PCR:95℃5s;60℃30 s,40个循环。溶解曲线:95℃5s;60℃1min。降温:50℃30 s,1个循环。内参基因GAPDH、FGP-2和VEGF的引物由上海生工公司设计(表1)。采用2-△△CT的方法计算相对表达量。

表1 目的基因的引物序列
(3)Western-blot检测:摘取小鼠主动脉组织1 mg,加入1 mL RIPA细胞裂解液,冰上裂解30 min,收集入1.5 mL离心管,在4℃离心机中离心,预设:5 000 r/min,5 min后提取上清,后95℃煮沸,4℃保存。按照说明书制备浓缩胶10 mL,分离胶20 mL。上样后电泳分离,转膜,FGP-2和VEGF的一抗经一抗稀释液1:10 000稀释后加入样本离子膜,4℃冰箱避光孵育过夜(>12 h),PBST洗膜,5 min,重复3次,用山羊抗小鼠IgG二抗经稀释液1:1 000稀释后孵育1.5 h,PBST洗膜5 min,重复3次,用DAB显影液处理样本。Image J软件分析蛋白条带。
(4)免疫组化染色:按照中杉金桥超敏二步法试剂盒的说明书对冷冻切片进行操作。加入一抗(VEGF)4℃孵育过夜,TBS漂洗后加入链霉亲和生物素辣根酶(SABC)标记二抗,37℃孵育20 min,DAB显色,阳性细胞呈棕黄色。光学显微下观察,每张切片随机取五个视野,对阳性细胞计数,取其均值。以阳性细胞指数(阳性细胞数/细胞总数)表示蛋白表达水平。
4.统计学方法 应用SPSS统计软件19.0版本进行数据分析。计量资料以均数±标准差表示,四组的比较采用单因素方差分析,两两比较用SNK法检测。以P<0.05为差异有统计学意义。
结果
1.各组血清生化指标的检测结果 在血清学生化指标中的TG、TC、HDL-C、LDL-C的比较中,ApoE(-/-)AS模型组与ApoE(-/-)阴性对照组相比,差异均有统计学意义(P<0.05)。EMMPRIN单克隆抗体干预组与ApoE(-/-)AS模型组的比较中,在TG、TC、LDL-C等指标中,EMMPRIN单克隆抗体干预组明显低于ApoE(-/-)AS模型组,差异有统计学意义(P<0.05)。EMMPRIN单克隆抗体干预组的HDL-C均高于AS模型对照组,差异有统计学意义(P<0.05)。在生化指标中的载脂蛋白A1和载脂蛋白B的比较中,ApoE(-/-)AS模型组与ApoE(-/-)阴性对照组相比,均差异有统计学意义(P<0.05)。EMMPRIN单克隆抗体干预组与ApoE(-/-)AS模型组相比,均差异有统计学意义(P<0.05)。
2.RT-PCR和Western blot检测结果 RT-PCR和Western blot结果显示:AS模型组中VEGF蛋白表达量明显大于空白对照组(P<0.05);阴性对照组中主动脉VEGF蛋白表达量与空白对照组比较差异无统计学意义(P>0.05);EMMPRIN单克隆抗体干预组中主动脉VEGF蛋白表达量明显降低,与AS模型组比较,差异有统计学意义(P<0.05)。
表1 各组血清生化指标检测结果比较(,n=40)

表1 各组血清生化指标检测结果比较(,n=40)
注:与空白对照组比较,*P<0.05;与ApoE(-/-)AS模型组比较,#P<0.05
项目 空白对照组 EMMPRIN单克隆抗体干预组ApoE(-/-)AS模型组ApoE(-/-)阴性对照组例数 10 10 10 10 TG 2.532±0.784 1.613±0.323# 2.324±1.014* 1.796±0.944#TC 3.865±1.315 22.867±5.314*23.461±9.667* 10.666±6.114#HDL 1.256±0.174 4.027±1.645*#3.184±0.949*#2.324±0.951#LDL 0.584±0.124 6.119±2.894* 6.273±2.119* 3.929±0.917#ApoA1 0.010±0.007 0.007±0.001 0.008±0.005 0.001±0.004 ApoB 0.028±0.014 0.028±0.009 0.022±0.017 0.054±0.037
3.各组免疫组织化学分析结果 免疫组化显示,棕黄色阳性颗粒主要表达在模型小鼠主动脉内皮细胞的细胞膜上。空白对照组均未见明显的VEGF蛋白的表达。ApoE(-/-)AS模型组中VEGF蛋白表达量明显大于空白对照组(P<0.05);ApoE(-/-)阴性对照组中主动脉VEGF蛋白表达量与空白对照组比较,差异有统计学意义(P>0.05);EMMPRIN单克隆抗体干预组中主动脉VEGF蛋白表达量明显降低,与As模型组比较,差异有统计学意义(P<0.05)。
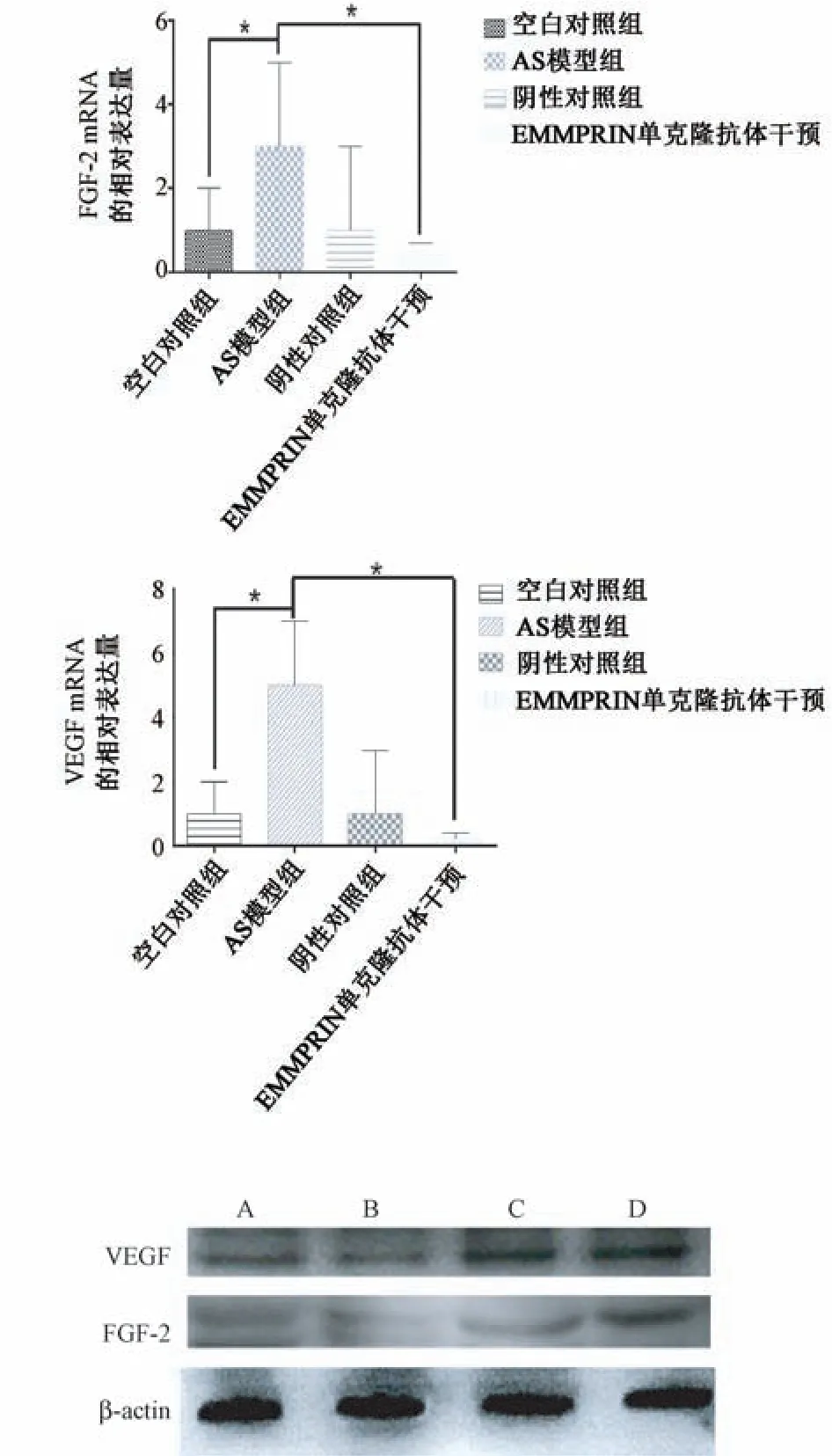
图1 FGP-2的mRNA相对表达量 图2 VEGF的mRNA相对表达量 图3 FGP-2和VEGF蛋白的表达量 A:空白对照组,B:ApoE(-/-)阴性AS组,C:ApoE(-/-)阴性对照组,D:EMMPRIN单克隆抗体干预组

图2 免疫组织化学分析的结果(400X)
讨论
动脉粥样硬化是个逐渐变化的过程,始于内皮细胞的病变,然后伴随脂质沉积、炎症细胞浸润等密切相关[9-11]。本文就EMMPRIN单克隆抗体对于As的作用机制,以及探讨是否作用于细胞的内质网应激机制[12-15]。根据预实验结果选择100μg EMMPRIN单克隆抗体腹腔注射给药。
TG、TC、HDL-C、LDL-C,是导致As和各种心脑血管疾病的首要因素[16]。最近研究认为,LDL-C是唯一能将胆固醇带入血管壁内皮细胞的脂蛋白,是促进As斑块形成的关键物质。本研究通过检测TG、TC、HDL-C和LDL-C的含量来验证造模的成功与否,结果显示,ApoE(-/-)AS组与ApoE(-/-)阴性对照组相比,均差异有统计学意义(P<0.05),证明了实验As模型构建成功。另外,本研究还以TG、TC、HDL-C和LDL-C的含量变化来检测EMMPRIN单克隆抗体对As的治疗作用,结果显示EMMPRIN单克隆抗体治疗组中TG、TC、LDL-C等明显低于ApoE(-/-)AS组,差异有统计学意义(P<0.05),说明EMMPRIN单克隆抗体对As的发展进程具有明显的抑制与治疗作用。EMMPRIN单克隆抗体治疗组的HDL-C均高于AS模型对照组,差异有统计学意义(P<0.05),说明EMMPRIN单克隆抗体对于以HDL-C升高为主的高脂血症与As同样具有一定的抑制与治疗作用。ApoE(-/-)AS组与ApoE(-/-)阴性对照组生化指标中的载脂蛋白A1和载脂蛋白B的比较,均差异有统计学意义(P<0.05),进一步说明了本实验As的构建成功。而EMMPRIN单克隆抗体对于As具有明显的抑制作用。
为探究EMMPRIN单克隆抗体在As的机制中是否与内质网应激[17]相关,本研究采用RT-PCR、Western-Blot和免疫组化等半定量的实验方法,比较内质网应激标志蛋白VEGF蛋白[18]和FGP-2蛋白[19]以上四组细胞中的表达量。空白对照组均未见明显的VEGF蛋白和FGP-2蛋白的表达。EMMPRIN单克隆抗体治疗组中主动脉VEGF蛋白表达量与空白对照组比较,差异有统计学意义(P>0.05),说明EMMPRIN单克隆抗体可以抑制VEGF蛋白的表达,从而证明EMMPRIN单克隆抗体可以通过内质网应激标志蛋白VEGF和FGP-2蛋白作用于动脉的内皮细胞,从而抑制As。
综上所述,EMMPRIN单克隆抗体通过抑制内质网应激VEGF蛋白和FGP-2蛋白的表达发挥其抑制As的作用。

