花椰菜松散型胚性愈伤组织的诱导
史滟滪 刘艳军 杨静慧 牟坤

摘 要:本研究采用花椰菜組培苗不同外植体诱导愈伤组织,从中筛选出理想外植体类型;将诱导出的愈伤组织转移到不同培养基上进行松散型愈伤组织的诱导,从中筛选出理想的培养基配方;将诱导出的花椰菜松散型愈伤组织转接到不同的胚性愈伤组织诱导培养基上,找到理想的培养基配方。试验结果表明,选用花椰菜组培苗茎段为外植体,在MS+0.5 mg·L-1BA+1.0 mg·L-12,4-D+30 g·L-1蔗糖的培养基上进行愈伤组织诱导,可以获得松散型愈伤组织;在MS+1 mg·L-1BA+1 mg·L-12,4-D+30 g·L-1蔗糖的培养基上通过3~4次继代培养,可以诱导出花椰菜松散型胚性愈伤组织。
关键词:花椰菜;外植体;胚性愈伤组织;激素
中图分类号:S635.3 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2019.05.003
Induction of Loose Embryogenic Callus in Cauliflowe
SHI Yanyu1, LIU Yanjun1, YANG Jinghui1, MU Kun2
(1.Department of Horticulture, Tianjin Agricultural University, Tianjin 300384, China;2. Tianjin Yuanda Landscape Engineering Company Limited, Tianjin 301600, China)
Abstract: In this study, the callus was induced by different explants of cauliflower tissue culture seedlings, and the ideal explant type was selected. The induced callus was transferred to different media for the induction of loose callus; The induced cauliflower loose callus was transferred to different embryogenic callus induction medium to find the ideal medium formula. The results showed that the stem segments of cauliflower tissue culture seedlings were used as explants on MS+0.5 mg·L-1BA+1.0 mg·L-12,4-D+30 g·L-1sucrose medium for callus induction, and loose callus was obtained. The cauliflower loose embryogenic callus could be induced by 3~4 subcultures on MS+1 mg·L-1BA+1 mg·L-12,4-D+30 g·L-1sucrose medium.
Key words: cauliflower; explants; embryogenic callus; hormone
花椰菜也叫菜花,是一种广泛种植的蔬菜品种,其营养丰富受到消费者的普遍欢迎。近年来,有关花椰菜的育种研究较多[1-5],培育了许多好的品种。但随着社会的发展,对新的种质资源需求越来越多,采用传统的杂交技术已经不能满足育种的需求,诱变育种和基因转化等新的育种手段相继出现,这些育种技术的应用都需要离体再生技术的辅助,因此建立高效的体细胞再生体系十分必要。
松散型胚性愈伤组织由于其结构松散,不但可以提高诱变和转化效率[6-11],而且胚性愈伤组织易于再生,可在短时间内获得大量的再生植株,从而加快突变株或转化株的成苗率,为体细胞离体诱变和基因转化研究奠定基础。本研究旨在通过选用不同外植体和不同的诱导培养基进行花椰菜松散型胚性愈伤组织诱导,建立高效的花椰菜再生体系。
1 材料和方法
1.1 材 料
本试验所用的花椰菜品种雪剑4号由天津市耕耘种业有限公司提供,经过种子消毒,获得无菌苗。在实验室中继代培养,为试验提供外植体。
1.2 方 法
1.2.1 采用不同花椰菜组培苗部位为外植体诱导愈伤组织 在超净台中剪取花椰菜组培苗的叶片、叶柄和茎段作为外植体。其中叶片用剪刀前成大小2 cm的小块,叶柄两端造成伤口,茎段不要带有侧芽。将处理好的外植体接种到事先配制好的愈伤组织诱导培养基上。培养基的配方为:MS+2 mg·L-12,4-D+30 g·L-1蔗糖,加入7 g·L-1的琼脂粉,pH值调节到5.8。将接过种的三角瓶放置到培养室中进行愈伤组织诱导。愈伤组织诱导条件为:24 h连续光照,采用1 000~2 000 Lux的光照强度,培养温度设置为25 ℃。
1.2.2 诱导愈伤组织的培养基配方筛选 将前一步骤诱导出的花椰菜愈伤组织从外植体上切下,在培养皿中用解剖刀将其分割成直径为2~3 mm大小的颗粒。将分割好的愈伤组织接种到事先配制好的含有不同激素的愈伤组织诱导培养基上,培养基编号依次为1、2、3、4、5、6、7。其具体配方为:1.MS+0.5 mg·L-12,4-D+30 g·L-1蔗糖;2.MS+1.0 mg·L-12,4-D+30 g·L-1蔗糖;3.MS+0.5 mg·L-1BA+30 g·L-1蔗糖;4.MS+0.5 mg·L-12,4-D+0.5 mg·L-1BA +30 g·L-1蔗糖;5.MS+0.5 mg·L-12,4-D+1 mg·L-1BA +30 g·L-1蔗糖;6.MS+1 mg·L-12,4-D+0.5 mg·L-1BA +30 g·L-1蔗糖;7.MS+2 mg·L-12,4-D+1 mg·L-1BA +30 g·L-1蔗糖。愈伤组织培养条件与步骤1相同,接种后大约30 d统计试验结果。
1.2.3 花椰菜胚性愈伤组织的诱导 将上一步骤诱导出的愈伤组织在超净台再次进行分割,并接种到事先配制好的胚性愈伤组织诱导培养基上,培养基编号依次为8、9、10、11、12、13、14、15、16、17。其具体配方为:8.MS+0.5 mg·L-12,4-D+0.5 mg·L-1BA+30 g·L-1蔗糖;9.MS+0.5 mg·L-12,4-D+1 mg·L-1BA+30 g·L-1蔗糖;10.MS+1 mg·L-12,4-D+0.5 mg·L-1BA+30 g·L-1蔗糖;11.MS+1 mg·L-12,4-D+1 mg·L-1BA+30 g·L-1蔗糖;12.MS+1 mg·L-12,4-D+2 mg·L-1BA+30 g·L-1蔗糖;13.MS+0.5 mg·L-12,4-D+0.5 mg·L-1KT+30 g·L-1蔗糖;14.MS+1 mg·L-12,4-D+1 mg·L-1KT+30 g·L-1蔗糖;15.MS+1 mg·L-12,4-D+2 mg·L-1KT+30 g·L-1蔗糖;16.MS+1 mg·L-1BA+30 g·L-1蔗糖;17.MS+1 mg·L-1KT+30 g·L-1蔗糖。在培养过程中采用每14 d继代培养1次,继代用培养基都与前面所用相同,培养条件为:24 h连续光照,采用2 000~3 000 Lux的光照强度,培养温度设置为23 ℃。经过大约3~4次继代培养,对愈伤组织的结构与性质进行鉴定,先采用显微镜观察愈伤组织细胞结构,判断愈伤组织类型;另外采用转接愈伤组织到无激素的MS培养基上,通过愈伤组织的再生情况来判断愈伤组织的胚性。
2 结果与分析
2.1 不同外植体对花椰菜愈伤组织诱导的影响
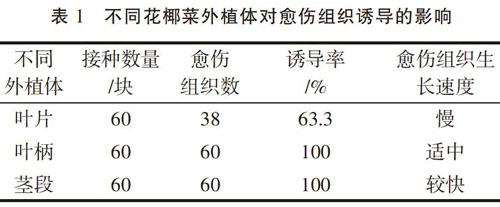
将不同花椰菜外植体接种到愈伤组织诱导培养基上,经过7 d时间,在部分外植体的伤口部位长出少量的愈伤组织,随着培养时间的延长,愈伤组织的数量也在增加,经过30 d的培养,大部分外植体上长出了愈伤组织,具体情况见表1。
从表1的结果可以看出,大部分外植体都可以诱导出愈伤组织,说明花椰菜容易获得愈伤组织。从愈伤组织诱导率来看,除了叶片外,茎段和叶柄愈伤组织诱导率均为100%;从愈伤组织生长速度来看,从叶片上诱导出的愈伤组织生长速度很慢,一般是靠近叶柄部位才有少量愈伤组织长出;叶柄一端诱导出的愈伤组织较多,愈伤组织生长速度也较快,但和茎段相比,愈伤组织生长速度不如茎段,说明茎段是理想的愈伤组织诱导外植体。
2.2 不同激素组合对花椰菜愈伤组织生长的影响
由于上一步骤诱导出的花椰菜愈伤组织多为白色或半透明的紧密型类型,这类愈伤组织生长速度慢,一般很难继续诱导出胚性愈伤组织,为此本试验采用不同激素组合的愈伤组织诱导培养基对这类愈伤组织继续培养,目的是获得理想的愈伤组织类型。愈伤组织经过大约30 d的培养,在不同培养基中愈伤组织的生长情况明显不同,具体结果见表2。
从表2可以看出,不同激素配比花椰菜愈伤组织生长速度和生长质量不同。单独使用2,4-D时(1号和2号培养基)愈伤组织生长缓慢,诱导出的愈伤组织为白色紧密型愈伤组织,这类愈伤组织很难再生和胚性化,是一种不能继续分化的愈伤组织类型;在2,4-D与BA的比值较低时,即高浓度的BA和低浓度的2,4-D配合使用时(3号、4号和5号培养基),愈伤组织生长缓慢,愈伤组织质地较硬,为绿色或白色愈伤组织,这类愈伤组织虽然可以再生,但只是愈伤组织外围少数细胞可以再生,在其内部多数进行组织分化,形成维管组织并纤维化,最后木质化后细胞死亡。这类愈伤组织也不是我们需要的类型;在2,4-D与BA的比值较高时(6号和7号培养基),诱导出的愈伤组织生长速度较快,愈伤组织结构也变得松散,多为淡绿色愈伤组织,这类愈伤组织一般很容易再生,可以进一步培养成胚性化愈伤组织,并且其结构松散,再生效率变得更高,这类愈伤组织正是我们需要诱导的愈伤组织类型。综合以上试验结果,MS+0.5 mg·L-1BA+1 mg·L-12,4-D+30 g·L-1蔗糖的培养基为理想的花椰菜愈伤组织诱导培养基。
2.3 不同培养基配方对花椰菜愈伤组织胚性化的影响
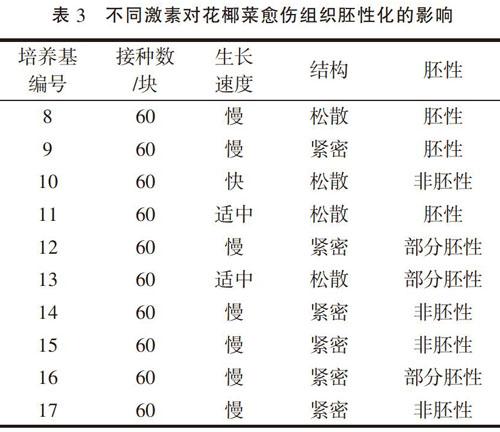
将上一步骤获得的松散型花椰菜愈伤组织,转接到胚性化愈伤组织诱导培养基上,进行愈伤组织胚性化的诱导。经过大约60 d时间,4次继代培养,每次继代时通过对愈伤组织的选择,每种培养基获得的愈伤组织生长效果不同,具体情况见表3。
从表3可以看出,采用不同分裂素与2,4-D配合使用对花椰菜愈伤组织结构、生长速度和胚性化影响较大(8、11、13号培养基)。具体来看,在单独使用分裂素时,愈伤组织生长变慢,愈伤组织质地变得紧密,经过BA的处理后,愈伤组织变成绿色,并随着培养时间的延长,在愈伤组织表面出现芽原基和再生出不定芽,只是数量较少,而采用KT时,随着培养时间的延长,愈伤组织开始褐变并逐渐死亡。这说明单独使用分裂素会促进愈伤组织提早分化,并且KT可能對花椰菜产生了毒害作用,不但不能促进花椰菜愈伤组织分化,反而加快了愈伤组织老化、死亡;采用KT与2,4-D配合使用时(14、15号培养基),在较低浓度的KT时愈伤组织生长正常,只是不能出现胚性化,而在较高浓度的KT时,不但不能出现胚性化现象,相反,愈伤组织生长缓慢,变得紧密,并出现褐变情况,说明KT对花椰菜胚性化没有作用,高浓度还会造成愈伤组织褐变死亡;当采用BA与2,4-D配合使用时,在适合的浓度配比下(1 mg·L-1BA+1 mg·L-12,4-D)(11号培养基),愈伤组织结构松散,生长速度适中,而且所有愈伤组织都呈现出胚性化现象,说明BA是诱导花椰菜胚性愈伤组织的理想分裂素。因此,综合以上试验结果,选择MS+1 mg·L-1BA+1 mg·L-12,4-D+30 g·L-1蔗糖的培养基上通过3~4次继代培养,可以诱导出花椰菜胚性愈伤组织。
3 结论与讨论
3.1 不同分裂素与2,4-D的比值对于愈伤组织结构特性的影响
在本试验中,通过采用不同分裂素与2,4-D的使用浓度的比值,可以获得理想的愈伤组织结构类型,主要原理是:一般情况下,2,4-D对于愈伤组织细胞的分裂与增大生长有较强的促进作用,并可以维持细胞的结构特点,即细胞液泡较大、细胞比较薄,细胞质浓度较低;因此,单一使用2,4-D会维持愈伤组织类型不变,但对于细胞的分化不利。一些质地较硬、结构松散的愈伤组织是由一些个体较小、分裂旺盛、液泡较小,细胞壁增厚的细胞类型组成,因此,在培养基中加入适当的分裂素就会改变细胞的类型,从而获得理想的愈伤组织,但并不是简单加入分裂素就可以起到对愈伤组织结构进行有目的的调整,应该采用适当的比例,才能控制愈伤组织不会向着极端方向转变,如试验中出现的结果,是在适合的比值下才会获得理想的结果。
3.2 不同分裂素种类对愈伤组织胚性化的影响
通常情况下,在分裂素水平较高的情况下可以促进细胞的分化,也就是可以改变愈伤组织细胞的性质,向着胚性化方向或其他组织分化方向转变,而2,4-D是一种维持细胞的愈伤组织特性和促进细胞生长的一种激素,因此,获得胚性化的愈伤组织的必要条件就是分裂素配合一定浓度的2,4-D。但并不是所有分裂素都能促进愈伤组织细胞的胚性化,如本试验中采用的KT分裂素就不能使花椰菜愈伤组织胚性化,相反还对愈伤组织有一定的毒害作用,这说明不同植物对激素的选择是不一样的,通过选择不同的分裂素,观察其对愈伤组织生长的影响来判断选择的正确性,因此,本试验采用BA可以获得理想的花椰菜胚性愈伤组织。
通过以上试验,笔者获得了雪剑菜花松散型胚性愈伤组织诱导方法,现将其操作步骤总结如下:选用花椰菜组培苗茎段为外植体,将其剪成小段,不带腋芽;在MS+0.5 mg·L-1BA+1.0 mg·L-12,4-D+30 g·L-1蔗糖的培养基上进行愈伤组织的诱导。经过大约30 d时间可以诱导出花椰菜结构良好的愈伤组织;再将诱导出的愈伤组织切成小块,在MS+1 mg·L-1BA+1 mg·L-12,4-D的培养基上进行培养,通过3~4次继代培养,可以诱导出花椰菜胚性松散型胚性愈伤组织。
参考文献:
[1]邰翔.花椰菜非毛花基因RAPD标记转SCAR标记[C]// 中国园艺学会.中国园艺学会2015年学术年会论文摘要集,2015.
[2]楼珏,张小玲,罗天宽,等.利用SSR和SRAP标记分析花椰菜自交系的遗传多样性[J].分子植物育种,2015,13(3):605-614.
[3]胡立敏,陶兴林,朱惠霞,等.花椰菜新品种圣雪3号的选育[J].中国蔬菜,2015(1):55-56.
[4]林珲,朱海生,陈敏氡,等.花椰菜游离小孢子培养技术研究进展[J].中国农学通报,2014,30(13):71-75.
[5]黄俊轩,刘艳军,李建科,等.以花椰菜花球为外植体的离体再生体系的建立[J].北方园艺,2014(5):88-90.
[6]严小峰,刘艳军,黄俊轩,等.冰灯玉露松散型胚性愈伤组织的诱导方法[J].天津农业科学,2017,23(7):21-24,36.
[7]国秀丽.棉花根系形态和磷效率对土壤盐度、供磷强度和AM真菌的响应[D].北京:中国农业大学,2017.
[8]史滟滪,楊静慧,刘婷,等.马铃薯松散型胚性愈伤组织的诱导[J].天津农业科学,2016,22(12):20-23.
[9]刘艳军,张超,杨静慧,等.塔杨松散型均质胚性愈伤组织培养体系[J].植物研究,2016,36(1):123-128,133.
[10]苗博瑛,刘艳军,杨静慧.黑莓松散型胚性愈伤组织的诱导[J].山西农业科学,2014,42(3):209-212,216.
[11]赖钟雄,黄浅,林秀莲,等.荔枝胚性悬浮细胞系的快速建立及其体胚植株的再生[J].中国农学通报,2007(1):28-32.

